Biologische Öle unterscheiden sich von Erdölen („normaler“ Dieselkraftstoff) in molekularer Struktur und Eigenschaften.

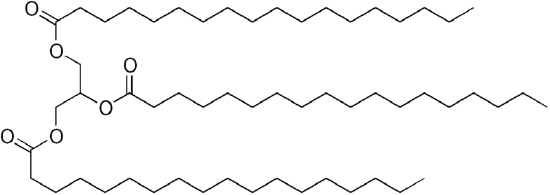
Gewöhnlicher Erdöldieselkraftstoff ist eine Mischung aus einfachen Kohlenwasserstoffen mit der durchschnittlichen chemischen Formel C12H23 (siehe unten), aber die Komponenten können ungefähr von C10H20 (Dodecan) bis C15H28 (Pentadecan). Im Gegensatz dazu sind biologische Öle „Triglyceride“ (klassifiziert als „Ester“) wie das unten gezeigte Glyceryltrilinoleat:
| C12H23, Dodekan | Ein Triglycerid: Glyceryltrilinoleat |
Aufgrund ihrer Größe und der daraus resultierenden großen intermolekularen Anziehungskraft ist die Viskosität biologischer Öle für den Einsatz in herkömmlichen Dieselmotoren im Allgemeinen zu hoch. Biologische Öle brennen auch etwas weniger leicht und mit einer wärmeren Flamme als Erdöldiesel. Biologische Öle können in herkömmlichen Dieselmotoren verwendet werden, wenn sie zur Verringerung ihrer Viskosität vorgewärmt werden, dies erfordert jedoch eine elektrische Zusatzheizung, bis sich der Motor erwärmt. Für diese Resons müssen bilogische Öle zur Verwendung als Biodiesel verarbeitet werden.
Ein biologisches Öl ist ein Ester, eine Art organische Verbindung mit der unten gezeigten Atombindung.
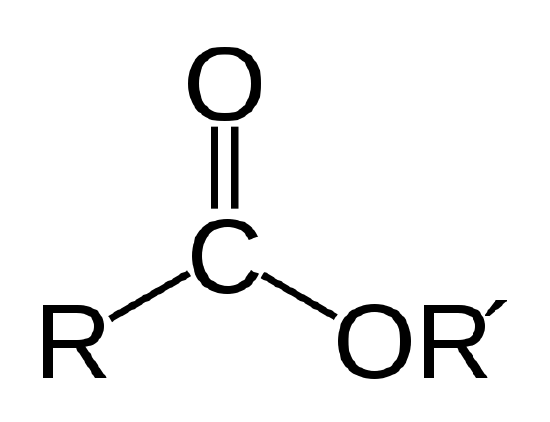 Die Esterbindung. R und R‘ stehen für Ketten von Kohlenstoff- und Wasserstoffatomen. R = -CH3 und R‘ = -C18H35O2 für das Methylstearat in Beispiel 1 |
Glycerin |
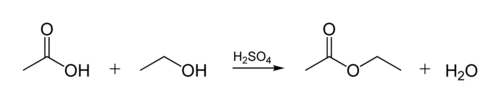
Die Esterbindung in biologischen Ölen entsteht, wenn ein Glycerinmolekül mit organischen Säuren reagiert. Das Glycerinmolekül hat eine Kette von 3 Kohlenstoffatomen mit jeweils einer -OH (Alkohol) -Gruppe. Die folgende Abbildung zeigt, wie ein organischer Alkohol mit einer organischen Säure reagiert. Organische Chemiker kürzen molekulare Strukturen ab – die „Zick-Zack“ -Linien in der Abbildung stellen Kohlenstoffketten mit einem C-Atom an jedem „Zick“ oder „Zag“ dar. Jeder Kohlenstoff hat 4 Bindungen, und wenn weniger als 4 gezeigt werden, wird angenommen, dass sie zu H-Atomen gehen. Der Alkohol ist also C2H5OH (Ethanol) und die Säure ist Essigsäure (oder Ethansäure, CH3COOH) in der Abbildung:
Da Glycerin 3 -OH-Gruppen hat, binden sich 3 langkettige organische „Fettsäuren“ an, um das sperrige „Triglycerid“ herzustellen.
Aber genauso einfach wie Ester aus Alkoholen und Säuren hergestellt werden können, können sie Alkohole oder Säuren sein. In Gegenwart eines starken Basiskatalysators wie NaOH kann ein Triglycerid mit 3 kleinen Alkoholmolekülen wie Methanol (CH3OH) reagieren, die das Glycerin- „Rückgrat“ ersetzen, wodurch 3 separate Ester mit niedrigerem Molekulargewicht hergestellt werden
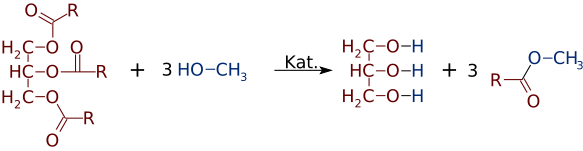
Ziemlich oft wird eine Mischung aus zwei oder mehr Produkten gebildet. Wenn beispielsweise ein Pflanzenöl mit Methanol reagiert, können nur eine oder zwei der Säuren aus dem Glycerin verdrängt werden, wodurch nur 1 oder 2 FAME erzeugt werden.
C3H5 (C18H35O2) 3 + NaOH + 2 CH3OH → C3H5 (C18H35O2) 2 (OH) + 2 C17H35KÜCHE3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH → C3H5(C18H35O2)(OH) 2 + 1 C17H35KÜCHE3 C3H5(C18H35O2) 3 + NaOH + 3 CH3OH → C3H5 (OH) 3 + 3 C17H35COOCH3
Normalerweise wird ein großer Überschuss an Methanol und Natriumhydroxid zugegeben, so dass die Reaktion die maximale Menge an FAME erzeugt.
Im Falle einer Umesterung tritt aber, obwohl keiner der Reaktanten vollständig verbraucht ist, keine weitere Mengensteigerung der Produkte ein. Wir sagen, dass eine solche Reaktion nicht zu Ende geht. Wenn eine Mischung von Produkten hergestellt wird oder eine Reaktion nicht zu Ende geht, wird die Wirksamkeit der Reaktion normalerweise in Bezug auf die prozentuale Ausbeute des gewünschten Produkts bewertet. Eine theoretische Ausbeute wird berechnet, indem angenommen wird, dass das gesamte Begrenzungsreagenz in Produkt umgewandelt wird. Die experimentell ermittelte Produktmasse wird dann mit der theoretischen Ausbeute verglichen und in Prozent ausgedrückt:

BEISPIEL 1: Wenn 100,0 g C3H5(C18H35O2)3-Gas und 15,0 g CH3OH bei 55°C mit NaOH-Katalysator gemischt werden, reagieren sie zu 90,96 g C17H35COOCH3-Methylstearat-Biodiesel. Berechnen Sie den prozentualen Ertrag.
Lösung Wir müssen die theoretische Ausbeute an NH3 berechnen, und dazu müssen wir zuerst herausfinden, ob N2 oder H2 das begrenzende Reagenz ist. Für die ausgewogene Gleichung
C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3 Stearin + Natriumhydroxid + 3 CH3OH → Glycerin + 3 methylstearat
Das stöchiometrische Verhältnis der Reaktanten ist
 Nun sind die Anfangsmengen der beiden Reagenzien gleichund
Nun sind die Anfangsmengen der beiden Reagenzien gleichund Das Verhältnis der Anfangsmengen ist somit
Das Verhältnis der Anfangsmengen ist somit Da dieses Verhältnis kleiner ist als
Da dieses Verhältnis kleiner ist als , gibt es einen Überschuss an CH3OH. Stearin ist das limitierende Reagenz. Dementsprechend müssen wir 0,1122 mol Stearin und 0,3366 mol CH3OH (anstelle von 0) verwenden.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, gibt es einen Überschuss an CH3OH. Stearin ist das limitierende Reagenz. Dementsprechend müssen wir 0,1122 mol Stearin und 0,3366 mol CH3OH (anstelle von 0) verwenden.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.