Wenn Sie Produkte entwickeln — insbesondere medizinische Geräte —, haben Sie die Begriffe Designvalidierung und Designvalidierung gehört (auch V&V). Hier erklären wir, was die beiden Aktivitäten sind, den Unterschied zwischen ihnen und geben Tipps, wie Sie das Beste aus Ihren Bemühungen herausholen können.
Hinweis: Um zu bestätigen, dass dieser Inhalt für Sie nützlich wäre, haben wir uns mit Megan Martin, einer Beraterin für Medizinprodukte V&V mit über 30 Jahren Erfahrung in den Bereichen Medizinprodukte V&V, Medizinprodukte-Software, Produkt- und Softwarequalität sowie US-amerikanische und internationale Zulassungsanträge, in Verbindung gesetzt. Sie werden ihre Einsichten und Beispiele überall finden!
Folgen Sie oder springen Sie zu dem Abschnitt, nach dem Sie suchen:
- Designvalidierung vs. Designverifizierung
- Was ist Designvalidierung genau?
- Was ist Design Verification für die FDA?
- Validation vs Verification Zusammenfassung
- Grundlagen des Designvalidierungsprozesses
- Grundlagen des Designvalidierungsprozesses
- 6 Tipps für eine bessere Validierung & Verification
- Video: Simplify V & V
- V&V: Glossar der Begriffe
- Designvalidierung vs. Designverifizierung: Was ist der Unterschied?
- Was genau ist Designvalidierung?
- Design Validation Example
- Benutzerbedarf
- Was ist Design Verification für die FDA?
- Design Verification Example
- Produktanforderungen
- Konstruktionsspezifikationen
- Validation vs Verification Summary
- Grundlagen des Designvalidierungsprozesses
- Grundlagen des Entwurfsverifikationsprozesses
- Identifizieren und Vorbereiten
- Planung
- Entwicklung
- Ausführen
- Berichterstattung
- 6 Tipps für eine bessere Validierung & Verifizierung
- Planen Sie voraus (und testen Sie frühzeitig)
- Gemeinsame Nomenklatur verwenden
- Tools mit durchgängiger Rückverfolgbarkeit verwenden
- Erstellen Sie Ihre Trace-Matrix, während Sie gehen
- Integrieren Sie die Rückverfolgbarkeit von Anforderungen & Testen mit Anomalie-Tracking
- Wählen Sie Werkzeuge, die Sie an Ihre Methode anpassen können
- Alles zusammenbringen
- Vereinfachen V&V Mit Helix ALM
- V&V: Glossar der Begriffe
- Common Design Validation Acronyms
Designvalidierung vs. Designverifizierung: Was ist der Unterschied?
Was ist der Unterschied zwischen Validierung und Verifizierung? Einfach ausgedrückt, bestimmt die Designvalidierung, ob Sie das richtige Produkt bauen. Funktioniert das Gerät wie für den Endbenutzer vorgesehen? Die Designüberprüfung bestimmt, ob Sie das Produkt richtig bauen. Entsprechen die Design-Outputs den Design-Inputs?
Das ist der einfache Unterschied, wie in der folgenden Grafik deutlich dargestellt.
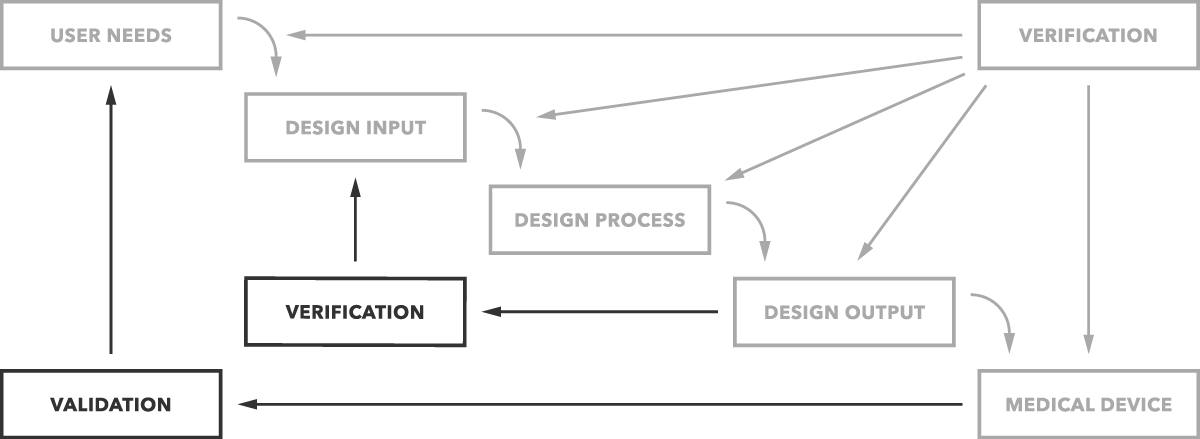
Aber Sie möchten natürlich mehr Details und Beispiele. Wir beginnen mit der Validierung.
Was genau ist Designvalidierung?
Designvalidierung ist ein Testprozess, mit dem Sie nachweisen („validieren“), dass das von Ihnen gebaute Gerät für den Endbenutzer wie vorgesehen funktioniert.Das offizielle Wort der FDA (21 CFR 820.3) besagt, dass die Designvalidierung „durch objektive Beweise feststellt, dass die Gerätespezifikationen den Benutzerbedürfnissen und der beabsichtigten Verwendung (en) entsprechen.“
Design Validation Example
Stellen wir uns vor, wir bauen ein Beatmungsgerät, das einen Patienten am Atmen hält und dass der Benutzer möchte, dass es während des Patiententransports funktioniert.
Zuerst müssen wir unsere Benutzerbedürfnisse definieren. Der Benutzer möchte Patienten bewegen, während sie sich am Beatmungsgerät befinden. Aber was versuchen sie eigentlich zu tun? „Transport“ kann das Bewegen des Patienten innerhalb des Krankenhauses umfassen. Oder könnte den Transport per Krankenwagen oder auf dem Luftweg beinhalten. Ein Benutzerbedarf könnte beispielsweise wie folgt aussehen.
Benutzerbedarf
| UsNe-0001 | Das Beatmungsgerät ist für den Einsatz während des Transports von Patienten im Krankenhaus geeignet. |
Diese Benutzeranforderungen werden in Produktanforderungen und Designspezifikationen unterteilt, um das Produkt zu entwerfen und zu bauen. (Wir werden uns diese gleich unter Design Verification ansehen.)
Lassen Sie uns zuvor unsere Benutzeranforderungen untersuchen und sehen, welche Testfälle zur Designvalidierung erforderlich sein könnten. Validierungstests unseres Benutzerbedarfs könnten so aussehen.
| Benutzer Benötigen |
Validierung Test |
||
|---|---|---|---|
| UsNe-0001 | Das Beatmungsgerät ist für den Transport von Patienten im Krankenhaus geeignet. | TCase-0001 | Validierungstestsuite: Testen Sie, ob das Beatmungsgerät von 15 Mitarbeitern des Krankenhaustransports problemlos gerollt werden kann. |
| TCase-0002 | Validierungstestsuite: Testen Sie, ob das Beatmungsgerät innerhalb seiner Spezifikationen arbeitet, während es durch Flure, über Türstaus und über Aufzugsschwellen gerollt wird. | ||
| TCase-0003 | Validierungstestsuite: Testen Sie, ob das Beatmungsgerät während des Übergangs zwischen Wechselstrom- und Batteriebetrieb innerhalb seiner Spezifikationen arbeitet. | ||
Validierungstests würden Testfälle, Testsuiten oder sogar klinische Studien umfassen, um zu beweisen, dass das Produkt, wie es gebaut wurde, unter den Bedingungen, unter denen es verwendet werden soll, gemäß den Erwartungen des Benutzers funktioniert. Da diese Tests an Produktions- oder produktionsäquivalenten Einheiten durchgeführt werden sollten, sind Designvalidierungstests häufig die letzten durchgeführten Tests.
Grundsätzlich müssen wir bei der Designvalidierung nachweisen, dass das Produkt den Anforderungen des Benutzers entspricht.
Die obige Tabelle zeigt übrigens auch die Nachvollziehbarkeit zwischen Anwenderbedürfnissen und Testfällen. Diese Trace-Matrix liefert einen Teil des V&V-Nachweises, den die FDA benötigt.
Was ist Design Verification für die FDA?
Bei der Designverifizierung testen Sie („verifizieren“), ob Ihre Designausgaben mit Ihren Designeingaben übereinstimmen.
Laut FDA ist die Designverifizierung wiederum „die Bestätigung durch Prüfung und Bereitstellung objektiver Beweise dafür, dass bestimmte Anforderungen erfüllt wurden.“
Denken Sie daran, dass es zwar Tests gibt, aber auch andere akzeptable Überprüfungsaktivitäten.
Sie können Tests, Inspektionen und Analysen umfassen (weitere Informationen hierzu finden Sie in der FDA Design Control Guidance).
Design Verification Example
Kehren wir zu unserem Beatmungsgerät-Beispiel zurück. Wir haben unsere Benutzerbedürfnisse identifiziert; Lassen Sie uns nun herausfinden, was das Gerät tun muss und wie es es tun muss.
Um dies zu erreichen, müssen wir spezifische Produktanforderungen definieren. Zum Beispiel:
- Was ist die maximale Belastung für einen Patienten? (Wie viel Luft muss das Beatmungsgerät bewegen?)
- Wie lange muss der Akku halten? (Wie lange dauert der Transport?)
- Auf welche Bedingungen werden sie während des Transports stoßen? (Tür klemmt? Aufzüge?)
- Gibt es regulatorische Standards, die erfüllt werden müssen? (Sicherheitsstandards?)
„Klare, vollständige, eindeutige, testbare Anforderungen sind eine Schlüsselkomponente in einem erfolgreichen Entwicklungsprojekt. Unzureichende Anforderungen führen zu Zeitverschwendung, Konstruktionsfehlern, umfangreichen Nacharbeiten und zerbrechlichen oder fehleranfälligen Produkten.“ -Megan Martin, V&V Consultant
Dies ist der „Was“ -Teil der Definition von Geräteeigenschaften. Was genau muss das Gerät tun? Produktanforderungen (oft in einem Produktanforderungsdokument enthalten) für unsere Benutzeranforderungen könnten wie folgt aussehen.
Produktanforderungen
|
PrRq-0001 |
Das Beatmungsgerät muss eine maximale Einstellung von 2-Liter-volumengesteuerten Atemzügen bei 20 Atemzügen pro Minute haben. |
|
PrRq-0002 |
Das Beatmungsgerät muss mindestens 90 Minuten lang mit maximaler Batterieleistung betrieben werden. |
|
PrRq-0003 |
Das Beatmungsgerät muss auf einem Rollständer montiert werden können. |
|
PrRq-0004 |
Das Beatmungsgerät und der Ständer müssen in der Lage sein, typische Schwellenwerte für Krankenhaustüren und Aufzüge zu überschreiten. |
Schließlich müssen wir Design-Spezifikation. „Wir haben bereits definiert, was wir erreichen werden, und jetzt müssen wir definieren, wie wir es tun werden“, sagt Megan. Dies kann auf verschiedene Arten erreicht werden, einschließlich schriftlicher Spezifikationen, elektrischer oder mechanischer Zeichnungen, Spezifikationen für den Kauf von Komponenten oder anderer Methoden.
Zum Beispiel könnten die Konstruktionsspezifikationen und Zeichnungen Folgendes zeigen.
Konstruktionsspezifikationen
|
DSpec-0001 |
Eine Turbine, die bis zu 40 Liter Luft pro Minute erzeugen kann. |
|
DSpec-0002 |
Ein Lithium-Ionen-Akku für mindestens 100 Amperestunden. |
|
DSpec-0003 |
Die Halterung für das Walzgerüst verwendet eine Hebelklemme aus Stahl, die für 22 lbs ausgelegt ist. |
|
DSpec-0004 |
Die stand basis ist 22 „breit mit 5 räder. |
|
DSpec-0005 |
Die Stativräder haben einen Durchmesser von 4″. |
Die Designverifizierung liefert den Nachweis (Testergebnisse), dass die Designausgaben (tatsächliches Produkt) den Designeingaben (Produktanforderungen und Designspezifikationen) entsprechen. Je nachdem, welches Element überprüft wird, wird ein Testfall oder eine Testsuite ausgeführt oder eine Inspektion oder Analyse durchgeführt, um die erforderlichen Nachweise zu erbringen.
Die folgenden Tabellen veranschaulichen, wie das aussehen könnte. Sie zeigen auch die Rückverfolgbarkeit, die die FDA erwartet.
| Produktanforderung | Verifikationstest | ||
|---|---|---|---|
| PrRq-0001 | Das Beatmungsgerät muss eine maximale Einstellung von 2-Liter-volumengesteuerten Atemzügen bei 20 atemzüge pro Minute. | TCase-0004 | Testfall: Überprüfen Sie die maximalen Atemeinstellungen oder Kombinationen von Atemeinstellungen. |
| PrRq-0002 | Das Beatmungsgerät muss mindestens 90 Minuten lang mit maximaler Batterieleistung betrieben werden. | TCase-0005 | Testsuite: Überprüfen Sie die Laufzeit bei maximalen Einstellungen mit einem voll aufgeladenen neuen Akku. |
| TCase-0006 | Testsuite: Überprüfen Sie die Laufzeit bei maximalen Einstellungen mit einem Akku, der 50 Ladezyklen durchlaufen hat. | ||
| PrRq-0003 | Das Beatmungsgerät muss auf einem Rollständer montiert werden können. | TCase-0007 | Demonstrationstest: Demonstrieren Sie, dass das Beatmungsgerät am Rollgerüst angebracht und vom Rollgerüst gelöst werden kann. |
| PrRq-0004 | Das Beatmungsgerät und der Ständer müssen in der Lage sein, typische Schwellenwerte für Krankenhaustüren und Aufzüge zu überschreiten. | TCase-0008 | Externer Test: Von einem Prüfdienst durchgeführter Test zur Überprüfung, dass Beatmungsgerät und Ständer gemäß IEC 60601-1 Medical Electrical Standard über einen Schwellenwert gerollt werden können, ohne zu kippen. |
Die Überprüfung der Produktanforderungen wie oben zeigt, dass das Produkt das tut, was wir gesagt haben.
Die Überprüfung der Designspezifikationen, die wir als nächstes zeigen werden, zeigt, dass das Produkt es so macht, wie wir es gesagt haben.
| Konstruktionsspezifikation | Verifikationstest | ||
|---|---|---|---|
| DSpec-0001 | Eine Turbine, die 40 Liter Luft pro Minute erzeugen kann. | TCase-0009 | Testsuite: Überprüfen Sie die Lufterzeugung durch Turbine bei 40 l / min mit Wechselstrom oder Batterie. |
| DSpec-0002 | Ein Lithium-Ionen-Akku für 100 Amperestunden. | TCase-0010 | Inspektion Test: Überprüfen batterie kauf spec zeigt typ ist lithium-ionen. |
| TCase-0011 | Analyse Test: Sammeln test daten und tun daten analyse zu demonstrieren batterie leistung über die lebensdauer der batterie wird erfüllen oder überschreiten 100 Amp Stunden. | ||
| DSpec-0003 | Die Halterung für das Walzgerüst verwendet eine Hebelklemme aus Stahl, die für 22 lbs ausgelegt ist. | TCase-0012 | Inspektion Test: Überprüfen teil spezifikation ist für eine stahl hebel-action clamp bewertet für 22 lbs oder mehr. |
| DSpec-0004 | Die stand basis ist 22 „breit mit 5 räder. |
TCase-0013 |
Testfall: Basisdurchmesser messen; Räder zählen; Raddurchmesser messen |
| DSpec-0005 | Die Standräder haben einen Durchmesser von 4″. | ||
Im Wesentlichen müssen wir bei der Designüberprüfung nachweisen, dass das von uns gebaute Produkt das Produkt ist, von dem wir sagten, dass wir es bauen würden.
Wenn sie zusammen in einem V&V-Bericht gesammelt werden, liefert die Kombination von Verifizierungs- und Validierungstestergebnissen zusammen mit der Rückverfolgbarkeit auf Benutzeranforderungen, Produktanforderungen und Designspezifikationen einen Teil der Beweise, die die FDA benötigt, wenn sie ein Medizinprodukt zur Freigabe einreicht.
Validation vs Verification Summary
Hier ist eine kurze, wenn auch etwas vereinfachte Zusammenfassung der wichtigsten Unterschiede.
|
Design Verification |
Design Validation |
|
Design output is as expected. |
Final design meets user’s needs. |
|
System, subsystem and unit testing. |
System testing. |
|
During development. |
After development. |
|
Test individual module or completed system under any conditions. |
Test conditions per user needs. |
|
Umfasst Systeminspektionen, Analysen und Tests. |
Beinhaltet das Testen von produktionsäquivalenten Einheiten unter realen Einsatzbedingungen. |
|
Enthält Berichte über durchgeführte Tests, Testergebnisse und Rückverfolgbarkeit. Berichte werden geprüft, genehmigt und unterzeichnet. |
Enthält einen Abschlussbericht mit Testergebnissen und Rückverfolgbarkeit, der zur Überprüfung durch die Aufsichtsbehörden bereitsteht. Berichte werden geprüft, genehmigt und unterzeichnet. |
Grundlagen des Designvalidierungsprozesses
Der Designvalidierungsprozess besteht weitgehend aus dem Testen des Geräts. Sie können dies je nach den Umständen auf verschiedene Arten durchführen. Zu den Aktivitäten können gehören:
- Vergleich mit ähnlichen Geräten, die für ähnliche Zwecke arbeiten.
- Simulation von Funktionalität durch mathematische Modellierung.
- Testen des endgültigen Designs, um zu beweisen, dass das System wie in den Benutzeranforderungen definiert funktioniert.
Testplan, Testfälle, Testausführungsaufzeichnungen und Testergebnisse sollten dokumentiert und als Teil der Konstruktionsaufzeichnungen gepflegt werden. Die Validierung in ihrer Gesamtheit ist nicht das Ergebnis einer einzelnen Aktivität, sondern die Sammlung der Ergebnisse aller Validierungsaktivitäten.
Grundlagen des Entwurfsverifikationsprozesses
Die Verifizierung kann auf einen einfachen fünfstufigen Prozess reduziert werden.
Identifizieren und Vorbereiten
Identifizieren Sie den besten Ansatz für die Durchführung der Verifizierung. Definieren Sie, was Sie messen und wie Sie es messen werden. Sie sollten auch die erforderlichen Ressourcen, Arbeitskräfte und Tools für eine erfolgreiche Überprüfung berücksichtigen.
Planung
Die Planung für die Verifizierung erfolgt während des gesamten Projektlebenszyklus. Sie entwickeln den Testplan, der kritische Meilensteine erfasst. Der Plan muss aktualisiert werden, wenn Änderungen an den Entwurfseingaben vorgenommen werden.
Entwicklung
Die Produktentwicklung beginnt! Es wird mit der Methodik der Wahl durchgeführt (Scrum, Wasserfall, Hybrid, etc.). Dieser Teil des Prozesses umfasst auch das Schreiben, Testen und Genehmigen der Testfälle, die zur Überprüfung verwendet werden.
Ausführen
Testprozeduren werden wie geplant ausgeführt. Ungültige Ergebnisse werden dokumentiert und überprüft und entweder akzeptiert oder als Fehler protokolliert. Fehler im Produkt werden behoben und freigegeben, und Regressionstests werden durchgeführt. Eine Rückverfolgbarkeitsmatrix wird erstellt, um zu überprüfen, ob die im Verifikationstestplan identifizierten Konstruktionseingaben getestet und bestanden wurden.
Berichterstattung
Die Berichterstattung erfolgt am Ende jeder Verifizierungsphase. Detaillierte Berichte umfassen Konfigurationsmanagement- und Release-Berichte, Testergebnisse nach Testtyp oder Produktversion sowie Probleme, die während der Verifizierungsaktivität festgestellt wurden. Ein Rückverfolgbarkeitsbericht zur Designverifizierung zeigt die Testergebnisse und die Abdeckung der Anforderungen. Schließlich werden die Überprüfungen nach jeder Designverifizierungsaktivität abgeschlossen und genehmigt.
6 Tipps für eine bessere Validierung & Verifizierung
Hier sind Tipps, um sicherzustellen, dass Sie das Beste aus Ihrer Validierung herausholen & Verifizierungsaktivitäten.
Planen Sie voraus (und testen Sie frühzeitig)
Haben Sie einen soliden Plan im Voraus und binden Sie alle ein. Binden Sie Testingenieure frühzeitig in die Entwicklungsplanung ein, um sicherzustellen, dass Anforderungen und Design klar, vollständig und testbar sind. Megan sagt: „Die frühe Entwicklung von Testmethoden kann Aufschluss über technologische Probleme geben, bevor sie zu großen Hindernissen werden.“ Frühe Testentwicklung kann auch Testwerkzeuge liefern. Diese können dann verwendet werden, um den Produktentwicklungsprozess zu beschleunigen und Testnachweise während formaler Tests bereitzustellen.
Gemeinsame Nomenklatur verwenden
Ihr Team auf die gleiche Seite zu bringen, ist entscheidend für eine erfolgreiche Designvalidierung & Überprüfung. Um auf dieselbe Seite zu gelangen, muss eine gemeinsame Terminologie verwendet werden. Die Verwendung derselben Begriffe beseitigt Verwirrung für Teammitglieder (nicht nur für neue Mitglieder — auch für Veteranen). Sehen Sie sich das Glossar der Begriffe und gebräuchlichen Akronyme unten an, um Ihre Grundlagen der Terminologie zu entwickeln.
Tools mit durchgängiger Rückverfolgbarkeit verwenden
Im einfachsten Fall kann die Rückverfolgbarkeit mit Word-Dokumenten und Tabellenkalkulationen erreicht werden, aber sie erzeugen so viel manuelle Arbeit (und sind so fehleranfällig), dass Sie sich wünschen, Sie hätten mit einem dedizierten Tool begonnen.
„Eine genaue Ablaufverfolgungsmatrix ist von unschätzbarem Wert, wenn Sie eine Regressionsanalyse durchführen, um zu bestimmen, was nach einer Produktänderung oder einer Fehlerbehebung erneut getestet werden sollte.“-Megan Martin, V& V Consultant
Mit einem tool mit starken anforderungen-zu-test-zu-ergebnisse spur fähigkeit wird helfen sie identifizieren löcher in abdeckung und geben frühen warnungen auf zerbrechlich oder ungetestet bereichen in die produkt.
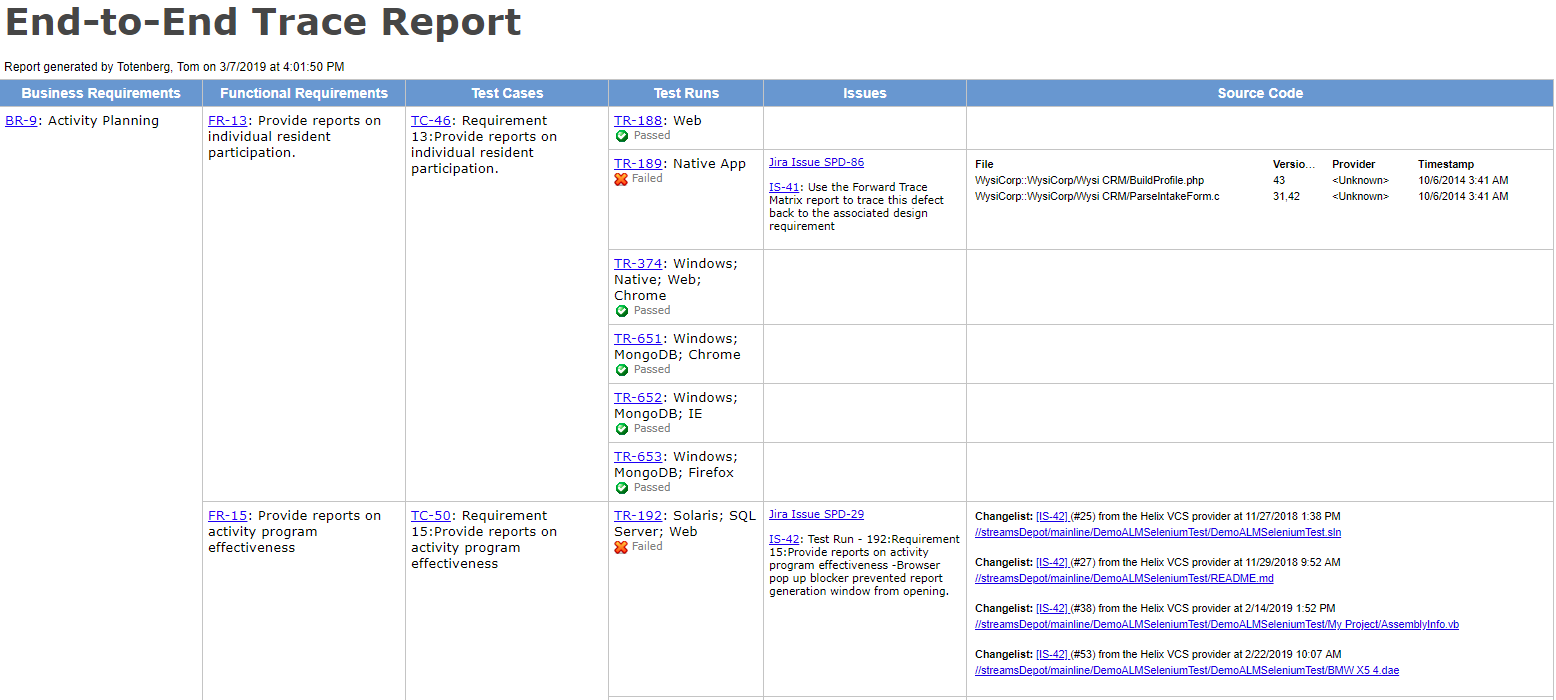
Holen Sie sich jetzt die End-to-End-Rückverfolgbarkeit
Erstellen Sie Ihre Trace-Matrix, während Sie gehen
„Es kann verlockend sein, es aufzuschieben, aber warten Sie nicht, bis Sie Ihre Trace-Matrix erstellt haben!“ sagt Megan. Wenn Sie unterwegs Ihre Rückverfolgbarkeit aufbauen, wird verhindert, dass sich Löcher unbemerkt entwickeln. Es gibt nur wenige Dinge, von denen Sie sich schwerer erholen können, als zu entdecken, dass Sie kritische Anforderungen, risikomindernde Funktionen oder wichtige Tests verpasst haben, wenn Sie glauben, dass Ihre Entwicklungsarbeit abgeschlossen ist.
Es erfordert viel weniger Wartungsaufwand, die Rückverfolgbarkeit Ihrer Anforderungen, Designs und Tests aufrechtzuerhalten, als kritische Lücken in Design und Entwicklung in der 11. Dieser Aufwand kann Ihnen auch dabei helfen, festzustellen, wie viel Arbeit noch übrig ist, wo Sie möglicherweise Entwicklungs- oder Testpersonal hinzufügen müssen oder wann Sie Lieferpläne neu bewerten sollten.
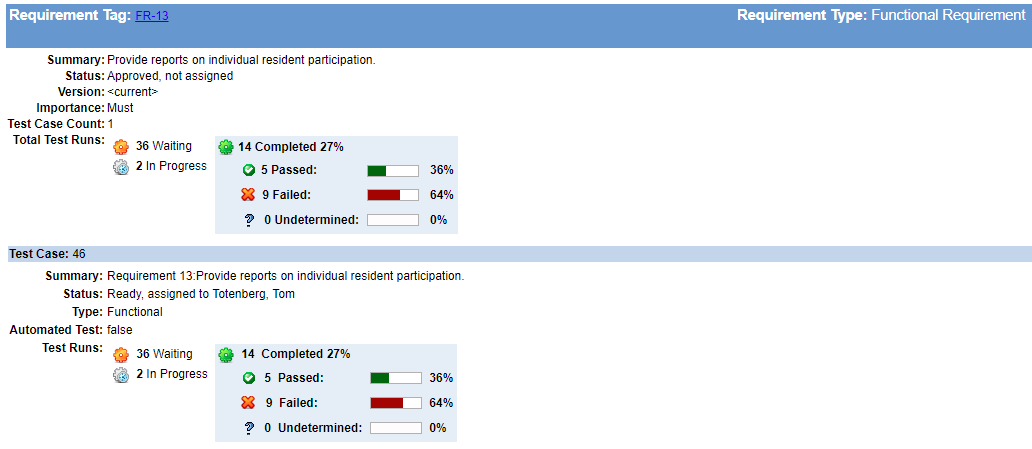
Integrieren Sie die Rückverfolgbarkeit von Anforderungen & Testen mit Anomalie-Tracking
Die Möglichkeit, Anomalien direkt mit einer Anforderung zu verknüpfen, verbessert die Kommunikation zwischen Testern und Entwicklern. Es ist sehr hilfreich. Das Generieren von Anomalien direkt aus einem Testprotokollfehler bedeutet, dass mehr Details zum Problem erfasst werden. Dadurch können Probleme einfacher dokumentiert, reproduziert, behoben und erneut getestet werden.
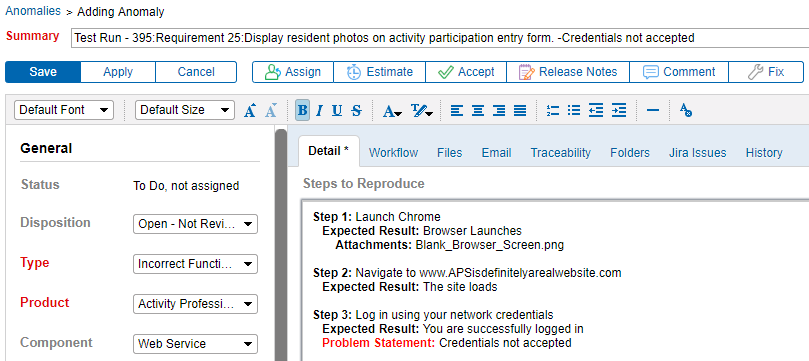
Wählen Sie Werkzeuge, die Sie an Ihre Methode anpassen können
„Unabhängig davon, welches Entwicklungsmodell Sie ausgewählt haben — Agil, iterativ, modifizierter Wasserfall — Sie möchten V&V Werkzeuge, die Ihnen dienen, indem Sie sich an Ihren Prozess anpassen, anstatt Sie zu zwingen, Ihren Prozess an das Werkzeug anzupassen“, rät Megan.
Die von Ihnen gewählten Entwicklungswerkzeuge für medizinische Geräte sollten die Genauigkeit und Effektivität der Arbeit Ihres Teams erhöhen und keinen unnötigen Aufwand für die täglichen Aufgaben verursachen. Ein gutes Werkzeug bietet Leitplanken, um sicherzustellen, dass die wichtigen Dinge immer getan werden. Es gibt Ihrem Team die Flexibilität, Ad-hoc-Ansichten und -Berichte zu erstellen, um die erfassten Daten besser zu nutzen (und zu untersuchen). Es bietet V&V gezielte Datenerfassung und Berichterstellung, um die Erstellung von Berichten einfach und wiederholbar zu machen.
Nehmen Sie sich Zeit, um zu definieren, wie Tools Ihr Team unterstützen sollen, bevor Sie sich entscheiden. Dann lassen Sie Ihre Tools an die Bedürfnisse Ihres Teams anpassen.
Alles zusammenbringen
Designvalidierung und -verifizierung sind wesentliche Bestandteile einer erfolgreichen Geräteentwicklung. Mit dem gemeinsamen Verständnis im Team sowie den richtigen Tools haben Sie einen soliden Rahmen, um Ihr Gerät auf den Markt zu bringen.
SEHEN SIE DIE GANZE DEMO JETZT >>
Vereinfachen V&V Mit Helix ALM
Erfahren Sie, wie Helix ALM die Entwicklung medizinischer Geräte beschleunigen kann.
Explore Helix ALM
*Nochmals vielen Dank an V & V-Expertin Megan Martin, die unschätzbare Einblicke in diesen Blog gegeben hat!
V&V: Glossar der Begriffe
Tatsächliches Ergebnis – Was ein System tatsächlich tut, wenn eine Aktion ausgeführt wird.
Anomalie – Wenn ein System nicht wie erwartet handelt. Zum Beispiel ein Fehler, ein Fehler oder ein Testfehler.
Deliverable – Ein obligatorisches Objekt, das als Ergebnis der Projektausführung erzeugt wird, in der Regel Dokumente in Validierungsbemühungen.Abweichung – Wenn ein Prozess oder eine Prozedur nicht wie definiert ausgeführt werden kann und eine alternative Methode oder ein alternatives Material verwendet wird.
Erwartetes Ergebnis – Was ein System tun soll, wenn eine Aktion ausgeführt wird.
Integrationstest – Tests, die mit zwei oder mehr Subsystemen durchgeführt werden, um die Interaktion und Interdependenzen der Subsysteme zu überprüfen.
Protokoll – Eine Sammlung von Testfällen zur Dokumentation von Systemtests.
Qualifizierung – Ein Testprotokoll, das angibt, dass ein System eine definierte Sammlung von Anforderungen erfüllt.
Qualitätssicherung – Teammitglieder, die mit der Sicherstellung der Produktqualität oder Prozessintegrität beauftragt sind.
Anforderung – Etwas, was ein System können muss.
Retrospektive Validierung – Validierung eines bereits bestehenden Systems.
Spezifikation – Ein Dokument, das die Anforderungen an ein System oder eine Komponente umreißt.
Subsystemtest – Tests, die an einem wichtigen Subsystem oder einer Gruppe von Komponenten durchgeführt werden.
System – Das Ding, das einer Validierung unterzogen wird.
System Owner – Die Person, die letztendlich für ein System verantwortlich ist.
Systemtest – Tests, die mit dem System als Ganzes durchgeführt werden.
Testfall – Ein dokumentiertes Verfahren, mit dem getestet wird, ob ein System eine Anforderung oder eine Sammlung von Anforderungen erfüllt.
Testplan – Eine Testmethode, die entwickelt wurde, um sicherzustellen, dass ein System die Anforderungen erfüllt.
Testschritt – Eine einzelne Zeile eines Testfalls. Es sollte Anweisungen, erwartetes Ergebnis und tatsächliches Ergebnis enthalten.
Rückverfolgbarkeit – Die Fähigkeit, sicherzustellen, dass die in den Spezifikationen beschriebenen Anforderungen getestet wurden. Oft in einer Anforderungsnachverfolgbarkeitsmatrix erfasst.
Unit-Test – Tests, die auf einer Software- oder Hardware-Einheit oder einem Low-Level-Modul durchgeführt werden.
Validierung – Feststellung durch objektiven Nachweis, dass die Gerätespezifikationen den Benutzeranforderungen und dem/den Verwendungszweck(en) entsprechen.
Validierungspaket – Eine Sammlung von Dokumenten, die während eines Validierungsprojekts erstellt wurden.
Verifizierung – Bestätigung durch Prüfung und Bereitstellung objektiver Nachweise, dass bestimmte Anforderungen erfüllt wurden.
V&V Plan – Ein Plan, der die zu überprüfenden und zu validierenden Anforderungen sowie die Arbeitskräfte, verantwortlichen Personen, Werkzeuge, Methoden, Ressourcen und den Zeitplan für die V&V Aufwand.
Common Design Validation Acronyms
CC – Change Control
CCB – Change Control Board (eine Gruppe von Personen, die kontrollieren, welche Änderungen wann vorgenommen werden)
DS – Design Specification
FAT – Factory Acceptance Testing
FS – Funktionale Spezifikation
FRS – Funktionale Anforderungsspezifikation (siehe Funktionale Spezifikation)
GCP – Gute klinische Praxis (Qualitätsrichtlinien für den klinischen Betrieb)
GLP – Gute Laborpraxis (Qualitätsrichtlinien für den pharmazeutischen Laborbetrieb)
GMP – Good Manufacturing Practice (Qualitätsrichtlinien für die Herstellung von Geräten oder Pharmazeutika)
RTM – Anforderungsnachverfolgbarkeitsmatrix
SAD – Softwarearchitekturdokument oder Systemarchitekturdokument
SAT – Site Acceptance Testing
SCCB – Software Change Control Board (wie CCB, aber für Software)
SDD – Software Detail Design Document
SDS – Software Design Specification
Spec – Spezifikation
SRS – Software Requirements Spezifikation
TM – Rückverfolgbarkeitsmatrix
UAT – Benutzerakzeptanzprüfung
URS – Benutzeranforderung Specification
UUT – Unit Under Test
VMP – Validation Master Plan
VP – Validation Plan
V&V – Verification and Validation