- Einführung
- Materialien und Methoden
- Instrumentelle Analyse
- Mikrobielle Kulturen
- Medienzubereitung
- Fermentation von Drostanolone Enanthate (1) mit C. aphidicola ATCC 28300 und F. lini NRRL 2204
- 2α-Methyl-3α,14α,17β-trihydroxy-5α-androstan (2)
- 2α-Methyl-7α-hydroxy-5α-androstan-3,17-dion (3)
- 2α-Methyl-3α,17β-dihydroxy-5α-androstan (4)
- 2-Methylandrosta-1,4-dien-3,17-dion (5)
- 2-Methylandrosta-11α-hydroxy-1,4-dien-3,17-dion (6)
- 2-Methylandrosta-14α-hydroxy-1,4-dien-3,17- dione (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- Ergebnisse und Diskussion
- Struktur Erläuterung
- Zytotoxizität gegen HeLa-, PC3-, H640- und HCT116-Krebs und normale 3T3-Zelllinien
- Struktur-Aktivitäts-Beziehung
- Fazit
- Autorenbeiträge
- Erklärung zum Interessenkonflikt
- Acknowledgements
- Ergänzendes Material
Einführung
Mikrobielle Transformation ist einer der wichtigsten Ansätze für die strukturelle Transformation verschiedener Klassen organischer Verbindungen. Diese Technik wurde erfolgreich in der grünen Chemie eingesetzt, d.h. die Arzneimittelentdeckungs- und Entwicklungsprogramme bieten eine hervorragende Quelle für Verbindungen rund um Kernstrukturen, gefolgt von einem Screening auf verschiedene biologische Aktivitäten. In mehreren Fällen wurde die mikrobielle Transformation als wichtiges Werkzeug für die regio-, chemo- und stereoselektiven Umwandlungen organischer Verbindungen verwendet, die mit herkömmlichen Methoden schwer zu erreichen sind (Holland und Weber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmanska et al., 2005; Borges et al., 2009; Choudhary et al., 2011; Ravindran et al., 2012). Aufgrund der inaktiven Natur des Kohlenwasserstoffgerüsts von Steroiden ist es oft schwierig, sie mit herkömmlichen synthetischen Methoden zu derivatisieren. Daher wird die mikrobielle Transformation häufig für die strukturelle Veränderung von Steroiden verwendet. Das Vorhandensein von P450-Cytochrom-Enzymsystemen in Pilzen macht die Ganzzell-Biokatalyse zu einem effizienten Werkzeug für die stereo- und regiospezifische Hydroxylierung (Choudhary et al., 2005a; Tong und Dong, 2009; Kristan und RiŽner, 2012; Baydoun et al., 2014).Drostanolone und seine Esterableitungen, wie drostanolone-Propionat, drostanolone pentanoate und drostanolone enanthate (1) sind aufbauend-androgene Steroide (AASs) benutzt von den Athleten, um ihre Muskeln zu verstärken, ohne Fett zu gewinnen. Darüber hinaus haben drostanolone und seine Esterableitungen die Fähigkeit, die Produktion des Östrogens zu hemmen. Propionatester von Drostanolon wird auch zur Behandlung von Brustkrebs unter dem Markennamen Masteron (Chowdhury et al., 1976; Clavel et al., 1982; Marinov et al., 1986; Vardar et al., 2002; Bahrke und Yesalis, 2004).
Krebs wird derzeit als große Herausforderung für die öffentliche Gesundheit anerkannt. Krebserkrankungen sind die zweithäufigste Todesursache in den Vereinigten Staaten und auf der ganzen Welt. Nach Angaben der Weltgesundheitsorganisation (WHO) liegt die Prävalenz von Krebs bei mehr als 6 Millionen Fällen pro Jahr. Krebszellen haben eine hohe Proliferationsrate. Sie breiten sich schnell im lebenden System aus und können gegen starke Chemotherapeutika und DNA-schädigende Mittel überleben. In ähnlicher Weise haben Zytostatika viele nachteilige Auswirkungen auf normale Zellen, und daher ist ihre Verwendung in der Krebschemotherapie eine therapeutische Herausforderung. Aus diesem Grund ist die Entwicklung sicherer, wirksamer und selektiver Chemotherapeutika gegen verschiedene Krebsarten dringend erforderlich (Munoz-Pinedo et al., 2012; Su et al., 2015; Swadogo et al., 2015; Rebecca et al., 2016).Brustkrebs ist eine der häufigsten Krebsarten in 140 Ländern der Welt. Es ist eine Hauptursache für krebsbedingten Tod bei Frauen auf der ganzen Welt, gekennzeichnet durch das abnormale Wachstum von Zellen in den Brustläppchen oder Kanälen mit der hohen Proliferationsrate (Hanahan und Weinberg, 2000; Ferlay et al., 2015).Gebärmutterhalskrebs ist die zweithäufigste Krebserkrankung bei Frauen auf der ganzen Welt, nach dem Brustkrebs. Die Hauptursache für Gebärmutterhalskrebs ist die Bildung von malignen Zellen in Geweben des Gebärmutterhalses (Wang et al., 2013; Hafiza und Latifah, 2014; Pariente et al., 2016). Die HeLa-Krebszelllinie, die aus humanen Gebärmutterhalskrebszellen gewonnen wird, ist ein gängiges zelluläres Modell zur Bewertung des zytotoxischen Potenzials von Testverbindungen.Prostatakrebs ist die zweithäufigste Krebserkrankung bei Männern weltweit nach dem Bronchuskrebs und die dritthäufigste Todesursache bei Krebs. Es ist der häufigste Grund für Malignität bei Männern. Die Inzidenz nimmt mit zunehmendem Alter zu, häufiger über 50 Jahre (Henry und Omahony, 1999; De-Bono et al., 2010; Wenbin et al., 2015). Die PC-3-Krebszelllinie, die aus männlichen Prostatakrebszellen gewonnen wird, ist ein weit verbreitetes Modell zur Untersuchung der Toxizität von Testverbindungen.Lungenkrebs ist eine weit verbreitete Krebserkrankung bei Männern in den Vereinigten Staaten seit Mitte der 1950er Jahre und bei Frauen seit den späten 1980er Jahren. Es ist eine der Hauptursachen für krebsbedingte Todesfälle. Lungenkrebs wird meist dem Rauchen zugeschrieben (Travis et al., 2002; Villanti et al., 2013; Mishra et al., 2016). Die H460-Krebszelllinie, die aus humanen Lungenkrebszellen gewonnen wird (lymphogene metastasierende Unterlinie des humanen großzelligen Lungenkarzinoms), wird häufig zur Bewertung der Zytotoxizität von Testverbindungen verwendet.
Nach Brust-, Lungen- und Prostatakrebs ist Darmkrebs die vierthäufigste Krebsart auf der ganzen Welt. Es ist der Krebs in etwa gleicher Häufigkeit bei Männern und Frauen gefunden. Es ist die zweithäufigste Ursache für krebsbedingte Todesfälle in westlichen Ländern (Levin et al., 2008; Andre et al., 2009; Ahearn et al., 2012). Die HCT116-Krebszelllinie, die aus menschlichen Darmkrebszellen gewonnen wird, wird üblicherweise zur Beurteilung der Zytotoxizität von Testverbindungen verwendet.
In Fortsetzung unserer Studien zur pilzlichen Transformation bioaktiver Steroide (Choudhary et al., 2005b,c, 2007, 2010; Ahmad et al., 2014; Siddiqui et al., 2017) synthetisierten wir Analoga von drostanolone enanthate (1) durch seine Umwandlung mit Cephalosporium aphidicola und Fusarium lini. Metaboliten 2-9, sowie Substrat 1, wurden gegen HeLa (Zervixkarzinom), PC-3 (Prostatakarzinom), H460 (Lungenkrebs), HCT116 (Darmkrebs) und 3T3 (Maus Fibroblasten normal) Zelllinien, mit Hochdurchsatz-Zell-basierten Assay, die effizienteste und bequemste Labormethode, die MTT-Assay, um die Reaktion von Testverbindungen bei malignen Erkrankungen vorherzusagen, wo sie Spezifität gegen die Krebszellen zeigten. Diese Studie hat somit Anti-Krebs-Metaboliten von Drostanolone enanthate (1) für weitere Studien identifiziert.
Materialien und Methoden
Instrumentelle Analyse
Dünnschichtchromatographie (DC) (Kieselgel, 20 × 20, 0,25 mm dick, PF254, Merck, Deutschland) wurde für die Analyse von Transformationsgrad und Reinheit verwendet. Zur initialen Reinigung von Metaboliten wurde Kieselgel-Säulenchromatographie (70-230 mesh, E. Merck, Deutschland) verwendet. Zusätzlich wurde präparatives Reverse Phase Recycling (JAI LC-908W, Japan), ausgestattet mit YMC L-80 (4-5 µm, 20-50 mm i.d.), zur Endreinigung von Metaboliten verwendet. Strukturen von Metaboliten wurden mit Hilfe von 1H- (400, 500 und 600 MHz) und 13C-NMR (100, 125 und 150 MHz) Spektren aufgeklärt, die auf Bruker Avance-NMR Spektrometern (Frankreich) in CD3OD, CD3COCD3 oder DMSO-d6 aufgezeichnet wurden. HREI-MS- und IR-Spektren wurden am Massenspektrometer JEOL JMS-600H (Japan) (Double-focusing magnetic sector mass analyzer) (EI, electron impact ionization) bzw. am Spektralphotometer Bruker Vector 22 FT-IR durchgeführt. Optische Rotationen von Metaboliten wurden auf JASCO P-2000 Polarimeter (Japan) aufgezeichnet. Zur Aufzeichnung der UV-Spektren wurde ein UV-sichtbares Spektralphotometer Evolution 300 verwendet. Die Schmelzpunkte der transformierten Produkte wurden mit dem Gerät Büchi M-560 (Schweiz) gemessen. Einkristall-Röntgenbeugungsdaten wurden auf dem Bruker APEXII D8 Venture-Diffraktometer gesammelt, das mit einem PHOTON 100-Detektor (CMOS-Technologie) und einem feinfokussierten versiegelten Röhrchen mit Röntgenquelle (Cu Ka-Strahlung α = 1,54178 Å) ausgestattet war. Reflexionsintensitäten wurden mit der SAINT-Software integriert. Absorptionskorrektur wurde auf Multi-Scan durchgeführt, und Struktur wurde durch SHELXTL Programm gelöst (Gerlier und Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
Mikrobielle Kulturen
Mikrobielle Kulturen von C. aphidicola ATCC 28300 und F. lini NRRL 2204 wurden aus der American Type Culture Collection (ATCC) bzw. Northern Regional Research Laboratories (NRRL) gewonnen. Kulturen wurden auf Sabouraud Dextrose Agar (SDA) Slant gezüchtet und bei 4 ° C gehalten.
Medienzubereitung
Vier Liter Medien für das Wachstum von C. aphidicola ATCC-28300 wurden durch Mischen von 200 g Glucose, 4 g KH2PO4, 8 g Glycin, 4 g KCl, 8 g MgSO4,7H2O und 8 ml Spurenelementen in 4 L destilliertem Wasser hergestellt. In ähnlicher Weise wurden vier Liter Medien für F. lini NRRL 2204 hergestellt, indem 40 g Glucose, 20 g Hefeextrakt, 20 g Pepton, 20 g KH2PO4, 20 g NaCl und 40 ml Glycerin in 4 L destilliertem Wasser gemischt wurden.
Fermentation von Drostanolone Enanthate (1) mit C. aphidicola ATCC 28300 und F. lini NRRL 2204
Medium für das Wachstum von C. aphidicola und F. lini wurde durch Mischen der oben genannten Bestandteile in 4 L destilliertem Wasser für jeden Pilz hergestellt, das dann gleichmäßig in 40 Erlenmeyerkolben von 250 ml (100 ml in jedem Kolben) abgefüllt wurde. Alle diese Kolben wurden bei 121°C autoklaviert und unter sterilisierten Bedingungen mit SDA-Schrägen von C. aphidicola ATCC 28300 und F. lini NRRL 2204 inokuliert. Diese Pilzkultur enthaltenden Kolben wurden auf dem Rotationsschüttler (121 U / min) bei 26 ± 2 ° C für 3-4 Tage belassen, um ein maximales Wachstum von C. aphidicola und F. lini zu erhalten. Verbindung 1 (1 g) wurde für jeden Pilz in 20 ml Aceton gelöst, 0,5 ml in jeden Kolben gegeben und erneut 12 Tage auf einen Rotationsschüttler gestellt. Analog wurden auch eine Negativkontrolle (Medium + Pilzkultur) sowie eine Positivkontrolle (Medium + Substrat) hergestellt, um die Pilzmetaboliten bzw. den Abbau von Verbindung 1 zu bewerten. Nach 12-tägiger Inkubation wurden alle Kolben filtriert und mit 20 L Dichlormethan (DCM) extrahiert, die organische Phase abgetrennt und anschließend am Rotationsverdampfer im Vakuum eingedampft. Man erhielt 1,5 g hellgelbes festes Roh. Dieses Rohmaterial wurde über Kieselgelsäulenchromatographie durch Elution mit Gradientenhexanen und Aceton-Lösungsmittelsystemen fraktioniert. Säulenchromatographie ergab vier Hauptfraktionen (1-4), die dann durch Recycling-HPLC gereinigt wurden. Metaboliten 2 (tR = 16 min, 8 mg, 0,8%), 3 (tR = 19 min, 11 mg, 1,1%), 4 (tR = 17 min, 35 mg, 3,5%), 5 (tR = 23 min, 42 mg, 4,2%), 6 (tR = 20 min, 9 mg, 0,9%), 7 (tR = 21 min, 12 mg, 1,2%) und 9 (tR = 18 min, 5 mg, 0,5%) gereinigt aus den Fraktionen 1-7 durch Reverse Phase Recycling HPLC mit Methanol-Wasser als Lösemittelsystem (MeOH: H2O; 70:30). Während Metabolit 8 aus Fraktion 8 durch Normalphasen-Recycling-HPLC erhalten wurde (tR = 32 min, CHCl3: MeOH; 95: 5, 7.5 mg, 0,75%).
2α-Methyl-3α,14α,17β-trihydroxy-5α-androstan (2)
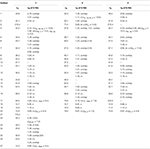
Tabelle 1. 13C- und 1H-NMR chemische Verschiebungsdaten (J und W1/2 in Hz) der Verbindungen 1-3 (δ ppm).
2α-Methyl-7α-hydroxy-5α-androstan-3,17-dion (3)
2α-Methyl-3α,17β-dihydroxy-5α-androstan (4)
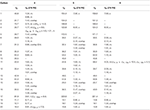
Tabelle 2. 13C- und 1H-NMR chemische Verschiebungsdaten (J und W1/2 in Hz) der Verbindungen 4-6 (δ ppm).
2-Methylandrosta-1,4-dien-3,17-dion (5)
2-Methylandrosta-11α-hydroxy-1,4-dien-3,17-dion (6)
2-Methylandrosta-14α-hydroxy-1,4-dien-3,17- dione (7)
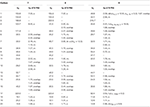
Tabelle 3. 13C- und 1H-NMR chemische Verschiebungsdaten (J und W1/2 in Hz) der Verbindungen 7-9 (δ ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Zelllinien wurden in DMEM F12-Medien gezüchtet, ergänzt mit 10% FBS unter einer 5% CO2-Atmosphäre bei 37 ° C in einem Inkubator.
Der kolorimetrische Assay MTT wurde zur Bewertung der Zellstoffwechselaktivität verwendet. In diesem Test wird das gelbe MTT in den Mitochondrien der lebenden Zellen zu violettem Formazon reduziert (Gerlier und Thomasset, 1986). Je mehr die lebenden Zellen, desto mehr die Farbe und damit mehr Absorption wird durch Kolorimeter beobachtet (Fesahat et al., 2015). Wir haben diese Methode verwendet, um die Wirkung unserer transformierten Produkte auf die zelluläre Zytotoxizität gegen Krebszellen zu analysieren. Etwa 10.000 Zellen jeder Zelllinie (HeLa, PC3, H460, HCT116 normal und 3T3 normal) wurden in 96-Well-Platten ausgesät. Nach Erreichen einer Konfluenz von 80-90% wurden sie mit verschiedenen Konzentrationen von Verbindungen (25, 50, 75, 100 und 200 µM) für 24 h behandelt. Alle Verbindungen wurden in sterilem DMSO gelöst, um eine 200 mm Stammlösung herzustellen. Die Lösung wurde filtriert und in Wachstumsmedium in Serie verdünnt. Von jeder Verdünnung wurden 600 µL verwendet, um 3 Vertiefungen (jeweils dreifach) von 96 Vertiefungen, d. H. Jeweils 200 µL, zu behandeln. Jedes Experiment wurde in drei biologischen Replikaten durchgeführt. MTT wurde zugegeben und für 4 h inkubiert. Nach Entfernung von MTT wurden die violetten Formazonkristalle in DMSO gelöst, und der Messwert wurde bei 540 und 570 nm für normale bzw. Krebszellen beobachtet. Der Multiskan-Reader liefert λmax bei 540 nm in DMSO-behandelten 3T3-Fibroblastenzellen (die in der Morphologie konfluenter sind), während bei Krebszellen 570 nm λmax ergibt (Bonmati-Carrion et al., 2013; Danihelová et al., 2013). In diesem Experiment wurde eine breite Palette von Epithelkarzinomzelllinien verwendet, bei denen Cisplatin ein häufiges Medikament der Wahl war. Es zielt auf DNA ab, stört die Zellteilung während der Mitose und induziert Apoptose (Eastman, 1999). IC50-Werte wurden berechnet, um die Mindestkonzentration zu bestimmen, die erforderlich ist, um 50% der Zellen abzutöten.
Während
At = Extinktionswert der Testverbindung
Ab = Extinktionswert des Rohlings
Ac = Extinktionswert der Kontrolle
Ergebnisse und Diskussion
Struktur Erläuterung
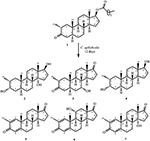
Abbildung 1. Biotransformation von drostanolone enanthate (1) mit Cephalosporium aphidicola.
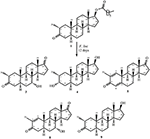
Abbildung 2. Biotransformation von drostanolone enanthate (1) mit Fusarium lini.
Metabolit 2 wurde als weiße Kristalle isoliert. Die Summenformel C20H30O3 basierte auf HREI-MS, die bei m/z 322,2517 (calcd. 322.2508, C20H34O3), was auf die Addition von drei Wasserstoff- und einem Sauerstoffatom, die Reduktion von C-3-Ketoncarbonyl und die hydrolytische Spaltung der Heptanoat-Seitenkette in Substrat 1 hindeutet. Die IR-Absorption bei 3.531 und 3.423 cm-1 war auf das Vorhandensein von Hydroxylgruppen zurückzuführen. Das 1H-NMR-Spektrum zeigte ein zusätzliches Methinprotonensignal bei δ 3,69 (Tabelle 1) (Datenblatt 2). Die Signale für die Heptanoat-Seitenkette fehlten auch im 1H-NMR-Spektrum von Verbindung 2. Das 13C-NMR-Spektrum zeigte Signale für einen neuen Methinkohlenstoff bei δ 71,4 und einen neuen quartären Kohlenstoff bei δ 84,8. Kohlenstoffsignale für Heptanoatkette und Ketoncarbonyl fehlten ebenfalls im 13C-NMR-Spektrum. Dies deutete auf eine Reduktion von C-3-Carbonyl, einen hydrolytischen Verlust der Heptanoatkette und die Zugabe eines OH an C-14 hin (Tabelle 1). Die OH-Gruppe wurde bei C-3 auf der Grundlage von HMBC-Korrelationen von H3-20 (δ 0,91, d) mit C-3 (δ 71,4) platziert (Abbildung 3). Dies resultierte aus der Reduktion von C-3-Carbonyl. Die zweite OH-Gruppe wurde bei C-14 platziert, basierend auf der HMBC-Korrelation von H3-18 (δ 0,81, s) mit C-14 (δ 84,8). Das dritte OH war an C-17, resultierte aus hydrolytischem Verlust der Heptanoateinheit. Die O-H-Gruppe an C-3 wurde basierend auf den NOESY-Korrelationen von H-3 als α-orientiert abgeleitet (δ 3.69, br. s) mit β-orientiertem H-2 (δ 1,64, d) und α-orientiertem H3-20 (δ 0,91, d) (Abbildung 4). Das OH-14 wurde als α-orientiert abgeleitet, basierend auf NOESY-Korrelationen von H-9 (δ 1,32, m) mit OH-14 (δ 2,66, s) (Aceton-d6). Die Einkristall-Röntgenbeugungsanalyse unterstützte ferner die Struktur des Metaboliten 2, der aus drei Ringen in Stuhlkonformation (A, B und C) und einem in Hüllkonformation (D) besteht. Drei OH-Gruppen an C-3, C-14 und C-17 wurden zugewiesen, α-, α- und β-Orientierung (Abbildung 5). Einkristall-Beugungsdaten des Metaboliten 2 wurden der Cambridge Crystallographic Data Collection (CCDC 1500706) vorgelegt. Die Struktur des Metaboliten 2 wurde somit als 2α-Methyl-3α,14α,17β-Trihydroxy-5α-androstan abgeleitet.
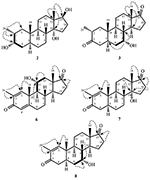
Abbildung 3. Schlüssel HMBC (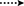 ) und COSY (
) und COSY ( ) Korrelationen in neuen Metaboliten.
) Korrelationen in neuen Metaboliten.
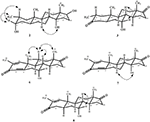
Abbildung 4. Key NOESY Korrelationen in neuen Metaboliten.
Metabolit 3 wurde als weißer Feststoff erhalten. Die HREI-MS zeigte die at m/z 318.2192 (calcd. 318.2195, C20H30O3). Dies stellte den Verlust der Heptanoat-Seitenkette und die Zugabe eines Sauerstoffatoms in Substrat 1 dar. Das IR-Spektrum zeigte Extinktionen für OH (3,436 cm−1) und ketonische Carbonyle (1,711 cm−1). Im 1H-NMR-Spektrum fehlten Signale der Heptanoatkette und des C-17-Methinprotons, wohingegen ein neues Downfield-Methinprotonensignal bei δ 3,92 beobachtet wurde (Tabelle 1) (Datenblatt 3). Dies deutete auf eine Hydroxylierung des Steroidskeletts und eine oxidative Spaltung der Heptanoateinheit hin. Das 13C-NMR-Spektrum unterstützte auch die obigen Schlussfolgerungen. Kohlenstoffsignale für die Heptanoateinheit fehlten, während ein neues ketonisches Carbonyl und ein Oxy-Methin-Signal im 13C-NMR-Spektrum auftraten (Tabelle 1). Dies deutete auf eine oxidative Spaltung der Heptanoatkette und Hydroxylierung in Substrat 1 hin. Das neu erschienene Methinproton bei δ 3,92 (H-7) zeigte HMBC-Korrelationen mit C-5 und C-8, was auf ein OH bei C-7 hindeutet (Abbildung 3). Die HMBC-Korrelationen von H3-18 und H2-16 mit einem Kohlenstoff bei δ 223,8 deuteten auf einen ketonischen Kohlenstoff bei C-17 hin. OH an C-7 wurde weiter durch COSY-Korrelationen von H-7 mit H2-6 und H-8 unterstützt. H-7 (δ 3,92, s) zeigte KEINE SIGNIFIKANTEN Korrelationen mit axial orientiertem H-8 (δ 1,70, s), was auf eine α-Orientierung von OH bei C-7 hindeutete (Abbildung 4). Somit wurde die Struktur des Metaboliten 3 als 2α-Methyl-7α-hydroxy-5α-androstan-3,17-dion abgeleitet.
An den Verbindungen 1 und 5 wurden ebenfalls Einkristall-Röntgenbeugungsanalysen durchgeführt. Verbindung 1 bestand aus vier Ringen, d. H. A, B, C und D mit Stuhl-, Stuhl-, Stuhl- und Hüllkonformationen. An C-2 war ein Methyl mit äquatorialer Ausrichtung vorhanden. Heptanoatesterkette war an C-17 des Rings D vorhanden (Abbildung 6). Während Metabolit 5 die Ringe A, B, C und D in Hobel-, Stuhl-, Stuhl- und Hüllkonformationen enthält. Heptanoat-Seitenkette fehlte in Metabolit 5 (Abbildung 7). Einkristallbeugungsdaten der Metaboliten 1 und 5 wurden der Cambridge Crystallographic Data Collection (CCDC 1500705 bzw. CCDC 1500707) vorgelegt. Einkristall-Röntgenbeugungsanalysedaten der Verbindungen 1, 2 und 5 sind in Tabelle 4 dargestellt.
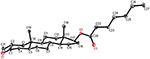
Abbildung 6. Computergenerierte ORTEP-Zeichnung des endgültigen Röntgenmodells von Verbindung 1. Farbcodes: Kohlenstoff, schwarz; Sauerstoff, rot.
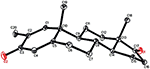
Abbildung 7. Computergenerierte ORTEP-Zeichnung des endgültigen Röntgenmodells von Verbindung 5. Farbcodes: Kohlenstoff, schwarz; Sauerstoff, rot.

Tabelle 4. Einkristall-Röntgenbeugungsanalyse der Verbindungen 1, 2 und 5.
Zytotoxizität gegen HeLa-, PC3-, H640- und HCT116-Krebs und normale 3T3-Zelllinien
Natürliche Produkte, z. B. Flavonoide, Steroide, Terpene usw. kann als eine ausgezeichnete Quelle für die Herstellung vieler Medikamente dienen, da sie für viele biologische Aktivitäten wie Anti-Krebs, entzündungshemmende, Anti-Leishmanial, antibakterielle Aktivitäten, etc. berichtet werden. Daher ist es notwendig, sie zu derivatisieren, um die Struktur-Aktivitäts-Beziehung zu untersuchen, die für die Synthese sicherer und wirksamer Arzneimittel hilfreich sein könnte. Gegenwärtig werden viele pharmazeutische Produkte aufgrund der Anwesenheit einer Reihe von Enzymen in ihnen effizient über mikrobielle Biotransformation synthetisiert. Basierend auf der berichteten Antikrebsaktivität von Drostanolon (9), Drostanolonpropionat und Drostanolonheptanoat (1) wurden die Verbindungen 1-9 auf Zytotoxizität gegen HeLa-, PC-3-, H460- und HCT116-Krebszelllinien untersucht. Interessanterweise zeigten alle Verbindungen eine moderate bis starke Antikrebsaktivität. Die Antikrebsaktivität der Verbindungen 1-9 wurde aus den IC50-Werten gegen HeLa (humanes Zervixkarzinom), PC-3 (humanes Prostatakarzinom), H460 (humanes Lungenkarzinom) und HCT116 (humanes Dickdarmkarzinom) abgeleitet (Tabelle 5). Basierend auf diesen Ergebnissen wurde die Zytotoxizität dieser Verbindungen auch gegen die normale 3T3-Zelllinie (Mausfibroblast) untersucht, wobei alle Verbindungen außer 8 (IC50 = 74,6 ± 3,7 µM) und 9 (IC50 = 62,1 ± 1,2 µM) als nicht zytotoxisch befunden wurden.

Tabelle 5. Zytotoxizität der Verbindungen 1-9 gegen HeLa-, PC3-, H460- und HCT116-Krebs und normale 3T3-Zelllinien.
Struktur-Aktivitäts-Beziehung
Variationen in den Strukturen von Metaboliten beeinflussten ihre Antikrebsaktivität. Metabolit 2 mit der Abwesenheit von Esterteil und zwei aO-H-Gruppen an C-3 und C-14 und eine ßO-H-Gruppe an C-17 zeigte eine geringere Zytotoxizität gegen HeLa, H460 und HCT116 Krebszelllinien, aber seine Anti-Krebs-Aktivität war höher gegen PC-3 Krebszelllinie, im Vergleich zu Verbindung 1. Metabolit 3 mit dem Verlust der Estergruppe und zwei Ketogruppen an C-3 und C-17 und aO-H-Gruppe an C-7 zeigte auch eine geringere Aktivität gegen HeLa, H460 und HCT116 Krebszelllinien, aber erhöhte Aktivität gegen PC-3 Krebszelllinie im Vergleich zu Substrat 1. Die Reduktion von C-3-Carbonyl zu O-H und die hydrolytische Spaltung der Estereinheit in Verbindung 4 erhöhten ihre Aktivität sowohl gegen HeLa- als auch gegen PC-3-Krebszelllinien in gewissem Maße, aber ihre Antikrebsaktivität gegen H460- und HCT116-Krebszelllinien verringerte sich im Vergleich zu Substrat 1. Das Vorhandensein von C = C zwischen C-1 / C-2 und C-4 / C-5, zusammen mit C = O bei C-3 und C-17 machte Metabolit 5 zu einem potenten Antikrebsmittel gegen HeLa-Krebszelllinie im Vergleich zu Substrat 1 und das Standardarzneimittel (Cisplatin). Darüber hinaus war seine Antikrebsaktivität gegen die PC-3-Krebszelllinie im Vergleich zu Substrat 1 ebenfalls erhöht. Interessanterweise war seine Antikrebsaktivität gegen H460- und HCT116-Krebszelllinien im Vergleich zu Verbindung 1 geringer. Das Vorhandensein von C = C zwischen C-1 / C-2 und C-4 / C-5, C = O bei C-3 und C-17 zusammen mit der aO-H-Gruppe bei C-11 im Metaboliten 6 erhöhte seine Antikrebsaktivität gegen HeLa und PC-3 Krebszelllinien im Vergleich zu Substrat 1 und zeigte ein ähnliches Antikrebspotential gegen HeLa Krebszelllinie als Standardarzneimittel (Cisplatin). Seine Antikrebsaktivität gegen H460- und HCT116-Krebszelllinien nahm jedoch im Vergleich zu Verbindung 1 ab. Das Vorhandensein von C = C zwischen C-1 / C-2 und C-4 / C-5, C = O an C-3 und C-17 zusammen mit der aO-H-Gruppe an C-14 im Metaboliten 7 erhöhte erneut seine Antikrebsaktivität gegen HeLa und PC-3 Krebszelllinien und verringerte seine Antikrebsaktivität gegen H460 und HCT116 Zelllinien im Vergleich zu Substrat 1. Das Vorhandensein von C = C an C-1 / C-2, C = O an C-3 und C-17 und aOH an C-7 machte Metabolit 8 zum stärksten Antikrebs gegen HeLa-Krebszelllinie im Vergleich zu Substrat 1 und das Standardarzneimittel (Cisplatin). Es zeigte auch eine gute Aktivität gegen PC-3-Krebszelllinien, verringerte jedoch die Antikrebsaktivität gegen H460- und HCT116-Krebszelllinien im Vergleich zu Substrat 1. Metabolit 9 mit nur Hydrolyse an C-17 zeigte eine erhöhte Antikrebsaktivität gegen HeLa-, PC-3- und HCT116-Krebszelllinien, verringerte jedoch die Zytotoxizität gegen die H460-Krebszelllinie im Vergleich zu Substrat 1 und dem Standardarzneimittel (Cisplatin). Auf der Grundlage der obigen Diskussion kann geschlossen werden, dass eine erhöhte Antikrebsaktivität der Verbindungen 5-8 gegen HeLa- und PC-3-Krebszelllinien wahrscheinlich auf die Anwesenheit von C = C an C-1 / C-2 und Carbonylketon an C-3 und C-17 im Vergleich zu Substrat 1 zurückzuführen ist.
Fazit
Autorenbeiträge
Das Konzept der vorgestellten Forschung wurde von MIC entwickelt und gestaltet. MIC war auch der Projektleiter. Alle Daten wurden von MIC, A-t-W und HC analysiert und interpretiert. MS, SY, MA und NF führten die Experimente durch. MIC, A-t-W und MS schrieben das Manuskript. Alle Autoren haben das Manuskript überarbeitet. Die endgültige Version des Manuskripts wurde vor der Einreichung ebenfalls vom MIC genehmigt.
Erklärung zum Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Acknowledgements
A-t-W und MIC erkennen die befähigende Rolle der Higher Education Commission, Islamabad, Pakistan, durch eine finanzielle Unterstützung im Rahmen von „Studien zur Chemoprävention der Mammakarzinogenese durch diätetische Wirkstoffe“ (20-3790/NRU/R&D/HEC/13/793) an.“ SY erkennt die finanzielle Unterstützung der OPCW (Organisation für das Verbot chemischer Waffen) durch ein Forschungsprojekt mit dem Titel „Strukturelle und biologische Studien zu neuen anabolen Steroiden, die durch Biotransformation erhalten wurden.“ HC erkennt die finanzielle Unterstützung von „The Deanship of Scientific Research (DSR), King Abdulaziz University, Bildungsministerium, Saudi-Arabien.“
Ergänzendes Material
Eastman, A. (1999). „Der Wirkungsmechanismus von Cisplatin: von Addukten zur Apoptose“, in Cisplatin: Chemie und Biochemie eines führenden Krebsmedikaments, ed B. Lippert (Zürich: Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002/9783906390420.ch4
CrossRef Volltext / Google Scholar
Vardar, E., Vardar, SA und Cengiz, T. (2002). Anabol-androgener Steroidmissbrauch. Anato. J. Psychiatrie 3, 104-107.