- Einleitung
- Materialien und Methoden
- Pflanzenmaterialien und Wachstumsbedingungen
- PSI- und PSII-Messungen
- Elektrochrome Verschiebungsanalyse
- Photoinhibitorische Behandlungen
- Statistische Analyse
- Ergebnisse
- Diskussion
- Die Rolle der CEF-Stimulation bei schwachem Licht
- Änderung des P700-Oxidationsverhältnisses bei schwachem Licht hängt nicht mit pmf zusammen
- ETRII steuert das Oxidationsverhältnis von P700 bei schwachem Licht
- Schlussfolgerung
- Autorenbeiträge
- Finanzierung
- Erklärung zum Interessenkonflikt
Einleitung
Obwohl Licht die treibende Kraft der Photosynthese ist, kann hohes Licht eine signifikante Photoinhibition des Photosystems II (PSII) für Blätter schattenbildender Pflanzen verursachen (Kitao et al., 2000; Barth et al., 2001; Krause et al., 2004; Huang et al., 2015b, 2016b,c). Photoinhibited PSII erholt sich jedoch schnell bei schwachem Licht (He und Chow, 2003; Zhang und Scheller, 2004, Allakhverdiev et al., 2005), aufgrund der schnellen Fluktuationsrate von D1-Protein (Aro et al., 1993; Zhang und Scheller, 2004; Allakhverdiev et al., 2005). Die Rate der PSII-Reparatur wurde bei Hemmung der ATP-Synthese entweder über PSI oder PSII reduziert (Allakhverdiev et al., 2005), was darauf hinweist, dass die schnelle reparatur von photodamaged PSII komplexe bedürfnisse eine große menge von ATP in eine kurze zeit. Eine frühere Studie zeigte, dass nach der abkühlungsinduzierten Photoinhibition von PSII der zyklische Elektronenfluss (CEF) während der Erholung bei schwachem Licht signifikant stimuliert wurde (Huang et al., 2010). Es wurde vorgeschlagen, dass diese Stimulation von CEF bei schwachem Licht die Synthese von ATP für die schnelle Reparatur von PSII verbessert (Huang et al., 2010). Es sind jedoch weitere Nachweise erforderlich, um die spezifische Rolle der CEF-Stimulation bei schwachem Licht nach der PSII-Photoinhibition zu klären.
Während der CEF werden Elektronen von NADPH oder Ferredoxin um PSI in den Plastochinonpool geleitet. Dieser Elektronentransfer ist an die Protonentranlokation gekoppelt und erzeugt einen Protonengradienten über Thylakoidmembranen (ΔpH) (Shikanai und Yamamoto, 2017). Eine weitere Funktion von ΔpH ist neben der ATP-Synthese die Herunterregulierung des photosynthetischen Elektronentransports durch Ansäuern des Thylakoidlumens (Shikanai, 2014, 2016). Diese Regelung beinhaltet zwei verschiedene Mechanismen: Einer ist mit der Wärmeenergiedissipation verbunden und leitet überschüssige absorbierte Lichtenergie als Wärme von PSII-Antennen ab (Takahashi et al., 2009), und die andere ist die Herunterregulierung der Cyt b6 / f-Komplexaktivität und steuert die Geschwindigkeit des Elektronentransfers zu PSI (Suorsa et al., 2012, 2016; Tikkanen und Aro, 2014). In Angiospermen einschließlich Arabidopsis thaliana arbeiten zwei Wege des PSI-zyklischen Elektronentransports (Shikanai, 2007). Der erste CEF-Weg ist ein PGR5- / PGRL1-abhängiger Weg, der gegenüber Antimycin A empfindlich ist (Munekage et al., 2002; Sugimoto et al., 2013), und der andere ist abhängig vom Chloroplasten-NADH-Dehydrogenase-ähnlichen (NDH) Komplex (Burrows et al., 1998; Shikanai et al., 1998). Der Beitrag des PGR5- / PGRL1-abhängigen Signalwegs ist in C3-Pflanzen signifikanter. Unter hohem Lichteinfall induziert die Aktivierung von PGR5-/ PGRL1-abhängigem CEF die Ansäuerung des Thylakoidlumens und führt somit zu dem hohen Oxidationsverhältnis von P700 (Suorsa et al., 2012, 2016; Kono et al., 2014; Yamori et al., 2016). Im Vergleich dazu wurde das P700-Oxidationsverhältnis bei schwachem Licht durch den Mangel an PGR5- / PGRL1-abhängigem CEF kaum beeinflusst (Munekage et al., 2002, 2004; Kono et al., 2014). Bei mäßiger PSII-Photoinhibition ging die Stimulation von CEF bei schwachem Licht mit einer Erhöhung der P700-Oxidationsration einher (Huang et al., 2010). Es ist jedoch unklar, ob dieses erhöhte Oxidationsverhältnis von P700 durch die CEF-Stimulation verursacht wird.
Neben CEF spielt der Elektronentransfer von PSII (ETRII) eine wichtige Rolle bei der Beeinflussung des Redoxzustands von PSI (Tikkanen et al., 2014; Huang et al., 2016a,c; Suorsa et al., 2016). In pgr5-Pflanzen von A. thaliana ist eine starke Photoinhibition von PSII wahrscheinlich die ultimative Kontrolle des photosynthetischen Elektronentransfers, die die Aufrechterhaltung von P700 ermöglicht, das unter überschüssigem Licht optimal oxidiert wird (Tikkanen et al., 2014). Kürzlich haben Suorsa et al. (2016) zeigten, dass pgr5-Pflanzen ein hohes P700-Oxidationsverhältnis unter hohem Licht zeigten, wenn der ETRII durch Kombination von Knockout-Mutationen in PsbO1-, PsbP2-, PsbQ1-, PsbQ2- und PsbR-Loci reduziert wurde. In gekühlten Tabakblättern drückte eine moderate PSII-Photoinhibition den Elektronenfluss auf PSI und erhöhte dann das P700-Oxidationsverhältnis während weiterer Kühlbehandlungen (Huang et al., 2016a). Darüber hinaus führte die durch Abkühlung induzierte Photoinhibition von PSII zu einer Depression von ETRII, die mit einem Anstieg des P700-Oxidationsverhältnisses bei schwachem Licht einherging (Huang et al., 2010). Wir nehmen an, dass das Oxidationsverhältnis von P700 bei schwachem Licht hauptsächlich durch den Elektronenfluss von PSII gesteuert wird.
In unserem vorherigen Bericht haben wir beobachtet, dass die schattenbildende Pflanze Panax notoginseng eine selektive Photoinhibition von PSII unter hohem Lichtstress zeigte. Nach kurzfristiger Exposition gegenüber hohem Lichtstress nahm der ETRII bei schwachem Licht signifikant ab, aber die CEF wurde signifikant stimuliert. Gleichzeitig stieg das Oxidationsverhältnis P700 weitgehend an. Unsere spezifischen Ziele waren (1) zu untersuchen, ob die CEF-Stimulation bei schwachem Licht hauptsächlich die Synthese von ATP erleichtert; und (2) Bestimmen Sie, ob der Anstieg des P700-Oxidationsverhältnisses bei mäßiger PSII-Photoinhibition eher mit ETRII als mit der CEF-Stimulation oder der Änderung der pmf zusammenhängt. Um diese Fragen zu beantworten, wurden intakte Blätter von Panax notoginseng 30 min lang mit 2258 µmol Photonen m-2 s-1 behandelt. Vor und nach der High-Light-Behandlung wurden die Energieverteilung in PSII, der Redoxzustand von PSI und die Protonenantriebskraft (pmf) bei schwachem Licht von 54 µmol Photonen m-2 s-1 bestimmt.
Materialien und Methoden
Pflanzenmaterialien und Wachstumsbedingungen
In der vorliegenden Studie wurden 2-jährige Pflanzen einer schattenbildenden Pflanze Panax notoginseng (Burkill) F. H. Chen, C. Chow und W. G. Huang für Experimente verwendet. Diese Pflanzen wurden bei Lichtverhältnissen von 10% Sonnenlicht (mit einer maximalen Lichtintensität von etwa 200 µmol Photonen m-2 s-1) gezüchtet. Für diese Pflanzen wurden keine Wasser- und Nährstoffbelastungen festgestellt. Für die photosynthetischen Messungen wurden 9 Wochen alte, vollständig expandierte Blätter verwendet.
PSI- und PSII-Messungen
Photosystem I- und PSII-Parameter wurden bei 25°C durch gleichzeitige Aufzeichnung mit einem dualen PAM-100-Messsystem (Heinz Walz GmbH, Effeltrich, Deutschland) gemessen. Die Chlorophyllfluoreszenzparameter wurden wie folgt berechnet: Fv/Fm = (Fm – Fo)/Fm, Y(II) = (Fm‘- Fs)/Fm‘ (Genty et al., 1989), NPQ = (Fm – Fm‘)/Fm‘. Fo und Fm sind die minimale bzw. maximale Fluoreszenz nach dunkler Akklimatisierung. Fs ist die lichtangepasste stationäre Fluoreszenz. Fo und Fm wurden nach dunkler Akklimatisierung für 30 min vor und nach der High-Light-Behandlung bestimmt. Die PSI-Photosyntheseparameter wurden mit Dual PAM-100 basierend auf P700-Signal (Intensitätsdifferenz von 830 und 875 nm pulsmoduliertem Messlicht, das den Photodetektor erreicht) gemessen (Klughammer und Schreiber, 2008). Die P700+ -Signale (P) können zwischen einem minimalen (P700 vollständig reduziert) und einem maximalen Pegel (P700 vollständig oxidiert) variieren. Der Maximalpegel (Pm) wurde unter Anlegen eines Sättigungsimpulses (600 ms und 10000 µmol Photonen m-2 s-1) nach Vorbeleuchtung mit fernrotem Licht bestimmt und Pm zur Abschätzung der PSI-Aktivität verwendet. Pm‘ wurde ähnlich wie Pm bestimmt, jedoch mit aktinischem Licht anstelle von fernrotem Licht. Die Quantenausbeute von PSI wurde berechnet als Y (I) = (Pm‘- P)/Pm. Das P700-Oxidationsverhältnis in einem gegebenen aktinischen Licht wurde als Y (ND) = P / Pm berechnet. Die Quantenausbeute der nicht-photochemischen Energiedissipation aufgrund der akzeptorseitigen Begrenzung wurde als Y (NA) = (Pm – Pm‘) / Pm berechnet. Die Steady-State-Werte für Y(II), NPQ, Y(I) und Y(ND) wurden nach leichter Akklimatisierung bei schwachem Licht für 20 min gemessen.
Der photosynthetische Elektronenfluss durch PSI und PSII wurde berechnet als: ETRII = Y (II) ×PPFD ×0,84 ×0,5 (Krall und Edwards, 1992), ETRI = Y (I) ×PPFD×0,84 ×0,5 (Yamori et al., 2011), wobei 0,5 als Anteil des absorbierten Lichts angenommen wird, das PSI oder PSII erreicht, und 0,84 als Absorptionsgrad (der Anteil des einfallenden Lichts, das von Blättern absorbiert wird). Das Ausmaß der CEF-Aktivierung wurde als ETRI/ETRII-Verhältnis geschätzt (Yamori et al., 2011, 2015). Es ist zu beachten, dass die 1: 1-Anregungsverteilung zwischen PSI und PSII möglicherweise nicht real ist, da Schattenpflanzen dazu neigen, das PSII / PSI-Verhältnis zu erhöhen (Lunde et al., 2003; Tikkanen et al., 2006; Grieco et al., 2012). Darüber hinaus wurden in dieser Studie PSI- und PSII-Parameter mit rotem aktinischem Licht (635 nm) von Dual-PAM 100 (Walz, Deutschland) gemessen. Da rotes aktinisches Licht die Anregung von PSII gegenüber der von PSI begünstigt, kann die Anregungsenergieverteilung von LHCII zu PSII und PSI durch das rote aktinische Licht beeinflusst werden (Tikkanen et al., 2017).
Elektrochrome Verschiebungsanalyse
Das ECS-Signal wurde als Extinktionsänderung bei 515 nm mit einem Dual-PAM-100 (Walz, Effeltrich, Deutschland) überwacht, das mit einem Emitter-Detektor-Modul P515 / 535 (Walz) ausgestattet war. Das ECS-Signal wurde nach 20 min Beleuchtung bei 54 µmol Photonen m-2 s-1 erhalten, danach wurde der ECS-Zerfall durch Abschalten des aktinischen Lichts für 30 s gemessen. Die Analyse der ECS-Dunkelintervallrelaxationskinetik (DIRKECS) erfolgte nach der Methode von Sacksteder et al. (2001) und Takizawa et al. (2008). Die Gesamt-PMF wurde aus der Gesamtamplitude des schnellen Abklingens des ECS-Signals während des 300-ms-Dunkelintervalls geschätzt. Die langsame Relaxation des ECS-Signals ermöglichte es, den Beitrag des Protonengradienten über die Thylakoidmembranen (ΔpH) zu erkennen. Die Zeitkonstante der ECS-Relaxation erster Ordnung (tECS) ist umgekehrt proportional zur Protonenleitfähigkeit (gH+) der Thylakoidmembran durch die ATP-Synthase (Sacksteder und Kramer, 2000; Cruz et al., 2005). Als Ergebnis wurde gH + als inverse der Abklingzeitkonstante geschätzt .
Photoinhibitorische Behandlungen
Nach dunkler Akklimatisierung für 30 min wurden Fv/Fm und Pm in intakten Blättern gemessen. Anschließend wurden diese intakten Blätter bei 59 µmol Photonen m-2 s-1 für 20 min lichtadaptiert und Parameter von Chlorophyllfluoreszenz, P700-Signal und ECS-Signal aufgezeichnet. Dann wurde das aktinische Licht auf 2258 µmol Photonen m-2 s-1 geändert. Nach Belichtung mit diesem hohen Licht für 30 min wurde das aktinische Licht sofort auf 59 µmol Photonen m-2 s-1 geändert und die photosynthetischen Parameter wurden nach Lichtakklimatisierung für 20 min aufgezeichnet. Schließlich wurden Fv / Fm und Pm nach dunkler Akklimatisierung für 30 min gemessen.
Statistische Analyse
Die Ergebnisse wurden als Mittelwerte von fünf unabhängigen Experimenten dargestellt. Ein unabhängiger T-Test wurde mit einem Signifikanzniveau von α = 0,05 verwendet, um festzustellen, ob signifikante Unterschiede zwischen verschiedenen Behandlungen bestanden. Alle statistischen Analysen wurden mit SPSS 16.0 durchgeführt.
Ergebnisse
Während der photosynthetischen Induktion bei 59 µmol Photonen m-2 s-1 nahm der ETRII allmählich zu und erreichte nach etwa 18 min einen Steady State (Abbildung 1A). Im Vergleich dazu war ETRI während dieser Induktionsphase konstant (Abbildung 1A). Nach dem Einsetzen dieses schlechten Lichts war ETRI viel höher als ETRII. Nach einer 20-minütigen photosynthetischen Induktion war ETRI jedoch niedriger als ETRII. Diese Ergebnisse deuteten auf die Aktivierung von CEF während der Anfangsphase der Induktion gemäß früheren Studien hin (Joliot und Joliot, 2002, 2005; Makino et al., 2002). Nach dieser photosynthetischen Induktion bei schwachem Licht wurden Blätter bei einem hohen Licht von 2258 µmol Photonen m-2 s-1 für 30 min beleuchtet. Interessanterweise nahm der ETRII während der High-Light-Behandlung allmählich ab (Abbildung 1B). In der Zwischenzeit war der Wert von ETRI höher als der von ETRII (Abbildung 1B), was auf die Aktivierung von CEF unter hohem Lichteinfall hinweist. Nach dieser High-Light-Behandlung wurde das maximal photooxidierbare P700 (Pm) stabil gehalten (Abbildung 2A). Im Vergleich dazu verringerte sich die maximale Fluoreszenzintensität (Fm) um 40% und die maximale Quantenausbeute von PSII (Fv / Fm) von 0,80 auf 0,65 (Abbildungen 2B, C). Diese Ergebnisse zeigten die selektive Photoinhibition von PSII in Blättern von Panax notoginseng unter hoher Lichtbelastung.
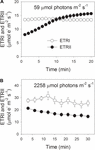
ABBILDUNG 1. Photosynthetischer Elektronenfluss bei schwachem Licht (A) und hohem Licht (B). (A) Dunkel akklimatisierte Blätter wurden 20 min lang einem schwachen Licht von 59 µmol Photonen m-2 s-1 ausgesetzt. (B) Nach Beleuchtung mit 59 µmol Photonen m-2 s-1 für 20 min, um die Elektronensenke in der Photosynthese zu aktivieren, wurden Blätter für 30 min einem hohen Licht von 2258 µmol Photonen m-2 s-1 ausgesetzt. Werte sind Mittelwerte ± SE (n = 5).
Vor der High-Light-Behandlung wurden reife Blätter bei schwachem Licht von 59 µmol Photonen m-2 s-1 für 20 min beleuchtet, um die Photosynthese zu aktivieren, und dann wurden Werte für ETRI, ETRII, Y(ND) und NPQ aufgezeichnet. Nach 30-minütiger High-Light-Behandlung wurden nach einer neuen Akklimatisierungsphase von 20 Minuten bei schwachem Licht Werte für ETRI, ETRII, Y (ND) und NPQ aufgezeichnet. Vor der High-Light-Behandlung lagen die Werte für ETRI und ETRII bei 59 µmol Photonen m-2 s-1 bei 13,4 bzw. 15,7 µmol Elektronen m-2 s-1 (Abbildungen 3A, B). Nach der Behandlung mit hohem Licht waren ETRI und ETRII bei schwachem Licht 12,8 bzw. 11,2 µmol Elektronen m-2 s-1 (Abbildungen 3A, B). Der Wert von ETRII bei 59 µmol Photonen m-2 s-1 nahm nach photoinhibitorischer Behandlung um etwa 30% ab, was auf die Depression von ETRII bei mäßiger PSII-Photoinhibition hinweist. Vor der High-Light-Behandlung betrug der Wert des ETRI / ETRII-Verhältnisses bei 59 µmol Photonen m-2 s-1 0,85 (Abbildung 3C). Nach photoinhibitorischer Behandlung stieg das ETRI / ETRII-Verhältnis signifikant auf 1,14 (Abbildung 3C). Diese Ergebnisse deuteten auf die Stimulation von CEF bei schwachem Licht bei PSII-Photoinhibition hin (Yamori et al., 2011, 2015).
Nach der High-Light-Behandlung änderte sich der Steady-State-Wert von Y(I) bei 59 µmol Photonen m-2 s-1 nicht (Abbildung 4A). Interessanterweise sank Y (NA) signifikant von 0,36 auf 0,23 (Abbildung 4B) und Y (ND) signifikant von 0,1 auf 0,25 (Abbildung 4C). Diese Ergebnisse zeigten die Änderung des Redoxzustands von PSI bei schwachem Licht nach photoinhibitorischer Behandlung. In der Zwischenzeit hat sich der Wert von NPQ geringfügig geändert (Abbildung 4D). Infolgedessen hatte die moderate PSII-Photoinhibition unterschiedliche Auswirkungen auf das Oxidationsverhältnis von P700 und NPQ bei schwachem Licht.
Um zu klären, ob der Anstieg von Y(ND) durch einen Anstieg von pmf verursacht wird, wurden die elektrochromen Shift-Signale bei 54 µmol Photonen m-2 s-1 nach Lichtakklimatisation für 20 min vor und nach der High-Light-Behandlung bestimmt. Interessanterweise verringerte sich der Gesamt-pmf nach der High-Light-Behandlung signifikant um 18% (Abbildung 5A), aber der ΔpH-Wert änderte sich nur unwesentlich (Abbildung 5B). Da die Bildung von pmf durch die Thylakoid-Protonenleitfähigkeit beeinflusst werden kann, wurde die Protonenleitfähigkeit (gH +) der Thylakoidmembran bei diesem niedrigen Licht auch vor und nach einer Behandlung mit hohem Licht untersucht. Das Ergebnis zeigte, dass sich gH + mit der High-Light-Behandlung nicht veränderte (Abbildung 5C), was darauf hindeutet, dass die High-Light-Behandlung die Aktivität der Chloroplasten-ATP-Synthase bei schwachem Licht kaum beeinflusste. Da die Abnahme der ETRII um 30% mit einer Abnahme der pmf um 18% einherging, kompensierte die Stimulation der CEF bei schwachem Licht teilweise die Bildung von pmf und ΔpH.

ABBILDUNG 5. Werte für die gesamte Protonenantriebskraft (pmf) (A), den Protonengradienten (ΔpH) über die Thylakoidmembranen (B) und die Protonenleitfähigkeit (gH +) der Thylakoidmembran (C) bei schwachem Licht. Alle Parameter wurden nach Adaption an 54 µmol Photonen m-2 s-1 für 20 min gemessen. Werte sind Mittelwerte ± SE (n = 5). Sternchen zeigt eine signifikante (P < 0.05) Veränderung nach der High-Light-Behandlung an.
Diskussion
Die Rolle der CEF-Stimulation bei schwachem Licht
Es wurde gezeigt, dass CEF eine wichtige Rolle bei der Aufrechterhaltung der Photosynthese und des Pflanzenwachstums spielt (Yamori und Shikanai, 2016). Unter hohem Lichteinfall wird nun angenommen, dass CEF für den Ausgleich des ATP / NADPH-Energiebudgets sowie für den Schutz von PSI und PSII vor Schäden unerlässlich ist (Munekage et al., 2002, 2004; Takahashi et al., 2009; Suorsa et al., 2012, 2016; Walker et al., 2014; Huang et al., 2015a, 2017b). Bei geringer Lichtintensität spielt CEF eine wichtige Rolle bei der Optimierung der photosynthetischen CO2-Assimilation, wahrscheinlich durch die Zufuhr von zusätzlichem ATP (Yamori et al., 2011, 2015; Nishikawa et al., 2012; Huang et al., 2015a). Die Hauptrolle von CEF wird flexibel in Reaktion auf die Lichtintensität moduliert. Insbesondere trägt CEF hauptsächlich zum Ausgleich des ATP / NADPH-Energiebudgets bei untersättigenden Lichtintensitäten bei, schützt aber hauptsächlich Photosyntheseapparate vor Photoinhibition, wenn sie sättigenden Lichtintensitäten durch Ansäuerung des Thylakoidlumens ausgesetzt werden (Huang et al., 2015a). Interessanterweise haben Huang et al. (2010) fanden heraus, dass CEF nach einer durch Abkühlung induzierten Photoinhibition von PSII bei schwachem Licht signifikant stimuliert wurde, und stellten die Hypothese auf, dass diese CEF-Stimulation hauptsächlich die Synthese von ATP für die schnelle Reparatur von PSII verbesserte. Es waren jedoch weitere Beweise erforderlich, um diese Hypothese zu stützen. In der vorliegenden Studie beobachteten wir, dass der Wert von ETRI / ETRII bei schwachem Licht signifikant anstieg (Abbildung 3C), was auf die Stimulation von CEF um PSI hinweist (Huang et al., 2011, 2012, 2017a,b; Yamori et al., 2011, 2015). Gleichzeitig nahm die Amplitude von pmf signifikant ab und ΔpH nahm leicht ab. Diese Ergebnisse zeigten, dass die Stimulation von CEF die ΔpH-abhängige Herunterregulierung des photosynthetischen Elektronentransports nicht auslöste. Mit anderen Worten, diese Stimulation von CEF bei schwachem Licht erleichterte hauptsächlich die Synthese von ATP.
Obwohl die Protonenleitfähigkeit der Chloroplasten-ATP-Synthase durch die High-Light-Behandlung nicht beeinflusst wurde, führte die geringere Größe des pmf zu einer Abnahme der tatsächlichen Rate der ATP-Synthese. Die Raten der PSII-Reparatur und der photosynthetischen CO2-Assimilation bei schwachem Licht sind hauptsächlich durch die Rate der ATP-Synthese begrenzt (Allakhverdiev et al., 2005; Yamori et al., 2011, 2015; Nishikawa et al., 2012). Da die ETRII bei PSII-Photoinhibition signifikant abnahmen, war die Rate der ATP-Synthese über ETRII bemerkenswert reduziert. Um das für den Primärstoffwechsel erforderliche ATP / NADPH-Verhältnis und die schnelle Reparatur von PSII auszugleichen, ist ein flexibler Mechanismus erforderlich, um zusätzliches ATP bereitzustellen. Unter dieser Bedingung verringerte sich der ETRII um 30%, der gesamte PMF jedoch nur um 18%. Diese Ergebnisse zeigen, dass die Stimulation von CEF die Reduktion der ETRII-abhängigen Bildung von pmf kompensierte und die Synthese von ATP verbesserte. Die schnelle Reparatur von lichtgeschädigtem PSII ist abhängig von der ATP-Synthese (Allakhverdiev et al., 2005). Die Beschleunigung von CEF um PSI erhöhte die intrazelluläre Konzentration von ATP und beschleunigte so die PSII-Reparaturrate bei Synechocystis (Allakhverdiev et al., 2005). Zusammengenommen schlagen wir vor, dass Die Stimulation von CEF bei schwachem Licht spielt eine wichtige Rolle bei der schnellen Reparatur von PSII-Aktivität über eine zusätzliche ATP-Synthese.
Änderung des P700-Oxidationsverhältnisses bei schwachem Licht hängt nicht mit pmf zusammen
Ein interessantes Phänomen ist, dass das P700-Oxidationsverhältnis bei schwachem Licht bei moderater PSII-Photoinhibition signifikant ansteigt (Huang et al., 2010), was auch in der vorliegenden Studie gezeigt wird. Unter Bedingungen, bei denen absorbiertes Licht die Anforderungen für die Photosynthese übersteigt, reguliert die CEF-abhängige Erzeugung von ΔpH die Aktivität der Cyt b6 / f-Komplexaktivität herunter und steuert den Elektronenfluss von PSII zu PSI (Suorsa et al., 2012, 2016; Shikanai, 2014, 2016), Optimierung des Redoxzustands von P700 in PSI und Minimierung der ROS-Produktion in PSI während der Photosynthese. In pgr5-Pflanzen von A. thaliana wird P700 durch Elektronen im Licht aufgrund des Verlustes der pmf-Erzeugung reduziert. In der pgr5-Mutante, die Flavodiiron-Protein akkumuliert, wurde jedoch auch der pmf-Spiegel auf den Wildtyp-Spiegel wiederhergestellt, und somit wurde P700 wie im Wildtyp oxidiert (Yamamoto et al., 2016). In Chlorophyll b-defizienten Weizenmutantenlinien führt ein unzureichender Thylakoid-Protonengradient zu einer Überreduktion der PSI-Akzeptorseite und damit zu einer PSI-Photoinhibition unter hohem Licht oder hoher Temperatur (Brestic et al., 2015, 2016). Kürzlich berichteten einige Studien, dass die erhöhte Aktivität der Chloroplasten-ATP-Synthase die Bildung von pmf beeinträchtigte und die Überreduktion der photosynthetischen Elektronentransportkette verursachte, was zu einer Photodamage von PSI unter hohem Licht und schwankendem Licht führte (Kanazawa et al., 2017; Takagi et al., 2017). Diese Berichte unterstützen die kritische Rolle von pmf bei der Aufrechterhaltung der optimalen Oxidation von P700 unter überschüssiger Lichtenergie.Unsere vorliegenden Ergebnisse zeigten, dass nach der High-Light-Behandlung für 30 min die gesamte pmf, die bei diesem niedrigen Licht gebildet wurde, signifikant abnahm und die Bildung von ΔpH sich leicht veränderte (Abbildungen 5A, B). Währenddessen stieg das Oxidationsverhältnis von P700 signifikant von 0,1 (vor der Behandlung) auf 0,25 (nach der Behandlung) an (Abbildung 4C). Diese Ergebnisse deuten stark darauf hin, dass dieser Anstieg des P700-Oxidationsverhältnisses nicht durch die Änderung des pmf erklärt werden kann, die sich weitgehend von der Korrelation zwischen Y (ND) und pmf unter hohem Licht unterscheidet (Yamamoto et al., 2016; Takagi et al., 2017). Daher ist die regulierende Wirkung von pmf auf das Oxidationsverhältnis von P700 bei schwachem Licht minimal, wird jedoch unter hohem Licht oder schwankendem Licht besonders entscheidend. Unter hohem Lichteinfall geht ein hoher Wert von Y(ND) üblicherweise mit einem hohen Wert von NPQ einher (Munekage et al., 2002, 2004; Kono et al., 2014; Zivcak et al., 2015), aufgrund des Anstiegs der pmf. Die Beeinträchtigung der ΔpH-Bildung führt zu verringerten Spiegeln von Y (ND) und NPQ unter hohem Licht (Suorsa et al., 2012; Kono et al., 2014; Yamamoto et al., 2016; Kanazawa et al., 2017). Die Induktion von NPQ bei schwachem Licht wird hauptsächlich durch den Grad der Lumenversauerung bestimmt. Nach der High-Light-Behandlung änderte sich das Ausmaß der Lumenversäuerung nicht (Abbildung 5B) und der NPQ blieb stabil (Abbildung 4D). Im Vergleich dazu stieg Y (ND) signifikant an. Diese Ergebnisse zeigen, dass Y (ND) und NPQ bei schwachem Licht durch verschiedene Regulationsmechanismen gesteuert wurden.
ETRII steuert das Oxidationsverhältnis von P700 bei schwachem Licht
PSI wird nur dann überreduziert, wenn der Elektronenfluss von PSII die Kapazität der PSI-Elektronenakzeptoren übersteigt, mit den Elektronen fertig zu werden. Wenn der Elektronenfluss zu PSI begrenzt ist, ist PSI in den pgr5-Pflanzen von A. thaliana (Suorsa et al., 2012, 2016; Tikkanen et al., 2014). Für die schattenbildende Pflanze Psychotria rubra war die PSI-Aktivität in Gegenwart von DCMU gegenüber starkem Lichtstress unempfindlich (Huang et al., 2016c). In gekühlten Tabakblättern ermöglichte eine moderate PSII-Photoinhibition die Aufrechterhaltung von P700, das optimal oxidiert wurde, und schützte dann die PSI-Aktivität vor weiterer Lichtschädigung (Huang et al., 2016a). Diese Ergebnisse zeigten die wichtige Rolle von ETRII bei der Kontrolle des Redoxzustands von PSI unter hohen Licht- oder Kühllichtbelastungen. Unsere vorliegenden Ergebnisse zeigten, dass die moderate PSII-Photoinhibition zu einer signifikanten Depression von ETRII bei schwachem Licht führte. Unterdessen änderten sich die PSI-Aktivität und die Aktivität der Chloroplasten-ATP-Synthase geringfügig, und die Gesamt-pmf und ΔpH nahmen nicht zu. Infolgedessen wurde die Reduktion der ETRII nicht durch die ΔpH-abhängige photosynthetische Kontrolle über den Cyt b6 / f-Komplex verursacht, sondern wahrscheinlich durch die Abnahme der PSII-Aktivität induziert (Tikkanen et al., 2014). Die verringerte Elektronenzufuhr von PSII zu PSI führte zu einer erhöhten P700-Oxidation. Somit wurde das P700-Oxidationsverhältnis bei schwachem Licht weitgehend von ETRII gesteuert.
Schlussfolgerung
Wir fanden heraus, dass die selektive Photoinhibition von PSII eine Stimulation von CEF und eine Erhöhung des P700-Oxidationsverhältnisses bei schwachem Licht induzierte. Die Stimulation von CEF löste nicht die ΔpH-abhängige Herunterregulierung des photosynthetischen Elektronentransports aus. Infolgedessen erleichterte diese Stimulation von CEF bei schwachem Licht hauptsächlich die Synthese von ATP, was für die schnelle Reparatur von lichtgeschädigtem PSII unerlässlich ist. Der Anstieg des P700-Oxidationsverhältnisses konnte nicht durch die Änderung der ΔpH-abhängigen Photosynthesesteuerung am Cyt b6 / f-Komplex erklärt werden, sondern wurde hauptsächlich durch die verringerte Elektronenzufuhr von PSII zu PSI verursacht.
Autorenbeiträge
WH, S-BZ und TL konzipierten und gestalteten die Forschung. WH und Y-JY führten die Experimente durch. WH, Y-JY, S-BZ und TL analysierten die Daten. Er schrieb den ersten Entwurf des Manuskripts, das von allen Autoren intensiv bearbeitet wurde.
Finanzierung
Diese Studie wurde von der National Natural Science Foundation of China (31670343), der Youth Innovation Promotion Association der Chinesischen Akademie der Wissenschaften (2016347) und den wichtigsten Wissenschafts- und Technikprogrammen in der Provinz Yunnan (2016ZF001) unterstützt.
Erklärung zum Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit von kommerziellen oder finanziellen Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Kono, M., Noguchi, K. und Terashima, I. (2014). Rolle des zyklischen Elektronenflusses um PSI (CEF-PSI) und O2-abhängiger alternativer Signalwege bei der Regulation des photosynthetischen Elektronenflusses in kurzzeitfluktuierendem Licht in Arabidopsis thaliana. In: Plant Cell Physiol. 55, 990–1004. doi: 10.1093/pcp/pcu033
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Shikanai, T. (2016). Regulatorisches Netzwerk der Protonenantriebskraft: Beitrag des zyklischen Elektronentransports um das Photosystem I. Photosynth. 129, 253-260. ust-idnr.: 10.1007/s11120-016-0227-0
PubMed Abstract / CrossRef Full Text / Google Scholar
Yamori, W., Makino, A. und Shikanai, T. (2016). Eine physiologische Rolle des zyklischen Elektronentransports um das Photosystem I bei der Aufrechterhaltung der Photosynthese unter schwankendem Licht in Reis. Sci. 6:20147. doi: 10.1038/srep20147
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Yamori, W. und Shikanai, T. (2016). Physiologische Funktionen des zyklischen Elektronentransports um das Photosystem I bei der Aufrechterhaltung der Photosynthese und des Pflanzenwachstums. Jahr. In: Plant Biol. 67, 81–106. doi: 10.1146/annurev-arp-043015-112002
PubMed Zusammenfassung | CrossRef Volltext | Google Scholar
Yamori, W., Shikanai, T. und Makino, A. (2015). Photosystem I Der zyklische Elektronenfluss über den Chloroplasten-NADH-Dehydrogenase-ähnlichen Komplex spielt eine physiologische Rolle für die Photosynthese bei schwachem Licht. Sci. Rep. 5:13908. doi: 10.1038/srep13908
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar
Zhang, S. P. und Scheller, H. V. (2004). Photoinhibition des Photosystems I bei Kühltemperatur und anschließende Erholung bei Arabidopsis thaliana. In: Plant Cell Physiol. 45, 1595–1602. doi: 10.1093/pcp/pch180
PubMed Zusammenfassung / CrossRef Volltext / Google Scholar