Dosierungsform: Injektion
Medizinisch überprüft von Drugs.com . Zuletzt aktualisiert am Dezember 22, 2020.
- Nebenwirkungen
- Dosierung
- Professionell
- Wechselwirkungen
- Schwangerschaft
- Mehr
NUR Rx.
Sterile intravenöse Lösung
- Inamrinone Beschreibung
- Inamrinon – Klinische Pharmakologie
- Pharmakokinetik
- Pharmakodynamik
- Indikationen und Verwendung für Inamrinon
- Kontraindikationen
- Warnhinweise
- Vorsichtsmaßnahmen
- Allgemein
- Labortests
- Arzneimittelwechselwirkungen
- Chemische Wechselwirkungen
- Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
- Schwangerschaft
- Stillende Mütter
- Pädiatrische Anwendung
- Nebenwirkungen
- Management von Nebenwirkungen
- Überdosierung
- Dosierung und Anwendung von Inamrinon
- Chemische Wechselwirkungen
- Wie wird Inamrinon geliefert
- VIAL LABEL
- More about inamrinone
- Related treatment guides
Inamrinone Beschreibung
Inamrinone Injection USP repräsentiert eine neue Klasse von kardialen Inotropika, die sich von Digitalisglykosiden oder Katecholaminen unterscheiden. Inamrinonlactat wird chemisch als 5-Amino-6 (1H) -on-2-hydroxypropanat bezeichnet und hat die folgende Struktur:
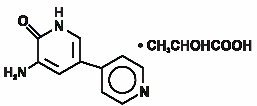
Inamrinon ist eine hellgelbe kristalline Verbindung mit einem Molekulargewicht von 187,20 und einer Summenformel von C10H9N3O. Jedes Mol Milchsäure hat ein Molekulargewicht von 90,08 und eine Summenformel von C3H6O3. Die Löslichkeiten von Inamrinone an pH 4,1, 6,0 und 8,0 sind 25, 0,9 und 0,7 mg/ml beziehungsweise.
Inamrinone injection ist eine klare gelbe sterile Lösung, die in 20-ml-Durchstechflaschen zur intravenösen Verabreichung erhältlich ist. Jeder ml enthält Inamrinonlactat entsprechend 5 mg Inamrinon und 0,25 mg Natriummetabisulfit als Konservierungsmittel in Wasser für Injektionszwecke. Alle in der Packungsbeilage angegebenen Dosierungen sind in Bezug auf die Base Inamrinon angegeben. Der pH-Wert wird mit Milchsäure oder Natronlauge zwischen 3,2 und 4,0 eingestellt. Die Gesamtkonzentration an Milchsäure kann zwischen 5 mg und 7,5 mg variieren.
Inamrinon – Klinische Pharmakologie
Inamrinon ist ein positiv inotropes Mittel mit vasodilatatorischer Aktivität, das sich in Struktur und Wirkungsweise von Digitalisglykosiden oder Katecholaminen unterscheidet.
Der Mechanismus seiner inotropen und vasodilatatorischen Wirkungen ist nicht vollständig geklärt.
In Bezug auf seine inotrope Wirkung weisen experimentelle Beweise darauf hin, dass es sich nicht um einen beta-adrenergen Agonisten handelt. Es hemmt die Aktivität der myokardialen zyklischen Adenosinmonophosphat (c-AMP) -Phosphodiesterase und erhöht die zellulären C-AMP-Spiegel. Im Gegensatz zu Digitalis hemmt es die Natrium-Kalium-Adenosintriphosphatase-Aktivität nicht.
In Bezug auf seine vasodilatatorische Aktivität reduziert Inamrinon die Nach- und Vorlast durch seine direkte entspannende Wirkung auf die glatte Gefäßmuskulatur.
Pharmakokinetik
Nach intravenöser Bolusinjektion (1 bis 2 Minuten) von 0,68 mg / kg bis 1,2 mg / kg an normale Probanden hatte Inamrinon ein Verteilungsvolumen von 1,2 Litern / kg und nach einer Verteilungsphasenhalbwertszeit von etwa 4,6 Minuten im Plasma eine mittlere scheinbare terminale Eliminationshalbwertszeit erster Ordnung von etwa 3,6 Stunden. Bei Patienten mit kongestiver Herzinsuffizienz, die Infusionen von Inamrinon erhielten, betrug die mittlere scheinbare terminale Eliminationshalbwertszeit erster Ordnung etwa 5,8 Stunden.In einer Studie wurde gezeigt, dass Inamrinon zu 10% bis 22% durch Ultrafiltration in vitro an menschliches Plasmaprotein gebunden ist, und in einer anderen Studie zu 35% bis 49% entweder durch Ultrafiltration oder Gleichgewichtsdialyse.
Der primäre Ausscheidungsweg beim Menschen erfolgt über den Urin als Inamrinon und mehrere Metaboliten (N-Glycolyl, N-Acetat, O-Glucuronid und N-Glucuronid). Bei normalen Probanden wurden ungefähr 63% einer oralen Dosis von 14C-markiertem Inamrinon über einen Zeitraum von 96 Stunden im Urin ausgeschieden. In den ersten 8 Stunden waren 51% der Radioaktivität im Urin Inamrinon mit 5% als N-Acetat, 8% als N-Glykolat und weniger als 5% für jedes Glucuronid. Ungefähr 18% der verabreichten Dosis wurden innerhalb von 72 Stunden mit dem Kot ausgeschieden.
In einer 24-stündigen nichtradioaktiven intravenösen Studie wurden 10% bis 40% der Dosis als unverändertes Inamrinon im Urin ausgeschieden, wobei der N-Acetylmetabolit weniger als 2% der Dosis ausmachte.
Bei Patienten mit kongestiver Herzinsuffizienz konnten nach einer Beladungsbolusdosis Steady-State-Plasmaspiegel von etwa 2,4 mcg / ml durch eine Infusion von 5 mcg / kg / min bis 10 mcg / kg / min aufrechterhalten werden. Bei einigen Patienten mit kongestiver Herzinsuffizienz mit damit verbundener eingeschränkter Nieren- und Leberperfusion ist es möglich, dass die Plasmaspiegel von Inamrinon während der Infusionsperiode ansteigen; Daher kann es bei diesen Patienten erforderlich sein, die hämodynamische Reaktion und / oder den Arzneimittelspiegel zu überwachen. Die Hauptmaße für das Ansprechen des Patienten umfassen den Herzindex, den Lungenkapillarkeildruck, den Zentralvenendruck und ihre Beziehung zu Plasmakonzentrationen. Darüber hinaus können sich Messungen von Blutdruck, Urinausstoß und Körpergewicht als nützlich erweisen, ebenso wie klinische Symptome wie Orthopnoe, Dyspnoe und Müdigkeit.
Pharmakodynamik
Bei Patienten mit depressiver Myokardfunktion führt Inamrinon aufgrund seiner inotropen und vasodilatatorischen Wirkungen zu einer sofortigen Erhöhung des Herzzeitvolumens.
Nach einer einzelnen intravenösen Bolusdosis von Inamrinon von 0.75 mg / kg bis 3 mg/kg bei Patienten mit kongestiver Herzinsuffizienz treten dosisabhängige maximale Erhöhungen des Herzzeitvolumens auf (von etwa 28% bei 0, 75 mg / kg bis etwa 61% bei 3 mg / kg). Der Spitzeneffekt tritt bei allen Dosen innerhalb von 10 Minuten auf. Die Wirkungsdauer hängt von der Dosis ab und dauert etwa 1/2 Stunde bei 0,75 mg / kg und etwa 2 Stunden bei 3 mg / kg.
Über den gleichen Dosisbereich zeigen der pulmonale Kapillarkeildruck und der gesamte periphere Widerstand eine dosisabhängige Abnahme (mittlere maximale Abnahme des pulmonalen Kapillarkeildrucks um 29% und des systemischen Gefäßwiderstands um 29%). Bei Dosen bis zu 3 mg/kg wurden dosisabhängige Abnahmen des diastolischen Drucks (bis zu 13%) beobachtet. Der mittlere arterielle Druck sinkt (9,7%) bei einer Dosis von 3 mg/kg. Die Herzfrequenz ist im Allgemeinen unverändert.
Die Änderungen der hämodynamischen Parameter werden während der kontinuierlichen intravenösen Infusion und danach für mehrere Stunden aufrechterhalten.
Inamrinon ist bei vollständig digitalisierten Patienten wirksam, ohne Anzeichen einer Herzglykosidtoxizität zu verursachen. Seine inotropen Wirkungen sind additiv zu denen von Digitalis. In Fällen von Vorhofflattern / -flimmern ist es möglich, dass Inamrinon die ventrikuläre Ansprechrate aufgrund seiner leichten Verstärkung der A / V-Leitung erhöht. In diesen Fällen wird eine vorherige Behandlung mit Digitalis empfohlen.
Bei Patienten mit ischämischer Herzkrankheit wurden eine Verbesserung der linksventrikulären Funktion und eine Linderung der Herzinsuffizienz beobachtet. Die Besserung trat auf, ohne Symptome oder elektrokardiographische Anzeichen einer Myokardischämie hervorzurufen.
Bei konstanter Herzfrequenz und konstantem Blutdruck kommt es zu einem Anstieg des Herzzeitvolumens ohne messbaren Anstieg des myokardialen Sauerstoffverbrauchs oder Veränderungen der arteriovenösen Sauerstoffdifferenz.
Die inotrope Aktivität bleibt nach wiederholten intravenösen Dosen von Inamrinon erhalten. Die Verabreichung von Inamrinon führt zu hämodynamischen und symptomatischen Vorteilen für Patienten, die durch eine konventionelle Therapie mit Diuretika und Herzglykosiden nicht zufriedenstellend kontrolliert werden können.
Indikationen und Verwendung für Inamrinon
Inamrinon Injection ist für die kurzfristige Behandlung von Herzinsuffizienz. Aufgrund der begrenzten Erfahrung und des Potenzials schwerwiegender Nebenwirkungen (siehe NEBENWIRKUNGEN) sollte Inamrinon nur bei Patienten angewendet werden, die engmaschig überwacht werden können und die nicht ausreichend auf Digitalis, Diuretika und / oder Vasodilatatoren angesprochen haben. Die Erfahrung mit intravenösem Inamrinon in kontrollierten Studien erstreckt sich nicht über 48 Stunden wiederholter Boli und / oder kontinuierlicher Infusionen hinaus.Unabhängig davon, ob es oral, kontinuierlich intravenös oder intermittierend intravenös verabreicht wird, wurde in kontrollierten Studien weder Inamrinon noch ein anderes cyclisch-AMP-abhängiges Inotrop als sicher oder wirksam bei der Langzeitbehandlung von Herzinsuffizienz nachgewiesen. In kontrollierten Studien zur chronischen oralen Therapie mit verschiedenen solchen Wirkstoffen (einschließlich Inamrinon) wurden die Symptome nicht konsistent gelindert, und die cyclischen AMP-abhängigen Inotrope waren konsistent mit einem erhöhten Risiko für Krankenhausaufenthalt und Tod verbunden. Patienten mit Symptomen der NYHA-Klasse IV schienen einem besonderen Risiko ausgesetzt zu sein.
Kontraindikationen
Inamrinon ist bei Patienten kontraindiziert, die überempfindlich darauf reagieren.
Es ist auch bei Patienten kontraindiziert, von denen bekannt ist, dass sie überempfindlich gegen Bisulfite sind.
Warnhinweise
Enthält Natriummetabisulfit, ein Sulfit, das bei bestimmten empfindlichen Personen allergische Reaktionen einschließlich anaphylaktischer Symptome und lebensbedrohlicher oder weniger schwerer asthmatischer Episoden hervorrufen kann. Die Gesamtprävalenz der Sulfitempfindlichkeit in der Allgemeinbevölkerung ist unbekannt und wahrscheinlich gering. Sulfitempfindlichkeit tritt bei Asthmatikern häufiger auf als bei Nichtasthmatikern.
Vorsichtsmaßnahmen
Allgemein
Inamrinon sollte nicht bei Patienten mit schwerer Aorten- oder Pulmonalklappenerkrankung anstelle einer chirurgischen Linderung der Obstruktion angewendet werden. Wie andere inotrope Mittel kann es die Obstruktion des Abflusstrakts bei hypertropher Subaortenstenose verschlimmern.
Während der intravenösen Therapie mit Inamrinon sollten Blutdruck und Herzfrequenz überwacht und die Infusionsrate bei Patienten mit übermäßigem Blutdruckabfall verlangsamt oder gestoppt werden.
Patienten, die eine intensive Diuretikatherapie erhalten haben, können einen unzureichenden Herzfülldruck haben, um angemessen auf Inamrinon anzusprechen.
Supraventrikuläre und ventrikuläre Arrhythmien wurden in der behandelten Population mit sehr hohem Risiko beobachtet. Während Inamrinon an sich nicht arrhythmogen ist, kann das Potenzial für Arrhythmien, die bei kongestiver Herzinsuffizienz selbst auftreten, durch jedes Medikament oder jede Kombination von Medikamenten erhöht werden.
Thrombozytopenie und Hepatotoxizität wurden beobachtet (siehe NEBENWIRKUNGEN).
ANWENDUNG BEI AKUTEM MYOKARDINFARKT
Es wurden keine klinischen Studien bei Patienten in der akuten Phase des postmyokardialen Infarkts durchgeführt. Daher wird Inamrinon in diesen Fällen nicht empfohlen.
Labortests
Flüssigkeit und Elektrolyte
Flüssigkeits- und Elektrolytveränderungen sowie die Nierenfunktion sollten während der Inamrinon-Therapie sorgfältig überwacht werden. Eine Verbesserung des Herzzeitvolumens mit der daraus resultierenden Diurese kann eine Verringerung der Diuretikadosis erforderlich machen. Kaliumverlust aufgrund übermäßiger Diurese kann digitalisierte Patienten für Arrhythmien prädisponieren. Daher sollte die Hypokaliämie vor oder während der Anwendung von Inamrinon durch Kaliumsupplementierung korrigiert werden.
Arzneimittelwechselwirkungen
In einer relativ begrenzten Erfahrung wurden keine unerwünschten klinischen Manifestationen bei Patienten beobachtet, bei denen Inamrinon gleichzeitig mit den folgenden Arzneimitteln angewendet wurde: Digitalisglykoside; Lidocain, Chinidin; Metoprolol, Propranolol; Hydralazin, Prazosin; Isosorbiddinitrat, Nitroglycerin; Chlorthalidon, Ethacrynsäure, Furosemid, Hydrochlorothiazid, Spironolacton; Captopril; Heparin, Warfarin; Kaliumpräparate; Insulin; Diazepam.
Ein Fallbericht über übermäßige Hypotonie wurde berichtet, als Inamrinon gleichzeitig mit Disopyramid angewendet wurde.
Bis zusätzliche Erfahrungen vorliegen, sollte die gleichzeitige Anwendung mit Disopyramid mit Vorsicht erfolgen.
Chemische Wechselwirkungen
Eine chemische Wechselwirkung tritt langsam über einen Zeitraum von 24 Stunden auf, wenn die intravenöse Lösung von Inamrinon direkt mit Dextrose (Glucose) -haltigen Lösungen gemischt wird. DAHER SOLLTE Inamrinon VOR DER INJEKTION NICHT MIT LÖSUNGEN VERDÜNNT WERDEN, DIE DEXTROSE (GLUCOSE) ENTHALTEN.
Eine chemische Wechselwirkung tritt sofort auf, was durch die Bildung eines Niederschlags belegt wird, wenn Furosemid in eine intravenöse Infusionsleitung von Inamrinon injiziert wird. Daher sollte Furosemid nicht in intravenösen Leitungen verabreicht werden, die Inamrinon enthalten.
Karzinogenese, Mutagenese, Beeinträchtigung der Fertilität
Bei oraler Verabreichung von Inamrinon an Ratten und Mäuse über einen Zeitraum von bis zu zwei Jahren in Dosierungen bis zur maximal tolerierten Dosis von 80 mg/kg/Tag gab es keinen Hinweis auf ein karzinogenes Potenzial.
Der Maus-Mikronukleustest (mit dem 7,5- bis 10-fachen der maximalen Humandosis) und der Ovarialchromosomenaberrationstest des chinesischen Hamsters waren positiv, was sowohl auf ein klastogenes Potenzial als auch auf eine Unterdrückung der Anzahl polychromatischer Erythrozyten hinwies. Der Ames-Salmonellen-Assay, die Maus-Lymphom-Studie und die kultivierte menschliche Lymphozyten-Metaphase-Analyse waren jedoch alle negativ. Die klastogenen Wirkungen stehen im Gegensatz zu negativen Ergebnissen, die in den männlichen und weiblichen Fertilitätsstudien an Ratten und einer Drei-Generationen-Studie an Ratten, beide mit oraler Dosierung, erhalten wurden.
In diesen Studien wurde bei Dosierungen von 50 mg/kg/Tag und 100 mg/kg/Tag eine leichte Verlängerung der Tragzeit bei Ratten beobachtet. Dystokie trat bei Muttertieren auf, die 100 mg / kg / Tag erhielten, was zu einer erhöhten Anzahl von Totgeburten, einer verringerten Wurfgröße und einem schlechten Überleben der Welpen führte.
Schwangerschaft
Teratogene Wirkungen – Schwangerschaftskategorie C
Bei neuseeländischen weißen Kaninchen wurde gezeigt, dass Inamrinon bei oralen Dosen von 16 mg / kg und 50 mg/ kg fetale Skelett- und grobe äußere Missbildungen hervorruft / kg, die für das Kaninchen toxisch waren. Studien an französischen Hy / Cr-Kaninchen mit oralen Dosen von bis zu 32 mg/ kg / Tag bestätigten diesen Befund nicht. Bei Ratten, die Inamrinon intravenös in der maximalen Dosis von 15 mg/ kg / Tag erhielten (ungefähr die empfohlene tägliche intravenöse Dosis für Patienten mit kongestiver Herzinsuffizienz), wurden keine Missbildungen beobachtet. Es liegen keine ausreichenden und gut kontrollierten Studien bei Schwangeren vor. Inamrinon sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das potenzielle Risiko für den Fötus rechtfertigt.
Stillende Mütter
Bei der Anwendung von Inamrinon bei stillenden Frauen ist Vorsicht geboten, da nicht bekannt ist, ob es in die Muttermilch übergeht.
Pädiatrische Anwendung
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht nachgewiesen.
Nebenwirkungen
Thrombozytopenie: Die intravenöse Injektion von Inamrinon führte bei 2,4 Prozent der Patienten zu einer Verringerung der Thrombozytenzahl auf unter 100.000 / mm3 oder normale Grenzwerte.
Es ist häufiger bei Patienten, die eine längere Therapie erhalten. Bisher wurden in engmaschig überwachten klinischen Studien bei Patienten, deren Thrombozytenzahl nicht gedrückt bleiben durfte, keine Blutungserscheinungen beobachtet.
Die Thrombozytenreduktion ist dosisabhängig und scheint auf eine Abnahme der Thrombozytenüberlebenszeit zurückzuführen zu sein. Mehrere Patienten, die während der Behandlung mit Inamrinon eine Thrombozytopenie entwickelten, hatten normale Knochenmarkuntersuchungen. Es gibt keine Hinweise darauf, dass die Thrombozytenreduktion mit der Immunantwort oder einem thrombozytenaktivierenden Faktor zusammenhängt.Gastrointestinale Nebenwirkungen: Gastrointestinale Nebenwirkungen, die mit Inamrinon während der klinischen Anwendung berichtet wurden, waren Übelkeit (1,7%), Erbrechen (0,9%), Bauchschmerzen (0,4%) und Anorexie (0,4%).Kardiovaskuläre Nebenwirkungen: Kardiovaskuläre Nebenwirkungen, die unter Inamrinon berichtet wurden, umfassen Arrhythmie (3%) und Hypotonie (1,3%).
Lebertoxizität: Bei Hunden zeigte Inamrinon in IV-Dosen zwischen 9 mg /kg / Tag und 32 mg/kg/Tag eine dosisabhängige Hepatotoxizität, die sich entweder als Enzymerhöhung oder Leberzellnekrose oder beides manifestierte. Hepatotoxizität wurde beim Menschen nach oraler Langzeitdosierung beobachtet und wurde in einer begrenzten Erfahrung (0,2%) nach intravenöser Verabreichung von Inamrinon beobachtet. Es gab auch seltene Berichte über Enzym- und Bilirubinerhöhungen und Gelbsucht.
Überempfindlichkeit: Es gab Berichte über mehrere offensichtliche Überempfindlichkeitsreaktionen bei Patienten, die etwa zwei Wochen lang mit oralem Inamrinon behandelt wurden. Anzeichen und Symptome waren variabel, umfassten jedoch Perikarditis, Pleuritis und Aszites (1 Fall), Myositis mit interstitieller Abschattung auf Röntgenbild des Brustkorbs und erhöhter Sedimentationsrate (1 Fall) und Vaskulitis mit knotigen Lungendichten, Hypoxämie und Gelbsucht (1 Fall). Der erste Patient starb, nicht unbedingt an der möglichen Reaktion, während die letzten beiden mit Absetzen der Therapie abgeklungen waren. Keiner der Fälle wurde erneut angefochten, so dass die Zuordnung zu Inamrinon nicht sicher ist, aber mögliche Überempfindlichkeitsreaktionen sollten bei jedem Patienten in Betracht gezogen werden, der über einen längeren Zeitraum mit Inamrinon behandelt wurde.
Allgemein: Weitere Nebenwirkungen, die in klinischen Studien mit intravenösem Inamrinon beobachtet wurden, sind Fieber (0,9%), Brustschmerzen (0,2%) und Brennen an der Injektionsstelle (0,2%).
Management von Nebenwirkungen
Senkung der Thrombozytenzahl: Eine asymptomatische Verringerung der Thrombozytenzahl (auf <150.000 / mm3) kann innerhalb einer Woche nach einer Abnahme der Arzneimitteldosis rückgängig gemacht werden. Ferner kann sich die Zählung ohne Änderung der Arzneimitteldosierung auf einem niedrigeren Niveau als vor dem Arzneimittel stabilisieren, ohne dass klinische Folgen auftreten. Prämedikamentöse Thrombozytenzahlen und häufige Thrombozytenzahlen während der Therapie werden empfohlen, um Entscheidungen über Dosierungsänderungen zu erleichtern.
Sollte eine Thrombozytenzahl von weniger als 150.000/mm3 auftreten, können die folgenden Maßnahmen in Betracht gezogen werden:
• Halten Sie die tägliche Gesamtdosis unverändert, da sich die Zählungen in einigen Fällen entweder stabilisiert haben oder auf das Niveau vor der Behandlung zurückgekehrt sind. * Verringern Sie die tägliche Gesamtdosis. * Setzen Sie Inamrinon ab, wenn nach klinischer Beurteilung des Arztes das Risiko den potenziellen Nutzen übersteigt. Gastrointestinale Nebenwirkungen: Während gastrointestinale Nebenwirkungen bei intravenöser Therapie selten beobachtet wurden, kann der Arzt bei schweren oder schwächenden Nebenwirkungen die Dosierung reduzieren oder das Medikament aufgrund der üblichen Nutzen-Risiko-Abwägungen absetzen.
Lebertoxizität: In der bisherigen klinischen Erfahrung mit intravenöser Verabreichung wurde Hepatotoxizität selten beobachtet. Wenn akute deutliche Veränderungen der Leberenzyme zusammen mit klinischen Symptomen auftreten, die auf eine idiosynkratische Überempfindlichkeitsreaktion hindeuten, sollte die Inamrinon-Therapie unverzüglich abgebrochen werden.
Wenn weniger als ausgeprägte Enzymveränderungen ohne klinische Symptome auftreten, sollten diese unspezifischen Veränderungen individuell bewertet werden. Der Kliniker möchte möglicherweise Inamrinon fortsetzen, die Dosierung reduzieren oder das Medikament auf der Grundlage der üblichen Nutzen-Risiko-Abwägungen absetzen.
Überdosierung
Ein Todesfall wurde bei einer massiven versehentlichen Überdosierung (840 mg über drei Stunden durch initialen Bolus und Infusion) von Inamrinon berichtet, obwohl ein kausaler Zusammenhang ungewiss ist. Sorgfalt sollte während der Produktvorbereitung und -verwaltung ausgeübt werden.
Dosen von Inamrinon können aufgrund seiner vasodilatatorischen Wirkung zu Hypotonie führen. In diesem Fall sollte die Verabreichung von Inamrinon reduziert oder abgebrochen werden. Es ist kein spezifisches Gegenmittel bekannt, aber allgemeine Maßnahmen zur Kreislaufunterstützung sollten ergriffen werden.
Bei Ratten betrug die LD50 von Inamrinon als Lactatsalz 102 mg / kg oder 130 mg / kg intravenös in zwei verschiedenen Studien und 132 mg / kg oral (intragastrisch); Als Suspension in wässrigem Tragantgummi betrug die orale LD50 239 mg / kg.
Dosierung und Anwendung von Inamrinon
Ladedosen der Inamrinon-Injektion sollten wie geliefert (unverdünnt) verabreicht werden. Infusionen von Inamrinon können in normaler oder halbnormaler Kochsalzlösung bis zu einer Konzentration von 1 mg / ml bis 3 mg / ml verabreicht werden. Verdünnte Lösungen sollten innerhalb von 24 Stunden verwendet werden.
Die Inamrinon-Injektion kann in laufende Dextrose (Glucose) -Infusionen über einen Y-Verbinder oder direkt in den Schlauch verabreicht werden, wo dies vorzuziehen ist.
Chemische Wechselwirkungen
Eine chemische Wechselwirkung tritt langsam über einen Zeitraum von 24 Stunden auf, wenn die intravenöse Lösung von Inamrinon direkt mit Dextrose (Glucose) -haltigen Lösungen gemischt wird. DAHER SOLLTE Inamrinon VOR DER INJEKTION NICHT MIT LÖSUNGEN VERDÜNNT WERDEN, DIE DEXTROSE (GLUCOSE) ENTHALTEN.
Eine chemische Wechselwirkung tritt sofort auf, was durch die Bildung eines Niederschlags belegt wird, wenn Furosemid in eine intravenöse Infusionsleitung von Inamrinon injiziert wird. Daher sollte Furosemid nicht in intravenösen Leitungen verabreicht werden, die Inamrinon enthalten.
Für die Verabreichung der Inamrinon-Injektion wird folgendes Verfahren empfohlen:
1. Beginnen Sie die Therapie mit einer Beladungsdosis von 0, 75 mg / kg, die langsam über 2 bis 3 Minuten verabreicht wird.
|
LOADING DOSE DETERMINATION 0.75 mg/kg (undiluted) |
||||||||||
|
Patient Weight in kg |
||||||||||
|
mL of undiluted Inamrinone Injection |
||||||||||
2. Continue therapy with a maintenance infusion between 5 mcg/kg/min and 10 mcg/kg/min.
3. Based on clinical response, an additional loading dose of 0.75 mg/kg may be given 30 minutes after the initiation of therapy.
4. Die Infusionsrate reicht normalerweise von 5 mcg / kg / min bis 10 mcg / kg / min, so dass die empfohlene tägliche Gesamtdosis (einschließlich Beladungsdosen) 10 mg / kg nicht überschreitet. Eine begrenzte Anzahl von Patienten, die mit höheren Dosen untersucht wurden, unterstützen ein Dosierungsschema von bis zu 18 mg / kg / Tag für eine verkürzte Therapiedauer.
Das folgende Infusionsratendiagramm kann verwendet werden, um sicherzustellen, dass die Berechnungen korrekt durchgeführt werden.
Um die Tabelle zu verwenden, muss die Konzentration der verwendeten Inamrinon-Infusionslösung 2,5 mg/ ml (2500 mcg/ ml) betragen. Diese Konzentration wird durch Mischen der Inamrinonlösung mit einem gleichen Volumen Verdünnungsmittel (normale oder halb normale Kochsalzlösung) hergestellt.
| * Verdünnung: Um die für die Infusion empfohlene Konzentration von 2, 5 mg/ ml herzustellen, mischen Sie Inamrinon mit einem gleichen Volumen Verdünnungsmittel. Mischen Sie beispielsweise drei 20-ml-Durchstechflaschen mit Inamrinon (3 x 20 ml = 60 ml) mit 60 ml Verdünnungsmittel für ein Gesamtvolumen von 120 ml der endgültigen 2,5 mg / ml-Lösung von Inamrinon. | ||||||||||
|
Inamrinone IV INFUSION RATE (mL/hr) CHART Using 2.5 mg/mL Infusion Concentration* |
||||||||||
|
Patient Weight in kg |
||||||||||
|
Dosage: 5.0 mcg/kg/min |
||||||||||
|
7.5 mcg/kg/min |
||||||||||
|
10.0 mcg/kg/min |
||||||||||
Example: A 70 kg patient would require a loading dose of 10.5 mL of undiluted Inamrinone. If the physician selects a dose of 7.5 mcg / kg / min für die Infusion würde die Flussrate 13 ml / h bei der 2,5 mg / ml Konzentration von Inamrinon betragen.
5. Die Verabreichungsrate und die Dauer der Therapie sollten entsprechend dem Ansprechen des Patienten angepasst werden. Der Arzt kann die Infusion nach unten reduzieren oder titrieren, je nach klinischem Ansprechen oder unerwünschten Wirkungen.
Bei den oben genannten Dosierungsschemata ist zu erwarten, dass die Plasmakonzentration von Inamrinon bei den meisten Patienten bei etwa 3 mcg/ ml liegt. Erhöhungen des Herzindex zeigen eine lineare Beziehung zur Plasmakonzentration in einem Bereich von 0.5 mcg/ml bis 7 mcg/ml. Bei höheren Plasmakonzentrationen wurden keine Beobachtungen gemacht.Die Verbesserung des Patienten kann sich in einem Anstieg des Herzzeitvolumens, einer Verringerung des pulmonalen Kapillarkeildrucks und solchen klinischen Reaktionen wie einer Verringerung der Dyspnoe und einer Verbesserung anderer Symptome der Herzinsuffizienz wie Orthopnoe und Müdigkeit widerspiegeln.
Die Überwachung des zentralvenösen Drucks (CVP) kann bei der Beurteilung der Hypotonie und des Flüssigkeitshaushalts hilfreich sein. Eine vorherige Korrektur oder Anpassung der Flüssigkeit / Elektrolyte ist unerlässlich, um eine zufriedenstellende Reaktion mit Inamrinon zu erzielen.
Parenterale Arzneimittel sollten visuell untersucht und nicht verwendet werden, wenn Partikel oder Verfärbungen beobachtet werden.
Wie wird Inamrinon geliefert
Inamrinone Injection USP wird in Einzeldosisflaschen mit 20 ml steriler, klarer gelber Lösung einzeln verpackt geliefert. NDC 55390-042-10.
Jeder 1 ml enthält Inamrinonlactat entsprechend 5 mg Inamrinon.
Vor Licht schützen. Verpackung ist licht beständig für schutz während der lagerung. Bis zum Gebrauch im Karton aufbewahren.
Bei kontrollierter Raumtemperatur von 15° bis 30°C (59° bis 86°F) lagern.
Manufactured by: Manufactured for:
Ben Venue Laboratories, Inc. Bedford Laboratories™
Bedford, OH 44146 Bedford, OH 44146
August 2002 AMR-P01
VIAL LABEL

Vial Label 100 mg/20 mL
| Inamrinone Inamrinone injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Bedford Laboratories (884528407)
Registrant – Ben Venue Laboratories (004327953)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Ben Venue Laboratories Inc. | 004327953 | MANUFACTURE(55390-042) | |
More about inamrinone
- Side Effects
- During Pregnancy
- Dosage Information
- Drug Interactions
- Drug class: inotropic agents
Related treatment guides
- Heart Failure
Medical Disclaimer