EINLEITUNG
Das intramurale Aortenhämatom (IMH) ist eine von mehreren Erkrankungen, die zum akuten Aortensyndrom (AAS) gehören.1,2 In morphologischer Hinsicht ist es durch Blutung in die Medienschicht der Aortenwand in Abwesenheit eines intima-medialen Risses gekennzeichnet, was bedeutet, dass keine Kommunikation mit dem Aortenlumen besteht. Einige Autoren haben vorgeschlagen, dass IMH das Ergebnis einer spontanen Ruptur der Aortenvasa vasorum ist. Die Häufigkeit von IMH bei Patienten mit klinischem Verdacht auf AAS liegt zwischen 5% und 20% der Fälle.2-4
Wie bei der klassischen Aortendissektion wird IMH gemäß der Stanford-Klassifikation in zwei Typen unterschieden: Typ A, wenn die aufsteigende Aorta betroffen ist, und Typ B, wenn die aufsteigende Aorta nicht betroffen ist.Es wird derzeit akzeptiert, dass die Behandlung von IMH vom Typ A im Wesentlichen chirurgisch ist, während Typ B anfänglich mit einer medizinischen Therapie behandelt werden kann, wobei eine Operation oder Stentplatzierung für Fälle mit zusätzlichen Komplikationen reserviert wird. Die mit IMH in den ersten Monaten verbundene Mortalität ist nicht zu vernachlässigen; Die wichtigsten unabhängigen prädiktiven Faktoren für den Tod sind der Aortendurchmesser >50 mm und die Beteiligung der aufsteigenden Aorta.5
Es gibt immer noch einige Unsicherheiten hinsichtlich der natürlichen Vorgeschichte dieser Krankheit und der am besten geeigneten Behandlung für betroffene Patienten. Klassisch wird empfohlen, die Antikoagulation bei Patienten mit einem AAS hauptsächlich aus zwei Gründen zu vermeiden: um das sezierende Fortschreiten des Hämatoms zu begrenzen und eine Herztamponade bei Patienten mit Perikarderguss zu vermeiden.
Ziel der vorliegenden Studie ist es, die klinischen und radiologischen Merkmale sowie die Entwicklung einer Untergruppe von Patienten mit IMH zu beschreiben, die während des Krankenhausaufenthalts eine gerinnungshemmende Behandlung erhielten.
METHODEN
Alle Patienten, die von Januar 2000 bis Dezember 2005 mit der Diagnose AAS in unser Krankenhaus eingeliefert wurden, wurden prospektiv untersucht. Unter diesen Patienten wählten wir alle aus, die ein IMH hatten und während des Krankenhausaufenthalts eine gerinnungshemmende Behandlung erhalten hatten. Demografische Informationen sowie klinische, radiologische und Follow-up-Daten wurden zusammengestellt.
Die Diagnose von AAS wurde durch Computertomographie (CT) mit und ohne Kontrastverstärkung gestellt. Die nachfolgenden bildgebenden Untersuchungen wurden mit CT und/oder Magnetresonanztomographie (MR) durchgeführt.
Alle untersuchten Patienten erhielten eine medizinische Behandlung, die auf eine strikte Kontrolle des Blutdrucks (BP ≤120/80 mm Hg) abzielte, die in allen Fällen Betablocker umfasste, außer wenn Kontraindikationen für diese Behandlung vorlagen.
ERGEBNISSE
Während des Studienzeitraums wurden 95 Patienten mit der Diagnose AAS in unser Zentrum aufgenommen. Zwölf (25.6%) dieser Patienten zeigten IMH (4 Typ A und 8 Typ B). Drei Patienten mit IMH, die während des Krankenhausaufenthalts eine gerinnungshemmende Behandlung erhielten (einer mit IMH vom Typ A und 2 mit IMH vom Typ B), sind Gegenstand dieses Berichts.
Die klinischen Merkmale und die wichtigsten demografischen Informationen der Patienten mit IMH, die eine Antikoagulation erhielten, sind nachstehend beschrieben und in der Tabelle dargestellt.
Fall 1
Ein 79-jähriger Mann mit schlecht kontrolliertem Bluthochdruck trotz pharmakologischer Behandlung und chronischem Vorhofflimmern. Die Krankengeschichte des Patienten beinhaltete eine Episode einer arteriellen Embolie in der oberen rechten Extremität 5 Jahre zuvor, die mit oraler Antikoagulation behandelt worden war. Er wurde wegen plötzlich einsetzender starker Schmerzen in der interskapulären Region aufgenommen, die auf den Bauch ausstrahlten und von starkem Schwitzen und Schwindel begleitet wurden. Die in der Notaufnahme durchgeführte Computertomographie identifizierte eine IMH vom Typ B, die sich vom Ursprung der linken A. subclavia bis zur aortoiliakalen Bifurkation erstreckte und die ersten Zentimeter der linken A. iliaca communis betraf (Abbildung 1). Zum Zeitpunkt der Aufnahme wurde der Patient mit Labetalol und Nitroprussid durch Perfusion behandelt und die Antikoagulation wurde abgebrochen. Nach Absetzen dieser Behandlung zeigte der Patient eine neue Episode einer arteriellen Embolie in der linken oberen Extremität, die eine Embolektomie erforderte. Aus diesem Grund wurde eine Antikoagulation zunächst mit Natriumheparin und später mit Acenocoumarol etabliert.
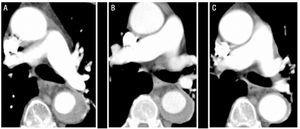
Abbildung 1.Radiologische Entwicklung des intramuralen Aortenhämatoms Typ B (IMH) bei Patient 1. Serielle CT-Schnitte an der Bifurkation der Lungenarterie zeigen eine fortschreitende Abnahme der Dicke der Läsion und der endgültigen Auflösung. A: IMH-Dicke zum Zeitpunkt der Diagnose. B: Dicke beim ersten CT-Follow-up (2 Wochen Evolution). C: IMH-Dicke nach 2 Monaten.
Fall 2
Ein 72-jähriger Mann mit Bluthochdruck von langer Entwicklung unter pharmakologischer Behandlung und einer Geschichte von chronischem Vorhofflimmern, für die er Digoxin und Acenocoumarol erhielt. Er kam in unser Zentrum für drückende Schmerzen in der mittleren Brust, die plötzlich auftraten und nach hinten ausstrahlten. Der anfängliche CT-Scan zeigte eine IMH vom Typ A mit Beteiligung der aufsteigenden Aorta, des Aortenbogens und der absteigenden Aorta bis zum Ursprung der A. mesenterica superior. Die Antikoagulation wurde abgebrochen. Während des Krankenhausaufenthaltes zeigte der Patient eine Episode des Bewusstseinsverlustes mit linker Hemiparese, von der er sich ohne Folgen erholte. Die zerebrale CT zeigte keine Anzeichen von Ischämie oder intrakraniellen Blutungen, daher wurde die Episode als vorübergehende ischämische Attacke embolischen Ursprungs interpretiert. Aufgrund dieser Komplikation wurde die gerinnungshemmende Behandlung mit Natriumheparin in Perfusion gefolgt von Acenocoumarol während des Krankenhausaufenthalts wieder aufgenommen.
Fall 3
Ein 73-jähriger Mann, Raucher, mit chronischem Nierenversagen und einer langen Geschichte von Bluthochdruck; er hatte chronisches Vorhofflimmern und erhielt eine Thrombozytenaggregationshemmung. Der Patient kam wegen schwerer interskapulärer Schmerzen, die auf beide Flanken ausstrahlten, in unser Krankenhaus. Der anfängliche CT-Scan stellte die Diagnose eines intramuralen Hämatoms vom Typ B fest, das auf die absteigende Brustaorta beschränkt war. Im distalen Segment des Hämatoms war ein tränenförmiges Bild (ulkusartige Projektion) innerhalb des Hämatoms zu sehen (Abbildung 2). Obwohl der Patient noch nie eine Embolie hatte, wurde wegen seines hohen embolischen Risikoprofils eine gerinnungshemmende Behandlung bei der Aufnahme begonnen.
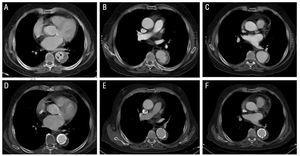
Abbildung 2. Radiologische Entwicklung des intramuralen Aortenhämatoms Typ B (IMH) bei Patient 3. Obere Tafel: Bilder bei der Diagnose (A) und während der Nachsorge (B und C). A: Beobachten Sie das tränenförmige Bild (ulkusartige Projektion) innerhalb des IMH (Pfeile). B: lokalisierte Dissektion während der Nachsorge (2 Monate später). C: progressive Erweiterung des Aortendurchmessers. Untere Tafel: Bilder 5 Monate nach der Diagnose (D-F). Die fortschreitende Dilatation des Hämatoms diktiert die Implantation von zwei Stents.
Radiologische Nachsorge
Der maximale Aortendurchmesser und der maximale IMH-Durchmesser zum Zeitpunkt der Diagnose sowie die Entwicklung der Läsion bei jedem Patienten sind in der Tabelle aufgeführt.
Während der radiologischen Nachuntersuchung zeigten alle Patienten eine allmähliche Abnahme der IMH-Dicke. Bei Patienten 1 und 2 betrug der maximale Durchmesser des IMH zum Zeitpunkt der Diagnose 17,6 bzw. 7 mm. In der 2-wöchigen CT-Nachbeobachtungsstudie betrugen die Durchmesser 13 bzw. 4,6 mm.
Bei Patient 3 betrug die IMH-Dicke 14 mm beim anfänglichen CT und 11,5 mm beim Follow-up-Scan. Zusätzlich präsentierte der Patient am distalen Ende des IMH ein tränenförmiges Bild, das 4 ×??6 mm zum Zeitpunkt der Diagnose. Einige Autoren haben dies als Zeichen für ein Aortengeschwür (ulkusartige Projektion) interpretiert. Nach der Entlassung aus dem Krankenhaus entwickelte der Patient eine lokalisierte Dissektion mit anschließender progressiver Dilatation des betroffenen Aortensegments (Pseudoaneurysma), die die Implantation von 2 Stents erforderte (Excluder 34 ×??10 mm und 40??×10 Millimeter). Die nachfolgende Entwicklung war günstig (Abbildung 2).
DISKUSSION
Während des Studienzeitraums erhielten 3 Patienten mit IMH eine gerinnungshemmende Behandlung. Obwohl IMH eine hämorrhagische Läsion ist, war die klinische und morphologische Entwicklung in dieser Untergruppe von Patienten günstig, mit fortschreitender Regression der Läsionsgröße in radiologischen Follow-up-Untersuchungen, trotz der Tatsache, dass Antikoagulation gegeben wurde. Patient 3 entwickelte während der Nachsorge eine Komplikation in einem Segment der Aorta, in dem die anfängliche Läsion möglicherweise ein penetrierendes Aortengeschwür (PAU) war. Dennoch erfuhr das Hämatom zunächst ähnliche Veränderungen wie bei den beiden anderen Patienten, mit einer allmählichen Abnahme des Durchmessers während der akuten Phase. Die Rolle, die die Antikoagulation bei der Pathogenese und Entwicklung zu einem Pseudoaneurysma gespielt haben könnte, ist schwer festzustellen.
In der wissenschaftlichen Literatur liegen keine endgültigen Daten zur Anwendung der Antikoagulation bei Patienten mit AAS vor, obwohl ein Absetzen dieser Behandlung gängige Praxis ist. Es ist wahrscheinlich, dass die Antikoagulation den natürlichen Verlauf von IMH nicht verändert. Drei Argumente stützen diese Hypothese: a) da die Hämostase keine wesentliche Rolle bei der Pathogenese der Läsion spielt, ist es unwahrscheinlich, dass sie sich auf ihre Auflösung auswirkt; b) IMH ist ein Zustand, der auf das Innere der Aortenwand beschränkt ist und keinen Kontakt mit dem Gefäßlumen hat, so dass es unwahrscheinlich ist, dass das Antikoagulans in die Läsion eindringen würde; und c) epidemiologische Studien haben keine höhere Inzidenz von IMH bei Patienten mit angeborenen oder erworbenen Störungen der Komponenten der Hämostase gezeigt.
Wir schließen daraus, dass in Situationen, in denen eine Antikoagulation erforderlich ist (Patienten mit einem hohen Embolierisiko), diese Behandlung aufrechterhalten werden kann, basierend auf den Ergebnissen dieser Studie, in der die Antikoagulation keinen Einfluss auf die klinische oder morphologische Entwicklung von IMH zu haben schien. Natürlich sind weitere Studien mit größeren Patientenserien erforderlich, um endgültige Schlussfolgerungen zu ziehen.