
Sau (Larry) Lee, Ph.D., stellvertretender Direktor des Office of Testing and Research und Vorsitzender des Emerging Technology Teams, Office of Pharmaceutical Quality, CDER
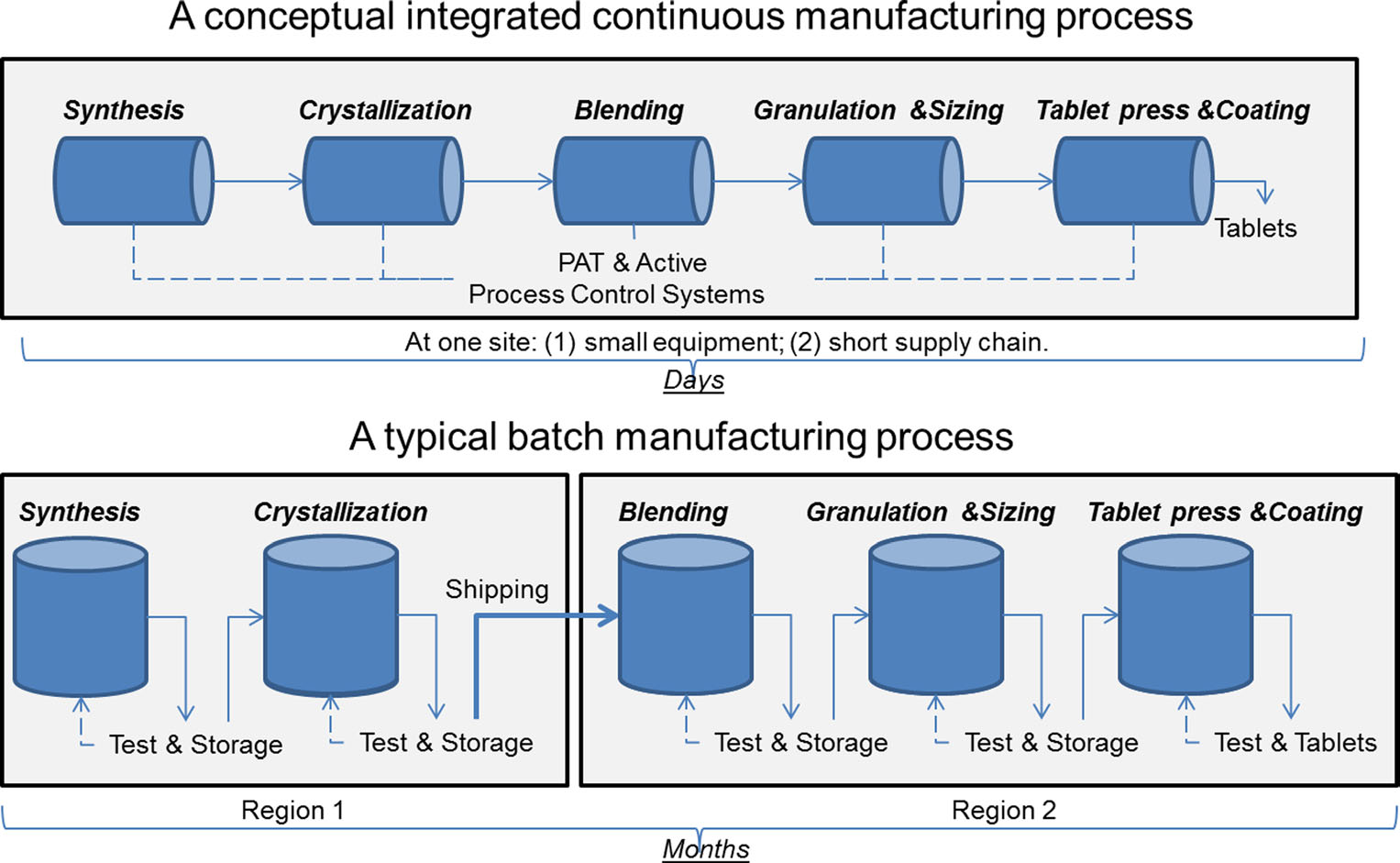 Ein Vergleich von kontinuierlicher Fertigung und Chargenfertigung. Bild mit freundlicher Genehmigung von Sau Lee. J. Pharm. (2015) 10:191-199.
Ein Vergleich von kontinuierlicher Fertigung und Chargenfertigung. Bild mit freundlicher Genehmigung von Sau Lee. J. Pharm. (2015) 10:191-199.Seit mehr als 50 Jahren werden Arzneimittel mit einer Methode hergestellt, die als „Batch Manufacturing“ bekannt ist, einem mehrstufigen, langwierigen Prozess, bei dem unhandliche Großgeräte verwendet werden. Die jüngsten Fortschritte in der Fertigungstechnologie haben die Pharmaindustrie jedoch dazu veranlasst, eine Abkehr von der Serienfertigung zu einem schnelleren und effizienteren Prozess, der als kontinuierliche Fertigung bezeichnet wird, in Betracht zu ziehen. Die FDA unternimmt proaktive Schritte, um die Implementierung neuer Technologien in der Arzneimittelindustrie, einschließlich der kontinuierlichen Herstellung, zu erleichtern, um die Produktqualität zu verbessern und viele der zugrunde liegenden Ursachen für Arzneimittelknappheit und Rückrufe anzugehen.
Batch vs. kontinuierliche Fertigung
Die Batchfertigung umfasst mehrere diskrete Schritte. Nach jedem Schritt im Prozess stoppt die Produktion in der Regel, sodass Proben offline auf Qualität getestet werden können. Während dieser „Haltezeiten“ zwischen den Schritten kann das Material manchmal in Containern gelagert oder an andere Einrichtungen auf der ganzen Welt geliefert werden, um den Herstellungsprozess abzuschließen. Dies kann die Bearbeitungszeit um Wochen oder Monate verlängern. Für einige Wirkstoffe, die für die Umwelt empfindlich sind, kann es auch die Gefahr des Abbaus einführen. Wenn die Nachfrage nach einem bestimmten Medikament steigt, kann eine erhöhte Produktion größere Geräte erfordern. Diese Skalierung von Geräten erfordert mehr physischen Platz, eine größere Stellfläche sowie mehr Zeit und Geld.
Im Gegensatz dazu werden Arzneimittel, die in kontinuierlicher Fertigung hergestellt werden, nonstop innerhalb derselben Anlage bewegt, wodurch Wartezeiten zwischen den Schritten entfallen. Das Material wird durch eine Montagelinie voll integrierter Komponenten geführt. Diese Methode spart Zeit, reduziert die Wahrscheinlichkeit menschlicher Fehler und kann schneller auf Marktveränderungen reagieren. Um der höheren Nachfrage Rechnung zu tragen, kann die kontinuierliche Fertigung über einen längeren Zeitraum laufen, was die Wahrscheinlichkeit von Arzneimittelknappheit verringern kann.
Beide Fertigungsarten unterliegen den gleichen Qualitätskontrollstandards, aber die Überwachung erfolgt in kontinuierlichen Fertigungsanlagen automatisiert und ist tendenziell häufiger als in der Serienfertigung. Wie alle Technologien können kontinuierliche Fertigungsanlagen Verschleiß erfahren, aber eine automatisierte Überwachung kann Probleme erkennen, lange bevor ein Fehler auftritt. Eine solche Überwachung kann auch dazu beitragen, die Lebenserwartung eines Geräts vorherzusagen, was zu einer besseren proaktiven Wartung führt.Schließlich kann die kontinuierliche Fertigung ein flexibleres Tracking und Tracing ermöglichen, was im Falle eines Produktausfalls von Vorteil wäre. Beispielsweise wird bei der Chargenherstellung eine bestimmte Menge (oder Charge) eines Arzneimittels durch die Größe der Ausrüstung definiert, die es hergestellt hat. Bei der kontinuierlichen Herstellung kann eine Menge (oder Charge) durch einen Zeitstempel, die Menge des produzierten Arzneimittels oder die Menge des Rohmaterials abgegrenzt werden. Diese Nachverfolgungsmethoden ermöglichen es dem Hersteller, im Falle eines Prozessfehlers eine geringere Menge an fehlerhaftem Material zu isolieren, was zu weniger Abfall und einer geringeren Wahrscheinlichkeit eines Mangels führt.
Ein herausfordernder, aber lohnender Übergang
Mehrere Branchen — wie die chemische und petrochemische Industrie — haben bereits eine Fertigungsentwicklung durchlaufen und verwenden effiziente kontinuierliche Technologien, um Produkte sicher herzustellen. Für die Pharmaindustrie steht der Übergang zur kontinuierlichen Fertigung jedoch aus mehreren Gründen noch am Anfang. Erstens können die Anlaufkosten für einen solchen Übergang hoch sein. Die Einstellung alter Batch-Geräte, der Kauf neuer Technologien und die Schulung von Mitarbeitern in deren Verwendung sowie die Modernisierung der Brancheninfrastruktur sind teuer und erfordern ein ernsthaftes Engagement eines Arzneimittelherstellers. Wirtschaftliche Analysen haben jedoch gezeigt, dass erhebliche langfristige Einsparungen möglich sind. Darüber hinaus müssen einige Technologien noch ausgereift sein, bevor sie kommerziell rentabel sind. Für bestimmte Arten von Arzneimitteln, wie biologische Produkte, existiert die Technologie zur Herstellung durch kontinuierliche Herstellung möglicherweise noch nicht. Forschung ist im Gange, um diese und andere Herausforderungen anzugehen. Darüber hinaus nehmen Arzneimittelhersteller immer noch regulatorische Unsicherheiten wahr, die die Produktzulassung verzögern können, wenn eine neue Herstellungstechnologie verwendet wird.
Während die Branche überlegt, wie sie den Wechsel vornehmen soll, stellt die FDA Ressourcen und Informationen zur Verfügung, um den Übergang zu erleichtern. Beispielsweise arbeitet die Agentur mit der Biomedical Advanced Research and Development Authority zusammen, einem Programm des US-Gesundheitsministeriums, um die Forschung in diesem Bereich zu finanzieren und zu unterstützen. Wir schulen auch unsere Prüfer und führen interne Untersuchungen zu Risikobereichen durch, die mit der kontinuierlichen Fertigung verbunden sind, damit wir verwandte Technologien besser bewerten können.
Ich leite ein multidisziplinäres Team im Rahmen des Emerging Technology Program im CDER Office of Pharmaceutical Quality. Das Programm wurde ins Leben gerufen, um der Industrie bei der Implementierung innovativer Technologien zur Verbesserung der Produktqualität und Modernisierung der Branche zu helfen, um die zugrunde liegenden Ursachen für Arzneimittelknappheit oder Rückrufe zu bekämpfen. Das Emerging Technology-Programm befasst sich nicht nur mit kontinuierlichen Fertigungstechnologien, sondern auch mit anderen Fortschritten wie dem 3D-Druck, neuartigen Darreichungsformen und neuartigen Behältersystemen. Im Rahmen dieses Programms arbeiten wir frühzeitig mit der Industrie zusammen, um neue Technologien zu entwickeln, und diskutieren alle erwarteten regulatorischen oder wissenschaftlichen Fragen, die Teil einer zukünftigen Anwendung sein könnten.
Viele Unternehmen haben sich wegen ihres Interesses an kontinuierlicher Fertigung beim Emerging Technology Program beworben. Das FDA-Dokument mit dem Titel Advancement of Emerging Technology Applications to Modernize the Pharmaceutical Manufacturing Base Guidance for Industry enthält Informationen und Ratschläge zur Zusammenarbeit mit der Agentur zu Beginn des Entwicklungsprozesses.Lesen Sie mehr über die Bemühungen der FDA zur Modernisierung der Arzneimittelherstellung im Voice-Blog der FDA.