Das erste biologische Medikament, humanisiertes Insulin (5,8 kDa), wurde 1982 nach dem Aufkommen der Biotechnologie verfügbar und markierte eine neue Ära in der pharmazeutischen Industrie. Moderne Fortschritte in der Biotechnologie erlauben großflächige Synthesen von Biologika auf mehr oder weniger kostengünstige Weise. Nachdem Biologika einst mit großen Peptiden und rekombinanten Proteinen begonnen hatten, umfassen sie heute eine breite Palette anderer Entitäten, wie Antikörper, monoklonale Antikörper und in jüngerer Zeit Nanobodies und verwandte Objekte, lösliche Rezeptoren, rekombinante DNA, Antikörper-Wirkstoff-Konjugate (ADCs), Fusionsproteine, Immuntherapeutika und synthetische Impfstoffe.
Der ‚aufsteigende Stern‘ der Biologika hat die zunehmende Aufmerksamkeit von Pharmafachleuten und Branchenanalysten auf sich gezogen, da dieses alternative Paradigma der Wirkstoffforschung eine erhebliche geschäftliche Herausforderung für das traditionellere Paradigma der niedermolekularen Wirkstoffforschung darstellt, das die Pharmaindustrie seit mehr als einem Jahrhundert definiert.
Es stellt sich also die Frage: Verlieren kleine Moleküle als Forschungsobjekte für die Wirkstoffentdeckung in der modernen Welt des biologischen Fortschritts an „Attraktivität“? Einige Experten bleiben optimistisch, was das Potenzial kleiner Moleküle angeht, das Rennen in zukünftigen pharmazeutischen Pipelines anzuführen, andere sehen, dass „Geld die Taschen wechselt“, und die Forschung an kleinen Molekülen wird von Aktionären und Investoren zugunsten von Biologika zunehmend vernachlässigt.
Um herauszufinden, wohin sich die Branche bewegt, beginnen wir zunächst mit ein paar Statistiken. Über einen Zeitraum von 7 Jahren (2010-2017) U.S. Die Food and Drug Administration (FDA) genehmigte insgesamt 262 neue molekulare Einheiten (NMEs), ausgenommen mehrere diagnostische Bildgebungsmittel und 1 Insulinanalogon (ref). Es scheint, dass 76% von ihnen kleine Moleküle sind (199), wobei nur ein Viertel Biologika sind. Interessant, Es gibt kein offensichtliches Wachstum der NMEs-Zulassungen für Biologika im Vergleich zu kleinen Molekülen, da beide Kategorien von Therapeutika auf ziemlich ähnliche Weise tendieren, wie in der folgenden Abbildung gezeigt. Da die Preise für Biologika jedoch sehr unterschiedlich sind (sie sind viel teurer), sieht das Bild beim Gesamtumsatz und Umsatzwachstum anders aus: Im Zeitraum von 2011 bis 2017 ist der Umsatz mit Biologika um 70% auf 232 Milliarden US-Dollar gestiegen. Der Anteil der Biologika am gesamten Pharmamarkt stieg von 16% im Jahr 2006 auf 25% im Jahr 2016, ohne erkennbare Anzeichen einer Verlangsamung (ref).
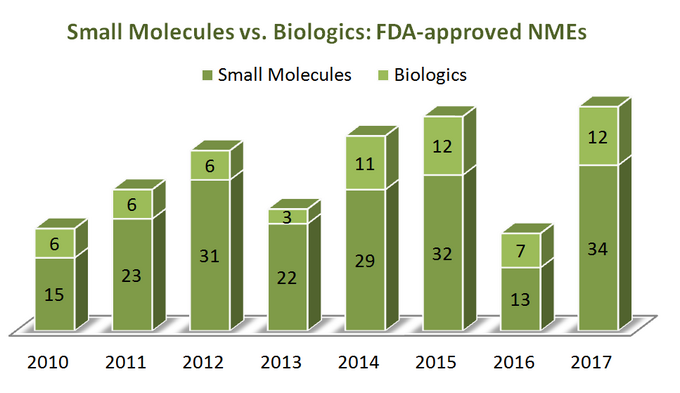
Zwar gibt es deutliche Vorteile von Biologika über kleine Moleküle in mehrfacher Hinsicht (zum Beispiel ihre tiefe Selektivität), sind die Dinge nicht „schwarz-weiß“, wenn diese beiden Kategorien von Therapeutika durch ihre Attribute zu vergleichen, da beide erhebliche Vor- und Nachteile haben bei der strategischen Entscheidungsfindung zu berücksichtigen. So scheint es ein wenig bedauerlich zu sehen, wie zahlreiche Berichte SMS im Vergleich zu Biologika in einem Streben nach „Frische“ ihrer Standpunkte beiseite geschoben haben.Eine Tabelle unten fasst einige starke und schwache Aspekte beider Kategorien (ref, ref) zusammen, die Herausforderungen und Möglichkeiten in beiden „Lagern“ veranschaulichen (Anmerkung Farben: grau – kein offensichtlicher Vorteil in keinem Lager; grün – vorteilhafte Situation; gelb – nachteilige Situation):
Kleine Moleküle |
Biologika |
|---|---|
|
Allgemeine Eigenschaften |
|
|
Niedrige Molekulargewichte (0,1 – 1 kDa); normalerweise chemisch und thermisch stabil, großer Polaritätsbereich. |
Sehr große Molekulargewichte >1 kDa; im Allgemeinen polar, hitzeempfindlich, leicht abbaubar (mit Ausnahme einiger langlebiger Typen wie monoklonaler Antikörper) |
|
Selektivität, Sicherheit |
|
|
Eher promiskuitiv, binden in der Regel an verschiedene -Zielstellen, einschließlich Nebenwirkungen oder Toxizität.Schließlich hatten es biologische Entwickler leichter, Patente zu erhalten, weil es auf diesem Gebiet wenig oder gar keinen Stand der Technik gab, als aktuelle Blockbuster entdeckt wurden. |
Sehr spezifisch für die Ziele, im Allgemeinen von geringerer Toxizität (mit einer großen Ausnahme ist die Immunogenität, die die Effizienz, Sicherheit und Disposition von Biologika ernsthaft beeinflussen kann). |
|
Zellpermeabilität |
|
|
SMs binden an Ziele wie G-Protein-gekoppelte Rezeptoren (GPCRs), ligandengesteuerte Ionenkanäle und Rezeptor-Tyrosinkinasen auf den extrazellulären oder intrazellulären Domänen. Sie können auf Ziele in den intrazellulären Regionen, Zytosole, Kerne und sogar ZNS-Ziele zugreifen, die durch die enge Blut-Hirn-Schranke (BBB) getrennt sind. |
Ein großer Teil der pharmakologischen Targets ist eingebettet und daher für Biologika unzugänglich. Insbesondere wenn es um das zentrale Nervensystem (ZNS) geht, ist das Vorhandensein der Blut-Hirn-Schranke ein Haupthindernis auf dem Weg von Molekülen, die größer als 600 Da sind und bis zu 98% der SMs und praktisch aller Biologika einschränken. |
|
Lieferung |
|
|
Weitgehend fallen in „Regel von fünf“ für oral absorption,, der es geeignet für oral lieferung. Die weitere Permeabilität über das Darmepithel wird primär durch eine Kombination aus passiver Diffusion und parazellulärem Transport vermittelt. |
Intrinsische Instabilität und hohe molekulare Massen machen fast alle Biologika oral inaktiv. Meist invasive Lieferung oder alternative nicht-invasive Technologien im Gange. |
|
Verteilung |
|
|
SMs werden über den Blutkreislauf verteilt, wodurch hohe Konzentrationen schnell erreicht werden können. |
Bei größeren Molekülen (z.B. >10 kDa) dominiert ein langsameres (um das 100-500-fache) Lymphsystem im Verteilungsprozess. Größere Biologika verteilen sich sowohl über das Blut als auch über das Lymphsystem durch konvektiven Transport, rezeptorvermittelte Endozytose, Phagozytose und Pinozytose. Das Ergebnis dieser Situation ist, dass größere Biologika im Vergleich zu SMs längere Halbwertszeiten, begrenzte Verteilungsvolumina und mehr Zeit benötigen, um Spitzenkonzentrationen zu erreichen. |
|
Disposition (Metabolismus) |
|
|
Die meisten SMs werden von nicht zielgerichteten Organen entsorgt – über Cytochrom- oder Nicht-Cytochrom-Metabolismen, Nierenfiltration oder fäkale Ausscheidung. |
Biologika haben engere Wechselwirkungen mit Zielen, so dass ihre Dispositionen direkt von ihrer Bindung beeinflusst werden (rezeptorvermittelte Arzneimitteldisposition), einschließlich der Clearances von Biologika durch Proteasen und Peptidase. |
|
Arzneimittel-Wechselwirkungen |
|
|
SMS sind anfällig für Arzneimittel–Wechselwirkungen, die aufgrund der Anwesenheit von Begleitmedikamenten auftreten können, die ihren Transport, Stoffwechsel, Transport oder Eliminationswege beeinflussen. |
Biologika sind weniger anfällig für traditionelle Arzneimittelwechselwirkungen, da sie als endogene Substrate metabolisiert und eliminiert werden. Es gibt jedoch dokumentierte Zytokin-vermittelte Veränderungen in arzneimittelmetabolisierenden Enzymen, daher müssen arzneimittelbiologische Wechselwirkungen bewertet werden, falls das Arzneimittel die Expression von Stoffwechselenzymen beeinflussen könnte. |
|
Geschäftliche Aspekte |
|
|
Niedrige Preise für SM-Medikamente. |
Typischerweise sehr hohe Preise für Biologika Behandlungen. Dies wird als einer der Gründe angesehen, warum Biologika im Vergleich zu SMS eine bessere gesamtwirtschaftliche Rendite zu erzielen scheinen. |
|
Hohe Abnutzungsrate (eine Studie der KMR Group aus dem Jahr 2009 zeigte, dass nur 7,1% der SMS, die in präklinische Tests eingeführt wurden, schließlich den Markt erreichten). |
Relativ niedrige Abnutzungsrate (dieselbe KMR-Gruppenstudie ergab, dass 24,4% der Biologika im präklinischen Stadium bis zur Marktreife überlebten). |
|
Severe competition from chemical generics after patents expiration. |
Biologics developers face less severe competition from biosimilars, after patents expiration. |
|
Simpler drug discovery/development process. |
More expensive and complex drug discovery and development process, compared to biologics. |
In Anbetracht des obigen Vergleichs wird deutlich, dass Biologika kein „Wundermittel“ sind und die Industrie in absehbarer Zeit nicht von Biologika dominiert wird, sondern ein Wettbewerbsgleichgewicht zwischen kleinen Molekülen, Biologika und hybriden Formen von Therapeutika wie ADCs aufrechterhalten wird – mit lokaler Dominanz jeder Form in geeignetere Therapiegebiete, Anwendungsfälle etc.
Im Folgenden finden Sie eine Liste mehrerer Industrietreiber, die auf der Seite der kleinen Moleküle spielen und das Kräfteverhältnis im gesamten Pharmamarkt zugunsten chemischer Ausgangspunkte beeinflussen könnten:
Der Aufstieg der künstlichen Intelligenz (KI) in der Wirkstoffforschung
Nach Durchbrüchen bei Deep-Learning-Algorithmen (2012) und in jüngerer Zeit der Schaffung generativer kontradiktorischer Netzwerke (GANs), die sich bei einer Reihe von Forschungsaufgaben auszeichnen können, ist das Interesse an verschiedenen KI-Technologien in den letzten Jahren sprunghaft angestiegen so ziemlich jede Branche. Viele KI-gestützte Tools sind schnell zum kommerziellen Mainstream geworden, wie Chatbots, persönliche Assistenten, Autopiloten usw.– das ist ein realer Proof of Concept der KI-Machbarkeit. Die Wirkstoffforschung ist keine Ausnahme von diesem „KI-getriebenen Trend“, und die Zahl der Startups, die versuchen, KI anzuwenden, um die Wirkstoffforschung auf unterschiedliche Weise zu fördern, ist in nur wenigen Jahren erheblich gewachsen und hat bisher über hundert aktive Unternehmen erreicht (hier ist eine Liste von einigen von ihnen).Interessanterweise konzentriert sich die Mehrheit der KI-gesteuerten Startups eher auf die Entdeckung kleiner Moleküle als auf Biologika, was wahrscheinlich nicht überraschend ist. Historisch gesehen wurden auch Nicht-KI-Rechenmethoden (Cheminformatik) aufgrund ihrer wesentlich einfacheren molekularen Strukturen und Interaktionsmuster hauptsächlich für niedermolekulare Therapeutika eingesetzt.Das folgende Diagramm zeigt eine geschätzte Statistik für 61 aktiv vermarktete Drug Discovery Startups, die spezialisierte KI-Tools in ihrem Forschungsworkflow entwickeln oder anwenden. Wie Sie sehen, konzentriert sich die Hälfte aller Unternehmen (51%, 31 Startups) auf kleine Moleküle, während nur 23% (14 Startups) an der Entdeckung / Entwicklung biologischer Medikamente (Antikörper, Impfstoffe usw.) beteiligt sind. Das Missverhältnis zu kleinen Molekülen wird auch durch die Höhe der VC-Finanzierung veranschaulicht, die gemeinsam von 610 KI-gesteuerten Startups (nur öffentlich bekannt gegebene Runden) aufgebracht wurde – wobei 770 Millionen in Unternehmen investiert wurden, die an kleinen Molekülen beteiligt waren, und nur etwas mehr als 200 Millionen wurden für Start-ups mit Schwerpunkt auf Biologika bereitgestellt – wie unten gezeigt.
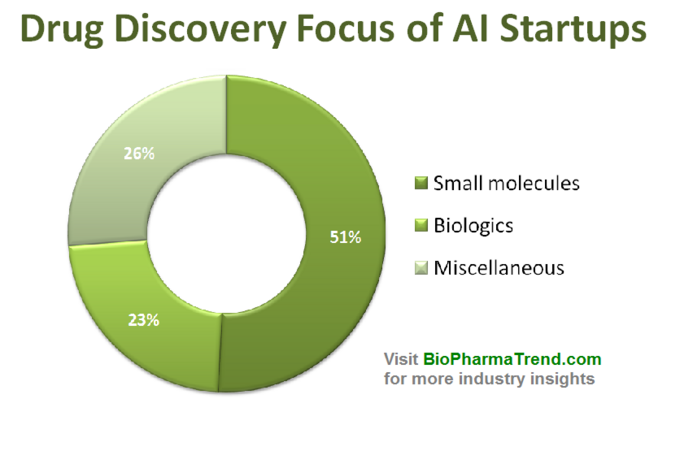
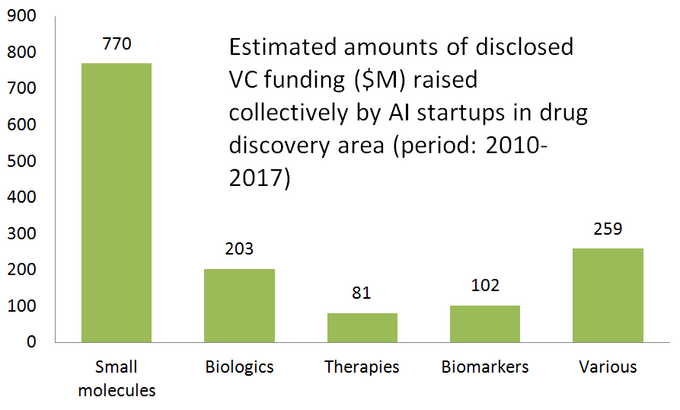
Diese Situation deutet darauf hin, dass die jüngsten Fortschritte bei KI-Algorithmen und ein Trend zur Anwendung des maschinellen Lernens für die pharmazeutische Forschung im Frühstadium tendenziell mehr Wachstum in der Entdeckung von niedermolekularen Arzneimitteln im Vergleich zur Entdeckung von Biologika bewirken – zumindest vorerst. Dies könnte zu mehr zukünftigen Investitionen in auf kleine Moleküle ausgerichtete Projekte führen, die von KI-gesteuerten Technologien unterstützt werden.
Erreichen „undruggable“ Targets
So wichtige Targets wie beispielsweise Protein-Protein-Wechselwirkungen (PPIs) werden traditionell von Biologika (mAbs) als potentielle Akteure dominiert, während kleine Moleküle in diesem Fall aufgrund ihrer geringen Größe lange als ungeeignet galten.
Mit den Fortschritten in der Pharmakogenomik kann sich diese Situation nach den Zulassungen Maraviroc (514 Da) und Tirofiban (441 Da) ziemlich schnell ändern. Es wurde rechnerisch gezeigt, dass SMs tatsächlich relativ hohe Affinitäten zu spezifischen Grenzflächen von Proteinen haben können und, was wichtig ist, sie können die ‚intrinsisch ungeordneten Proteinregionen‘ modulieren, die mit einer Reihe komplexer Systemkrankheiten verbunden sind. Hier ist eine interessante Vertuschung dieses Themas, die einige der wichtigen Erkenntnisse über PPI-Maschinen zusammenfasst, die in den letzten Jahrzehnten gewonnen wurden.
Ein weiteres schnell wachsendes Gebiet für die Entdeckung von niedermolekularen Wirkstoffen ist das Targeting von Ribonukleinsäure (RNA). Dieses Thema wurde in „Top 7 Trends in der pharmazeutischen Forschung im Jahr 2018“ aufgeführt, und es gab auch eine detaillierte Überprüfung des Themas in der Zellchemischen Biologie und eine schöne Industrie Vertuschung in C&EN.
Eine weitere neue Idee, die Kraft kleiner Moleküle freizusetzen, wurde kürzlich in einem Artikel „Targeted protein degraders are redefining how small molecules look and act“ diskutiert, der 2018 in C&EN veröffentlicht wurde. Die Strategie besteht hier darin, bifunktionale kleine Moleküle zu entwickeln, die in der Lage sind, ein gezieltes Protein insgesamt zum Proteasom, der Müllentfernungsmaschine der Zelle, zu leiten, anstatt nur die Wirkung des Proteins wie bei einem ‚traditionellen‘ Ansatz zu hemmen.
Überwindung der Grenzen von Screening-Technologien
Ein Großteil des Forschungspotenzials kleiner Moleküle wurde aufgrund verschiedener technologischer Einschränkungen von Screening-Ansätzen, die zur Identifizierung von Ansatzpunkten in Wirkstoffforschungsprogrammen verwendet werden, noch nicht realisiert.Ein solches Beispiel ist der phänotypische Screening-Ansatz, der heutzutage aufgrund mehrerer technologischer Fortschritte eine Renaissance erlebt, einschließlich der zunehmenden Fähigkeit, physiologisch relevante Zellmodelle, Auslesungen und hochentwickelte Nachweistechnologien zu entwickeln, die helfen, Wirkungsmechanismen (MoA) effizienter aufzudecken und die Unsicherheit zu minimieren. Auf der anderen Seite bietet die Implementierung von groß angelegten Profilierungstechniken und Rechenmethoden eine neue Ebene der Systemanalyse und des Verständnisses von niedermolekularen Phänotypen. Ein weiteres vielversprechendes Screening-Paradigma ist die Verwendung von DNA-kodierten Bibliotheken (DELs). Aufgrund ihrer einzigartigen Anordnung bietet die DEL-Technologie eine geeignete Möglichkeit, Hunderte von Millionen und sogar Milliarden neuartiger Moleküle in zielbasierten Wirkstoffforschungsprogrammen zu testen. Während diese Technologie nicht ohne Herausforderungen ist (z. B. Einschränkungen der DNA-kompatiblen Chemie, Unsicherheit bei Screening-Treffern usw.), wächst das Gebiet schnell und wird sogar als ‚revolutionär‘ für die Entdeckung von niedermolekularen Arzneimitteln angesehen.
Barriere der Synthetisierbarkeit überwinden
Einer der Stolpersteine der frühen Wirkstoffforschung in kleinen Molekülen ist die Einschränkung des synthetisch zugänglichen chemischen Raums – während viele vielversprechende chemische Ideen rechnerisch oder auf andere Weise generiert werden können, besteht immer das Risiko, dass die Synthese des gesamten Satzes von Verbindungen zur Validierung solcher Ideen kostspielig oder sogar undurchführbar wäre.
Jüngste Fortschritte in diesem Bereich wurden wiederum mit KI-basierter Software erzielt, die eine Syntheseplanungsleistung auf menschlicher Ebene bietet. Zum Beispiel hat BenevolentAI kürzlich ein Papier in Nature veröffentlicht, in dem beschrieben wird, wie sie tiefe neuronale Netze in Kombination mit modernen Baumsuchalgorithmen verwendeten, um die Synthese neuartiger Moleküle mit bemerkenswerter Erfolgsrate und Geschwindigkeit zu planen.
Mehrere interessante Vertuschungen mit reichhaltigen Kommentaren wurden hier und hier von Derek Lowe veröffentlicht, die etwas mehr Einblick in dieses faszinierende Gebiet der organischen und medizinischen Chemie geben.
Eine empirischere Strategie wurde von einem Chemieproduzenten Enamin entwickelt, der als REAL Chemical Space bekannt ist und derzeit über 3 umfasst.8 milliarden synthetisch zugängliche und durchsuchbare Moleküle für die Hit-Exploration und andere Aufgaben der medizinischen Chemie. Das Konzept läuft darauf hinaus, eine Reihe von intern validierten chemischen Routen (über 100 Reaktionen) auf einen großen Pool chemischer Bausteine anzuwenden, die im eigenen Bestand verfügbar sind (über 100 Tausend Verbindungen) – mit dem Ziel, sie kombinatorisch zu kombinieren, um eine Kaskade größerer „bleiähnlicher“ oder „arzneimittelähnlicher“ Moleküle zu erzeugen. Sobald ein gewisses Maß an Reproduzierbarkeit und Ausbeute in einer ausreichend großen Anzahl von Experimenten (mindestens 80%) erreicht ist, findet eine weitere rechnerische Aufzählung statt, um basierend auf den experimentell validierten Fällen einen breiteren chemischen Raum aufzubauen.
New R&D Märkte und Rollen für kleine Moleküle
Alles in allem kann man die Größe und das Wachstumspotenzial von Small molecules Pipelines übersehen oder missverstehen, wie während einer Podiumsdiskussion auf der Interphex erwähnt wurde. Derzeit sind rund 8000 kleine Moleküle in R&D aktiv, ein Wachstum von 25% in den letzten Jahren. Die oben aufgeführten Wachstumstreiber können zu einem weiter beschleunigten Wachstum in diesem Sektor führen.
Es ist auch wichtig zu beachten, dass niedermolekulare Medikamente eine wichtige Rolle in einigen Medikamenten der nächsten Generation spielen könnten, so dass sie auf niedermolekulare Pipelines angewiesen sind. Bei der Stammzelltherapie können beispielsweise kleine Moleküle therapeutische Reaktionen auslösen.
Wie Jeffrey Shumway von MilliporeSigma während der CPhI North America hervorhob, werden niedermolekulare Produkte tendenziell komplexer und verändern ihre Rolle in der (bio-) pharmazeutischen Industrie.Der zukünftige Bereich für kleine Moleküle sind Antikörper-Wirkstoff-Konjugate und verwandte Objekte, die sich aufgrund der natürlichen Konvergenz zweier Wirkstoffforschungsparadigmen und mehrerer technologischer Trends zu einer vielversprechenden Klasse von Therapeutika entwickelt haben. Haftungsausschluss: Die Informationen dienen nur der allgemeinen Information und sind keine rechtlichen / finanziellen / Aktienhandels- / medizinischen Ratschläge jeglicher Art. Sie lesen es auf eigene Faust und jede Verwendung dieser Informationen erfolgt auf eigenes Risiko. Es liegt in Ihrer Verantwortung, die Nützlichkeit und Sicherheit der Informationen in diesem Beitrag zu bewerten, und das Internet im Allgemeinen, und wie es gilt für Ihre eigene Situation und dann die zuständigen Experten für professionelle Beratung konsultieren, falls erforderlich.
Themen: Branchentrends