Vise
1) Déterminer la fréquence réelle de sensibilisation aux allergènes de contact les plus courants présents dans les produits ophtalmiques. 2) Évaluer la pertinence clinique des résultats et détecter les sources de sensibilisation.
Méthodes
Un nombre total de 1881 patients (âge moyen 46,5 ans, 357 hommes, 1 524 femmes) atteints de dermatite périorbitaire ont subi un test de patch entre les années 2001 et 2016 et ont été inclus rétrospectivement dans notre étude.
Résultats
Conclusion
Les allergènes les plus importants dans les produits ophtalmologiques de notre étude étaient le sulfate de néomycine suivi du chlorure de benzalkonium.
Pour chaque cas de dermatite périorbitaire, des tests de patch doivent être envisagés, non seulement avec les allergènes d’essai commerciaux, mais également avec les préparations ophtalmiques réelles du patient.
Mots clés
Dermatite périorbitaire, tests de patch, Allergènes de contact
Introduction
La dermatite périorbitaire est un problème assez courant en dermatologie et également en ophtalmologie. Il peut être d’origine allergique ou non allergique. Les maladies non allergiques comprennent la dermatite de contact irritante, la dermatite atopique (figure 1) et la dermatite séborrhéique. La dermatite allergique de contact périorbitaire peut être causée par des produits cosmétiques, des vernis à ongles, des colorants capillaires, certains allergènes de contact en suspension dans l’air (plantes, époxyde et autres résines) ou par des préparations ophtalmologiques. L’apparition clinique de la dermatite de contact allergique dans la région périorbitaire comprend une rougeur, souvent avec gonflement des paupières (Figure 2), en phase aiguë parfois avec des croûtes suintantes, en phase subaiguë et chronique avec une rougeur et un gonflement moins marqués mais avec une desquamation plus importante. La différenciation de la dermatite allergique de la dermatite non allergique ainsi que l’identification de la cause de l’allergie doivent être effectuées par des tests dits patch. L’identification des médicaments ophtalmologiques comme cause de la dermatite périorbitaire peut être parfois très difficile car les patients utilisent fréquemment en alternance de nombreux produits ophtalmologiques différents. De plus, il n’existe pas de série de tests de patch ophtalmique normalisés et il n’existe pas de composés purs pour les tests de patch. Entre les années 2001 et 2016, nous avons mené une étude rétrospective chez des patients atteints de dermatite périorbitaire qui ont été testés par patch à la clinique de dermatovénérologie du St. Hôpital de la Faculté Anne à Brno, en République tchèque, dans le but de déterminer la fréquence réelle de sensibilisation aux allergènes de contact les plus courants présents dans les produits ophtalmiques.
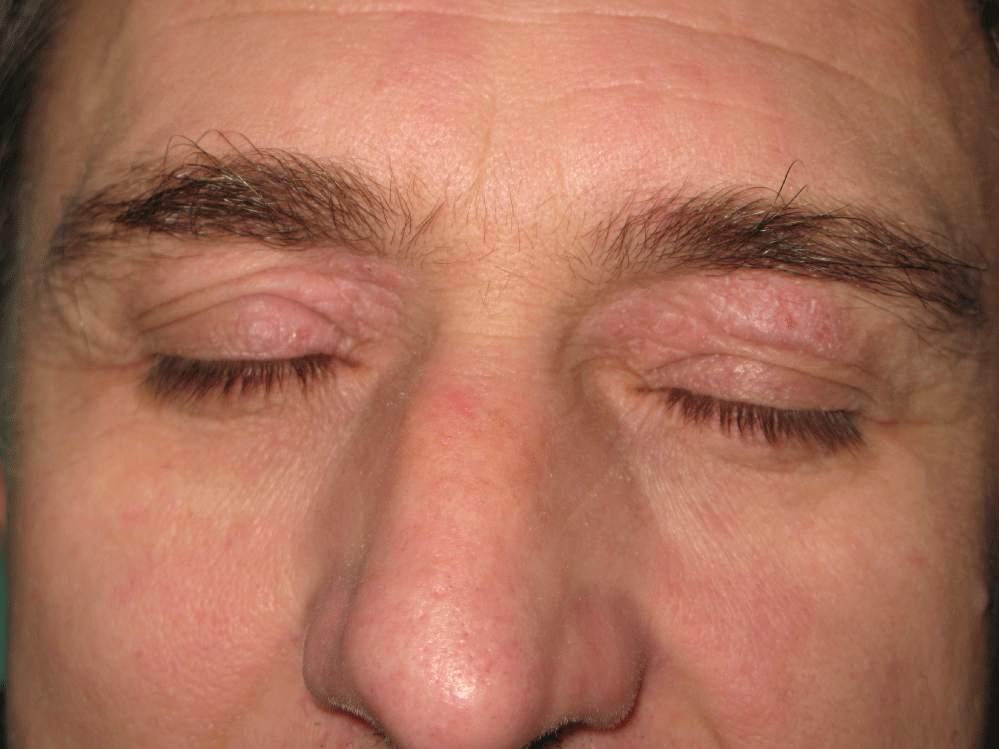 Figure 1: Dermatite atopique dans la région périorbitale. Voir la figure 1
Figure 1: Dermatite atopique dans la région périorbitale. Voir la figure 1
 Figure 2: Dermatite de contact allergique périorbitaire aiguë avec gonflement important des paupières. Voir la figure 2
Figure 2: Dermatite de contact allergique périorbitaire aiguë avec gonflement important des paupières. Voir la figure 2
Matériel et méthodes
Entre les années 2001 et 2016, 1881 patients (âge moyen 46 ans.5 ans) avec une dermatite périorbitaire ont été inscrits dans notre étude. Parmi eux, 357 hommes (âge moyen 43,9 ans) et 1524 femmes (âge moyen 47,0 ans). Tous les patients ont été testés par patch et des données cliniques et anamnestiques ont été enregistrées avant le test. Un patch test (épicutané) est une méthode de diagnostic utilisée pour identifier la cause de la dermatite de contact allergique (un type d’allergie retardé). Le principe des tests de patch est d’exposer une petite zone de la peau (généralement sur le dos) à l’allergène suspecté dans une quantité, une concentration et un véhicule normalisés. Le patch peut être un petit morceau de patch filtrant, une chambre en plastique, une chambre en aluminium ou même un gel préalablement imprégné d’un allergène (ce qu’on appelle de vrais tests). L’allergène est placé sur le patch, puis placé sur la peau du haut du dos du patient, où les patchs sont maintenus en place avec des bandes de ruban adhésif et restent intacts généralement pendant 48 heures (figure 3). Les patchs sont ensuite retirés et, en cas d’allergie, une réaction eczémateuse (papules, papulovésicules) est visible dans la zone testée. La sévérité de la réaction est marquée par des signes +. L’évaluation est effectuée le lendemain (72 heures après l’application), le lendemain (après 96 heures) et, dans certains cas (par exemple, test de corticostéroïdes), même une semaine après l’application. Cette lecture répétée est nécessaire, car en cas de véritable allergie, la réaction augmente au cours de jours consécutifs, tandis qu’en cas de réaction irritante (non allergique), elle diminue généralement (la réaction la plus forte se produisant le jour où les tests sont supprimés, moment auquel la réaction commence à s’estomper). La méthodologie des tests de patch a été normalisée par l’International Contact Dermatitis Research Group (ICDRG) et nous suivons strictement ces règles lors des tests de patch chez nos patients. Avec nos tests de patch, nous avons utilisé des allergènes de contact de la Société Chemotechnique et des bandes de Curatest de Lohmann &Rauscher. Les tests patch sont contre-indiqués en cas de dermatite aiguë, ou lorsqu’une éruption cutanée est présente dans la zone d’essai et lorsque la peau de la zone d’essai est fortement bronzée. Les substances toxiques ou toxiques ou les substances à pH extrêmement élevé ou faible ne doivent pas être testées par patch. Les tests sont problématiques chez les patients recevant un traitement immunosuppresseur simultané (peuvent entraîner des résultats faussement négatifs en fonction de la dose d’immunosuppresseurs). La série de référence européenne (tableau 1) des allergènes de contact a été testée chez tous nos patients ainsi que d’autres allergènes de contact suspectés en fonction des antécédents des patients. Rétrospectivement, la fréquence de sensibilisation aux allergènes de contact les plus courants présents dans les produits ophtalmiques (thimérosal, chlorure de benzalkonium, néomycine et paraben-mix) a été évaluée.
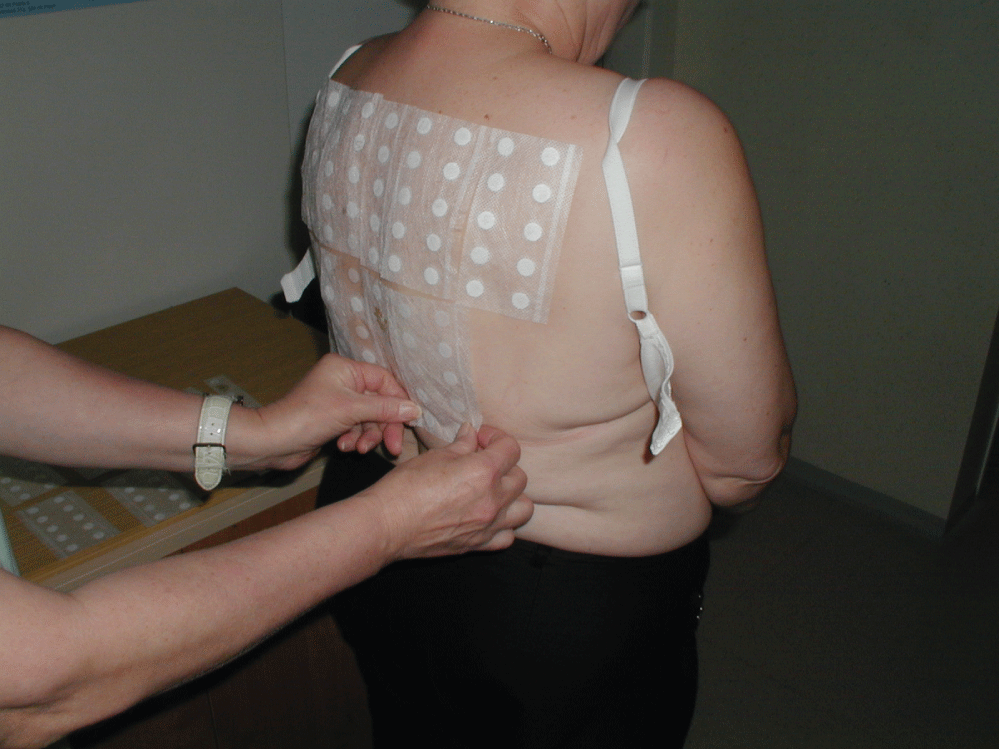 Figure 3 : Application des tests de patch. Voir la figure 3
Figure 3 : Application des tests de patch. Voir la figure 3
Tableau 1 : séries de référence européennes. Voir le tableau 1
Résultats
La fréquence de sensibilisation par contact à certains allergènes présents dans les produits ophtalmiques est indiquée dans le tableau 2. La fréquence de sensibilisation la plus élevée a été observée avec le thimérosal (9,7% des patients), mais parmi ces patients, un seul cas d’allergie a été causé par l’utilisation d’un produit ophtalmique avec le thimérosal. La deuxième fréquence la plus élevée a été enregistrée avec le sulfate de néomycine (2.6%), où 22 patients sensibilisés avaient déjà utilisé un produit ophtalmique contenant du sulfate de néomycine. La troisième sensibilisation allergique la plus élevée était le chlorure de benzalkonium (1,3%), et parmi les patients allergiques au chlorure de benzalkonium, 3 patients avaient déjà utilisé des produits ophtalmiques contenant l’allergène (figure 4). La sensibilisation aux parabènes était la moins fréquente (0,6%), où aucun des patients n’avait utilisé de produit ophtalmique contenant des parabènes (Figure 5 et Figure 6).
Tableau 2: Fréquence de sensibilisation aux allergènes sélectionnés utilisés dans les produits ophtalmologiques. View Table 2
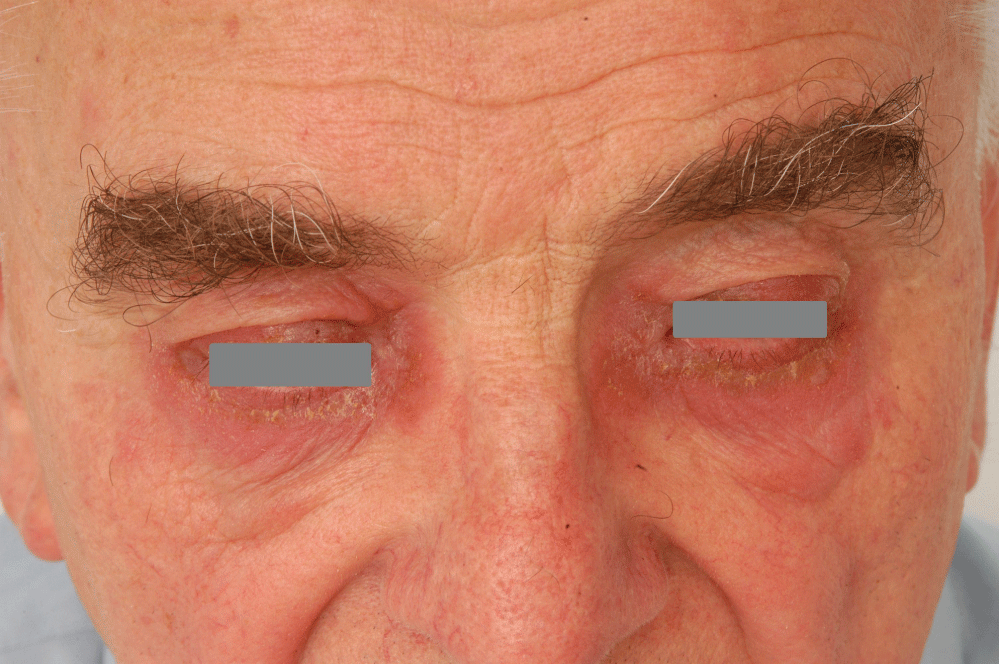 Figure 4: Allergic contact dermatitis to benzalkonium chloride. View Figure 4
Figure 4: Allergic contact dermatitis to benzalkonium chloride. View Figure 4
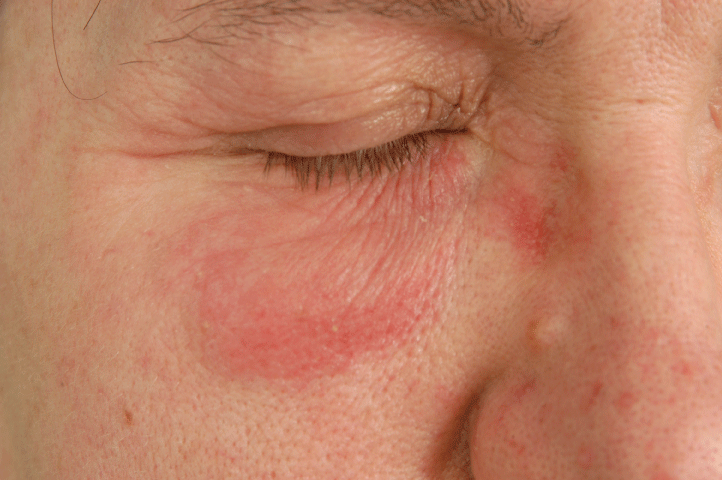 Figure 5: Allergic contact dermatitis to parabens. View Figure 5
Figure 5: Allergic contact dermatitis to parabens. View Figure 5
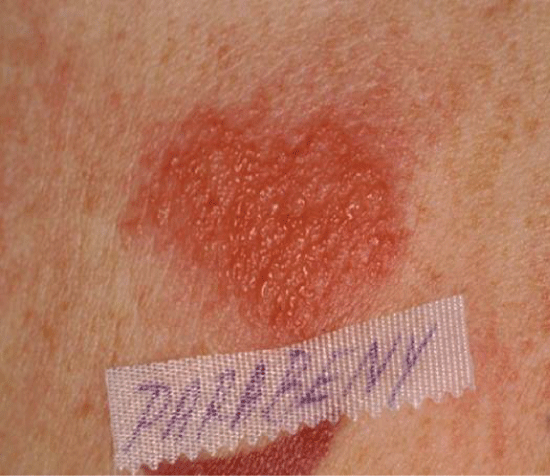 Figure 6: Positive patch test to parabens. Voir la figure 6
Figure 6: Positive patch test to parabens. Voir la figure 6
Discussion
Le thimérosal (merthiolate ou thiomersalate) ou le salicylate d’éthylmercure de sodium est un composé organique du mercure utilisé comme conservateur et désinfectant dans les lentilles de contact, les solutions oculaires, les vaccins et les encres de tatouage. Le thimérosal est composé de deux radicaux : un mercurial organique et un thiosalicylate. Bien que les deux composants puissent provoquer des réactions allergiques, la proportion d’éthylmercure dans le thimérosal agit généralement comme déterminant allergique. L’hypersensibilité au thimérosal ne signifie pas nécessairement une allergie au mercure. Les rapports de réactions croisées entre le thimérosal et d’autres composants du mercure sont peu fréquents. En ce qui concerne l’incidence des allergies au thimérosal, il existe une variabilité géographique importante. Aux États-Unis, l’incidence des allergies au thimérosal atteint 15%, tandis que les taux correspondants en Suède et au Danemark sont d’environ 3 à 4%. Ces différences sont dues à des variations dans la disponibilité et l’utilisation des produits contenant du thimérosal dans chaque pays. La pertinence clinique des réactions thimérosales est souvent controversée. Une étude menée par le North American Contact Dermatitis Group (NACDG) a révélé que la prévalence et la pertinence clinique des réactions thimérosales variaient de 10,9% à 16,8 % chez les 4 087 personnes évaluées. La forte prévalence des réactions thimérosales dans la population a conduit l’American Contact Dermatitis Society à désigner la substance comme « allergène de l’année » en 2002. Cependant, la même année, Belsito a publié un article déclarant le thimérosal « non allergène de l’année », en raison du manque de pertinence clinique de ces réactions et a recommandé son exclusion de la batterie de test cutané américaine. Un groupe de Santa Casa de Belo Horizonte a constaté que 14,7% des 1 406 patients testés entre 2003 et 2010 présentaient un thimérosal positif. Néanmoins, le rapport n’a pas discuté de la pertinence clinique des réactions. Herbst, et coll. allergies confirmées au thimérosal chez un groupe de patients atteints de dermatite périorbitaire chez 10.2% des patients, mais sans commentaire sur la pertinence. Landeck, et coll. a effectué une analyse rétrospective des données du patch du patient testé en Allemagne, en Autriche et en Suisse (réseau IVDK) entre janvier 2001 et décembre 2010 et a constaté que la fréquence de sensibilisation par contact au thimérosal était de 5,8%. Wijnmaalen, et coll. a effectué une étude rétrospective chez 90 patients suspectés d’allergie aux médicaments ophtalmiques, et ils ont détecté une allergie de contact au thimérosal chez 7% des patients. La fréquence de sensibilisation par contact au thimérosal dans une cohorte de 4 055 patients atteints d’eczéma chronique testés entre les années 2001 et 2016 dans notre département s’est avérée aussi élevée que 9,89%. Dans cette étude, nous avons constaté que la fréquence de sensibilisation par contact au thimérosal chez les patients atteints de dermatite périorbitaire était de 9,7%, mais avec une pertinence clinique très faible (un seul patient sur 182). L’utilisation de préparations oculaires contenant du thimérosal peut également entraîner une conjonctivite, qui peut survenir simultanément à l’eczéma des paupières, ainsi qu’une infiltration cornéenne, une kératite ponctuée épithéliale et des pseudodendrites cornéennes. Bien que le thimérosal soit présent dans les vaccins contre l’hépatite, le tétanos et la méningo-encéphalite, les effets indésirables significatifs de ces substances sont rares. Seuls 10% des patients sensibles au thimérosal signalent des effets indésirables à ces vaccins. Cependant, ces réactions sont généralement légères à modérées et se limitent souvent à une augmentation de la douleur autour du site d’injection.
La néomycine est un antibactérien largement utilisé dans les crèmes topiques, les onguents, les lotions, les préparations pour les yeux et les gouttes pour les oreilles. On le trouve également couramment dans des préparations combinées avec d’autres antibactériens et corticostéroïdes. Ces préparations sur ordonnance et en vente libre sont utilisées pour traiter une variété de troubles de la peau, des yeux et de l’oreille externe infectés et enflammés. Il est également utilisé comme conservateur dans certains vaccins. La dermatite de contact allergique à la néomycine a été décrite pour la première fois en 1952. Prystowsky, et coll. a déterminé la fréquence de l’allergie à la néomycine dans la population générale à 1,1%. Dans 10 centres européens, les taux de sensibilisation variaient de 1,1 à 3,8%. Le groupe américain de dermatite de contact a révélé une sensibilisation allant jusqu’à 11,6%. La néomycine est donc le cinquième allergène le plus courant en Amérique du Nord, en grande partie parce que cet antibiotique est largement disponible dans diverses préparations en vente libre aux États-Unis. Il peut y avoir une sensibilité croisée avec d’autres antibactériens du groupe aminoglycoside qui sont chimiquement liés, y compris la framycétine, la gentamicine, la kanamycine, la streptomycine, la tobramycine, la spectinomycine, la paromomycine. En République tchèque, la fréquence générale de sensibilisation au sulfate de néomycine était de 1,2% en 2014 et de 1,7% en 2016 chez les patients testés par patch (données de la section dermatoallergologique de la Société tchèque de dermatovénérologie). Herbst, et coll. allergie mise en évidence au sulfate de néomycine dans un groupe de patients atteints de dermatite périorbitaire à 3,8%. Landeck, et coll. a effectué une analyse rétrospective des données du patch du patient testé en Allemagne, en Autriche et en Suisse (réseau IVDK) entre janvier 2001 et décembre 2010 et a déterminé que la fréquence de sensibilisation par contact à la néomycine était de 5,9%. Wijnmaalen, et coll. a mené une étude rétrospective de 90 patients suspectés d’allergie aux médicaments ophtalmiques, et ils ont détecté une allergie de contact au sulfate de néomycine chez 8% des patients. Dans notre étude, nous avons trouvé une fréquence de sensibilisation par contact très similaire à celle du sulfate de néomycine (2.6%) avec une pertinence clinique assez significative (20 patients sur 48).
Le chlorure de benzalkonium appartient aux bases quart ammonium. Il est utilisé comme conservateur de cosmétiques et largement également dans l’industrie pharmaceutique, par exemple pour la conservation des gouttes pour les yeux et des onguents ainsi que dans des solutions de conservation des lentilles de contact. Dans les gouttes oculaires, la concentration varie de 0,004 à 0,025%. En tant qu’agent microbicide, le chlorure de benzalkonium est hautement toxique en fonction du temps et de la dose. Mais la sensibilisation par contact est censée être relativement rare, par exemple Goosens rapporte qu’elle est égale à 0.02%, mais parmi les patients sélectionnés (ayant une dermatite périorbitaire), la fréquence semble être plus élevée – Wijnmaalen, et al. a détecté une allergie de contact au chlorure de benzalkonium chez 4% des patients, et Herbst, et al. trouvé une allergie à ce conservateur chez 1,9% des patients. Landeck, et coll. a effectué une analyse rétrospective des données du patch du patient testé en Allemagne, en Autriche et en Suisse (réseau IVDK) entre janvier 2001 et décembre 2010 et a confirmé une fréquence de sensibilisation par contact au chlorure de benzalkonium de 1,6%. La fréquence de sensibilisation par contact au chlorure de benzalkonium a été déterminée à 1,2% dans une cohorte de 2 400 patients atteints d’eczéma chronique testés entre les années 2001 et 2009 dans notre département et à 1,85% chez 4 055 patients avec le même diagnostic testés de 2001 à 2016 également dans notre département. Toujours parmi les patients de notre étude atteints de dermatite périorbitaire, la fréquence de sensibilisation par contact a dépassé 1% (1,32%) avec une pertinence clinique de 3 patients sur 25.
Les parabènes sont des dérivés de l’acide p-hydroxy-benzoïque. Les ester de méthyle, d’éthyle, de propyle, de butyle, d’isobutyle et d’isopropyle sont utilisés à la fois pour la conservation de produits dermatologiques et cosmétiques. La sensibilisation en République tchèque a diminué ces dernières années, la fréquence réelle de sensibilisation étant de 0,8% en 2016 (données de la section dermatoallergologique de la Société tchèque de dermatovénérologie). Le potentiel de sensibilisation des parabènes est relativement faible, lorsqu’on envisage une application à long terme. En 1999-2000 dans 11 pays européens, la fréquence de sensibilisation était de 0,5%, en 2004-2005 en Grande-Bretagne chez 6 958 patients; la sensibilisation était de 0,8%. Chez nos patients atteints de dermatite périorbitaire, la sensibilisation était de 0,6%, mais sans pertinence clinique (aucun des patients n’avait utilisé de produit ophtalmique contenant des parabènes).
Conclusion
L’étude a montré que la sensibilisation aux excipients des préparations topiques ophtalmologiques chez les patients atteints de dermatite périorbitaire est assez significative. L’allergène le plus fréquemment détecté était le thimérosal, bien que présentant une pertinence clinique très faible, suivi du sulfate de néomycine (à l’inverse présentant une pertinence clinique nettement significative), du chlorure de benzalkonium (pertinence clinique relativement faible) et des parabènes (aucune pertinence clinique). En conséquence, en ce qui concerne la pertinence clinique, l’allergène le plus important dans les produits ophtalmiques est la néomycine, suivie du chlorure de benzalkonium.
Des tests de patch doivent être envisagés dans tous les cas de dermatite périorbitaire, et pas seulement avec les allergènes d’essai commerciaux, mais également avec les préparations ophtalmiques réelles du patient.
Contributions de l’auteur
Nečas et Dastychová ont effectué des tests de patch, Nečas a calculé la fréquence de sensibilisation et a écrit cet article, Dastychová a examiné et vérifié l’article.
Déclaration d’intérêts concurrents
Les auteurs affirment qu’il n’y a pas d’intérêts concurrents.
Remerciements
Une assistance technique a été fournie par l’infirmière Pospíšilová et le technicien de laboratoire Licková pour la préparation des allergènes et l’application de tests patch.
- Herbst RA, Maibach HI (1997) Dermatite de contact allergique ophtalmique: mise à jour 1997. Dermatite de contact 37:252-253.
- Rietschel R, Fowler JF (2008) Dermatite de contact de Fisher. (6e éd.), Hamilton, C.-B. Deckerinc, Canada.
- van’t Veen AJ, van Joost T (1994) La sensibilisation au thimérosal (merthiolate) est toujours présente aujourd’hui. Dermatite de contact 31:293-298.
- Rodrigues DF, Neves DR, Pinto JM, Alves MF, Fulgêncio AC (2012) Résultats des tests de patch de la clinique de dermatologie de santa casa de belo horizonte, belo horizonte, brésil, de 2003 à 2010. Un Bras Dermatol 87:800-803.
- Moriearty P, Pereira C, Guimarães NA (1978) dermatite de contact à salvador, Brésil. Dermatite de contact 4: 185-189.
- Belsito DV (2002) Thimérosal: contact (non) allergène de l’année. Contact Dermat 13:1-2.
- Herbst RA, Uter W, Pirker C, Geier J, Frosch PJ (2004) Dermatite périorbitaire allergique et non allergique: résultats des tests de patch du réseau d’information des Départements de dermatologie sur une période de 5 ans. Dermatite de contact 51:13-19.
- Landeck L, John SM, Geier J (2014) Agents ophtalmiques topiques en tant qu’allergènes dans la dermatite périorbitaire. Br J Ophthalmol 98:259-262.
- Wijnmaalen AL, van Zuuren EJ, de Keizer RJ, Jager MJ (2009) Tests d’allergie cutanée chez des patients suspectés d’une réaction allergique aux médicaments pour les yeux. Ophtalmique Res 41:225-229.
- Möller H (1994) Tous ces tests positifs au thimérosal. Dermatite de contact 31:209-213.
- Stingeni L, Lapomarda V, Lisi P (1996) Quel risque de photodermatite au piroxicam chez les patients positifs au thimérosal? Dermatite de contact 34:60-61.
- Breithaupt A, Jacob SE (2008) Thimerosal and the relevance of patch-test reactions in children. Dermatitis 19: 275-277.
- Sasseville D (2010) Neomycin. Dermatitis 21: 3-7.
- Baer R, Ludwig JS (1952) Allergic eczematous sensitization to neomycin. Ann Allergy 10: 136-137.
- Prystowsky SD, Nonomura JH, Smith RW, Allen AM (1979) Allergic hypersensitivity to neomycin. Relationship between patch test reactions and ‘use’ tests. Arch Dermatol 115:713-715.
- Uter W, Rämsch C, Aberer W, Ayala F, Balato A, et al. (2009) La série de référence européenne dans 10 Pays européens, 2005/2006results résultats du Système Européen de Surveillance des Allergies de Contact (ESSCA). Dermatite de contact 61:31-38.
- Zug KA, Warshaw EM, Fowler JF Jr, Maibach HI, Belsito DL, et al. (2009) Résultats Du Patch-Test Du Groupe Nord-Américain De Dermatite De Contact 2005-2006. Dermatite 20:149-160.
- Baudouin C, Labbé A, Liang H, Pauly A, Brignole-Baudouin F (2010) Conservateurs en collyre : le bon, le mauvais et le laid. Prog Retin Eye Res 29:312-334.
- Goossens A, Claes L, Drieghe J, Put E (1997) Antimicrobiens: conservateurs, antiseptiques et désinfectants. Dermatite de contact 39:133-134.
- Pecquet C, Bayrou O, Leynadier F (2002) Prévalence de tests correctifs positifs avec des conservateurs. Dermatite de contact 58:73.
- Dastychová E, Necas M (2010) Kontaktní precitlivelost na pomocné látky prípravku kosmetických a farmaceutických u ekzematiku. Ces-Slov Derm 85:78-90.
- Wilkinson JD, Shaw S, Andersen KE, Brandao FM, Bruynzeel DP, et al. (2002) Monitoring levels of preservative sensitivity in Europe. Un aperçu décennal (1991-2000). Dermatite de contact 46:207-210.
- Jong CT, Statham BN, Green CM, King CM, Gawkrodger DJ, et al. (2007) Sensibilité de contact aux conservateurs au Royaume-Uni, 2004-2005: résultats d’une étude multicentrique. Dermatite de contact 57:165-168.