Los aceites biológicos son diferentes de los aceites de petróleo (combustible diésel»regular») en estructura molecular y propiedades.

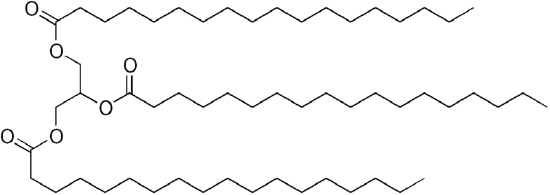
El combustible diesel de petróleo común es una mezcla de hidrocarburos simples, con la fórmula química promedio C12H23 (que se muestra a continuación), pero los componentes pueden variar aproximadamente de C10H20 (dodecano) a C15H28(pentadecano). Por el contrario, los aceites biológicos son «triglicéridos» (clasificados como «ésteres») como el trilinoleato de glicerilo que se muestra a continuación:
| C12H23, dodecano | A triglicérido: trilinoleato de glicerilo |
Debido a su gran tamaño y las consiguientes grandes atracciones intermoleculares, la viscosidad de los aceites biológicos es generalmente demasiado alta para su uso en motores diesel convencionales. Los aceites biológicos también se queman un poco menos fácilmente, y con una llama más hollín que el diesel de petróleo. Los aceites biológicos se pueden usar en motores diesel convencionales si se precalientan para reducir su viscosidad, pero esto requiere un calentador eléctrico auxiliar hasta que el motor se caliente. Para estos resones, los aceites bilógicos requieren procesamiento para su uso como biodiesel.
Un aceite biológico es un éster, que es un tipo de compuesto orgánico que tiene el enlace atómico que se muestra a continuación.
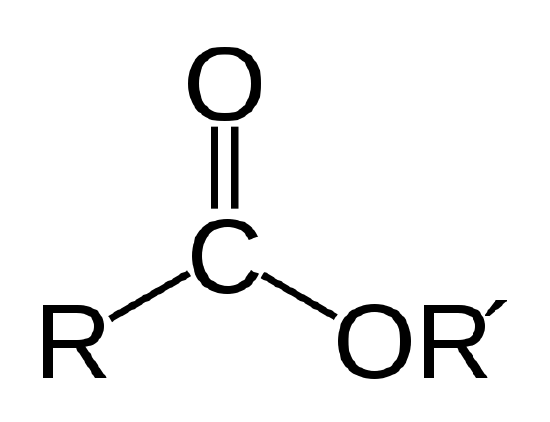 El éster de vinculación. R y R’ representan cadenas de átomos de carbono e hidrógeno. R = CH3 y R’ = -C18H35O2 para el estearato de metilo en el Ejemplo 1 |
glicerol |
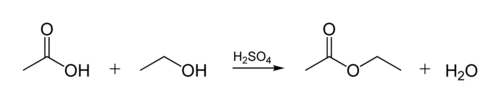
El éster de vinculación biológica de los aceites se crea cuando una molécula de glicerol reacciona con ácidos orgánicos. La molécula de glicerol tiene una cadena de 3 átomos de carbono, cada uno con un grupo-OH (alcohol). La siguiente figura muestra cómo reacciona un alcohol orgánico con un ácido orgánico. Los químicos orgánicos abrevian las estructuras moleculares the las líneas de » zig-zag «en la figura representan cadenas de carbono con un átomo C en cada» zig «o»zag». Cada carbono tiene 4 enlaces, y si se muestran menos de 4, se asume que van a átomos H. Por lo tanto, el alcohol es C2H5OH (etanol), y el ácido es ácido acético (o ácido etanoico, CH3COOH) en la figura:
Dado que el glicerol tiene grupos de 3-OH, 3 «ácidos grasos» orgánicos de cadena larga se unen para hacer el voluminoso «triglicérido».
Pero tan fácilmente como los ésteres pueden ser hechas a partir de alcoholes y ácidos, que pueden cambiar de alcoholes o ácidos. En presencia de un catalizador de base fuerte, como el NaOH, un triglicérido puede reaccionar con 3 pequeñas moléculas de alcohol, como el metanol (CH3OH), que reemplazan la «columna vertebral» de glicerol, formando 3 ésteres separados de menor peso molecular
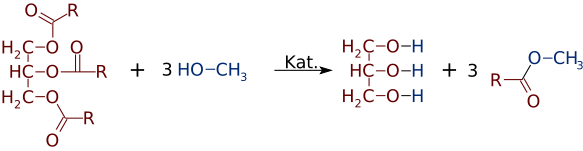
Muy a menudo se forma una mezcla de dos o más productos. Por ejemplo, cuando un aceite vegetal reacciona con metanol, solo uno o dos de los ácidos pueden ser desplazados de la glicerina, produciendo solo 1 o 2 FAMEs.
C3H5(C18H35O2)3 + NaOH + 2 CH3OH → C3H5(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH → C3H5(C18H35O2)(OH)2 + 1 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3
Por lo general, se agrega un gran exceso de metanol e hidróxido de sodio, de modo que la reacción produce la máxima cantidad de FAMA.
Pero en el caso de una transesterificación, a pesar de que ninguno de los reactivos se consume completamente, no se produce un aumento adicional en las cantidades de los productos. Decimos que tal reacción no se completa. Cuando se produce una mezcla de productos o una reacción no se completa, la eficacia de la reacción generalmente se evalúa en términos de porcentaje de rendimiento del producto deseado. El rendimiento teórico se calcula suponiendo que todo el reactivo limitador se convierte en producto. La masa de producto determinada experimentalmente se compara con el rendimiento teórico y se expresa como porcentaje:

EJEMPLO 1 Cuando 100,0 g de gas C3H5(C18H35O2)3 y 15,0 g de CH3OH se mezclan a 55°C con catalizador NaOH, reaccionan para formar 90,96 g de biodiésel de estearato de metilo C17H35COOCH3. Calcule el porcentaje de rendimiento.
Solución Debemos calcular el rendimiento teórico de NH3, y para ello, primero debemos descubrir si N2 o H2 es el reactivo limitante. Para la ecuación equilibrada
C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3 estearina + hidróxido de sodio + 3 CH3OH → glicerol + 3 estearato de metilo
La relación estequiométrica de los reactivos es
 Ahora, las cantidades iniciales de los dos reactivos son y
Ahora, las cantidades iniciales de los dos reactivos son y La relación de cantidades iniciales es, por lo tanto,
La relación de cantidades iniciales es, por lo tanto, Dado que esta relación es menor que
Dado que esta relación es menor que , hay un exceso de CH3OH. La estearina es el reactivo limitante. En consecuencia, debemos usar 0,1122 mol de estearina y 0,3366 mol de CH3OH (en lugar de 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, hay un exceso de CH3OH. La estearina es el reactivo limitante. En consecuencia, debemos usar 0,1122 mol de estearina y 0,3366 mol de CH3OH (en lugar de 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.