
Sau (Larry) Lee, Ph.D., Director Adjunto de la Oficina de Pruebas e Investigación y Presidente del Equipo de Tecnología Emergente, Oficina de Calidad Farmacéutica, CDER
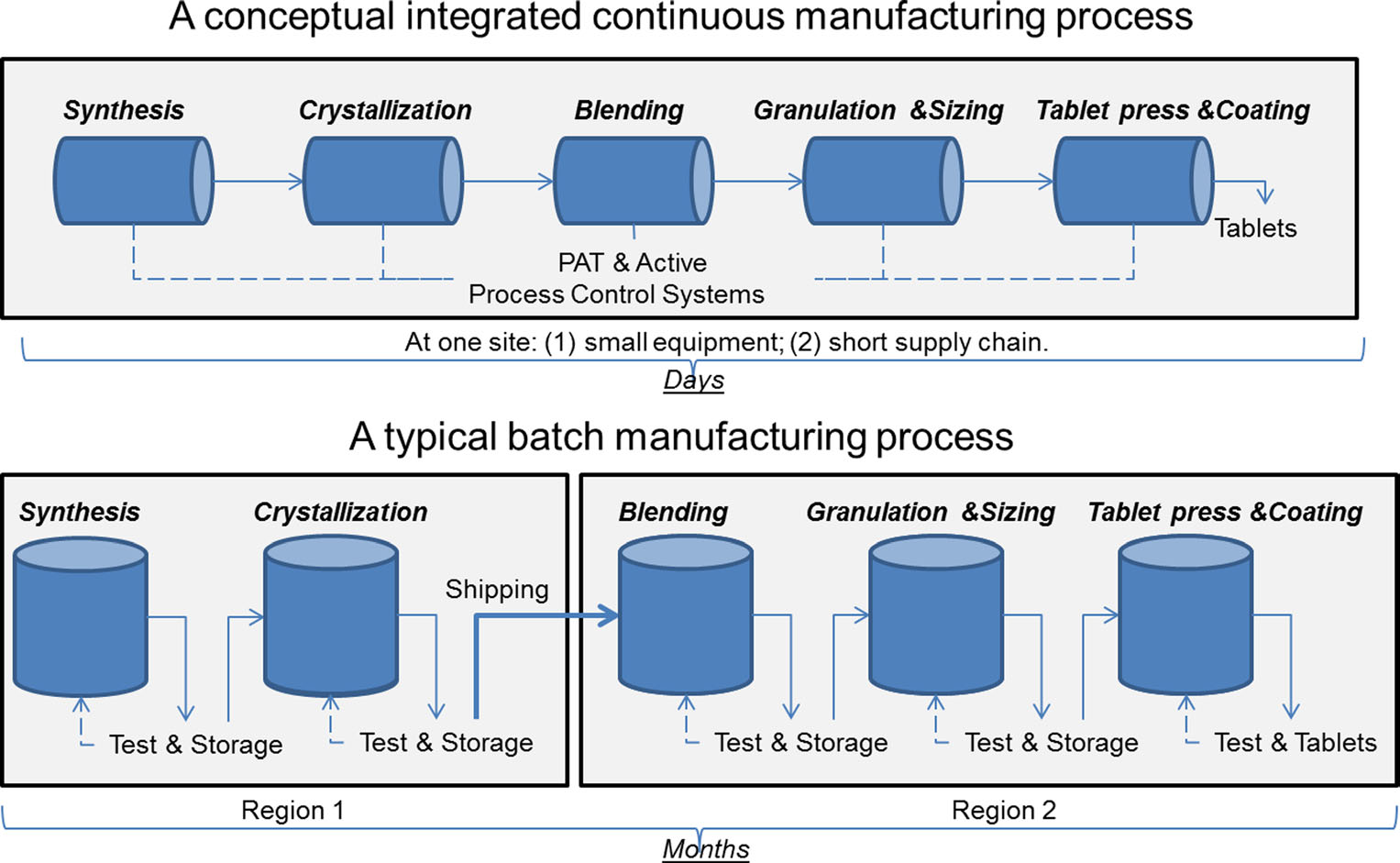 Una comparación de fabricación continua y fabricación por lotes. Imagen cortesía de Sau Lee. J. Pharm Innov (2015) 10: 191-199.
Una comparación de fabricación continua y fabricación por lotes. Imagen cortesía de Sau Lee. J. Pharm Innov (2015) 10: 191-199.Durante más de 50 años, los productos farmacéuticos se han producido utilizando un método conocido como «fabricación por lotes», un proceso largo y de varios pasos que implica el uso de equipos desgarbados a gran escala. Sin embargo, los recientes avances en la tecnología de fabricación han llevado a la industria farmacéutica a considerar la posibilidad de pasar de la fabricación por lotes a un proceso más rápido y eficiente conocido como fabricación continua. La FDA está tomando medidas proactivas para facilitar la implementación de tecnologías emergentes por parte de la industria farmacéutica, incluida la fabricación continua, para mejorar la calidad de los productos y abordar muchas de las causas subyacentes de la escasez y el retiro de medicamentos.
Fabricación por lotes vs. fabricación continua
La fabricación por lotes implica múltiples pasos discretos. Después de cada paso en el proceso, la producción normalmente se detiene para que las muestras se puedan probar fuera de línea para determinar la calidad. A veces, durante estos «tiempos de espera» entre pasos, el material puede almacenarse en contenedores o enviarse a otras instalaciones de todo el mundo para completar el proceso de fabricación. Esto puede agregar semanas o meses al tiempo de procesamiento. Para algunos ingredientes activos que son sensibles al medio ambiente, también puede introducir el riesgo de degradación. Además, si la demanda de ciertos aumentos repentinos de drogas, el aumento de la producción puede requerir equipos más grandes. Esta ampliación de los equipos requiere más espacio físico, un espacio más grande y más tiempo y dinero.
Por el contrario, los productos farmacéuticos que se fabrican con fabricación continua se mueven sin parar dentro de la misma instalación, lo que elimina los tiempos de espera entre pasos. El material se alimenta a través de una línea de montaje de componentes totalmente integrados. Este método ahorra tiempo, reduce la probabilidad de errores humanos y puede responder con mayor agilidad a los cambios del mercado. Para tener en cuenta la mayor demanda, la fabricación continua puede durar un período de tiempo más largo, lo que puede reducir la probabilidad de escasez de medicamentos.
Ambos tipos de fabricación están sujetos a los mismos estándares de control de calidad, pero el monitoreo se automatiza en las instalaciones de fabricación continua y tiende a ser más frecuente que en la fabricación por lotes. Al igual que toda la tecnología, los equipos de fabricación continua pueden experimentar desgaste, pero el monitoreo automatizado puede detectar problemas mucho antes de que ocurra un fallo. Este monitoreo también puede ayudar a predecir la esperanza de vida de un equipo, lo que lleva a un mejor mantenimiento proactivo.
Finalmente, la fabricación continua puede permitir un seguimiento y rastreo más flexibles, lo que sería una ventaja en caso de falla del producto. Por ejemplo, en la fabricación por lotes, una cantidad específica (o lote) de un medicamento se define por el tamaño del equipo que lo produjo. En la fabricación continua, una cantidad (o lote) se puede delimitar mediante una marca de tiempo, la cantidad de medicamento producido o la cantidad de materia prima de entrada. Estos métodos de seguimiento permiten al fabricante aislar una menor cantidad de material defectuoso en caso de fallo del proceso, lo que genera menos residuos y menos posibilidades de escasez.
Una transición desafiante pero valiosa
Varias industrias, como la química y la petroquímica, ya han experimentado una evolución en la fabricación y utilizan tecnologías continuas eficientes para fabricar productos de forma segura. Pero para la industria farmacéutica, la transición a la fabricación continua se encuentra todavía en sus primeras etapas por varias razones. En primer lugar, los costos iniciales de esa transición pueden ser elevados. Retirar equipos de lotes antiguos, comprar nueva tecnología y capacitar al personal sobre cómo usarlos, y renovar la infraestructura de la industria es costoso, lo que requiere un compromiso serio por parte de un fabricante de medicamentos. Sin embargo, los análisis económicos han mostrado ahorros potenciales significativos a largo plazo. Además, algunas tecnologías aún deben madurar antes de ser comercialmente viables. Para ciertos tipos de medicamentos, como los productos biológicos, la tecnología para producirlos por fabricación continua puede no existir todavía. Se están realizando investigaciones para abordar estos y otros desafíos. Además, los fabricantes de medicamentos siguen percibiendo incertidumbre regulatoria que puede retrasar la aprobación del producto cuando se utiliza una nueva tecnología de fabricación.
Mientras la industria considera cómo hacer el cambio, la FDA está proporcionando recursos e información para ayudar a facilitar la transición. Por ejemplo, la agencia se ha asociado con la Autoridad de Investigación y Desarrollo Biomédicos Avanzados, un programa dentro del Departamento de Salud y Servicios Humanos de los Estados Unidos, para ayudar a financiar y apoyar la investigación en esta área. También estamos capacitando a nuestro personal de revisión y realizando investigaciones internas sobre áreas de riesgo asociadas con la fabricación continua, para que podamos evaluar mejor las tecnologías relacionadas.
Dirijo un equipo multidisciplinario bajo el Programa de Tecnología Emergente en la Oficina de Calidad Farmacéutica de CDER. El programa se estableció para ayudar a la industria a implementar tecnologías innovadoras para mejorar la calidad de los productos y modernizar la industria, en un esfuerzo por abordar las causas subyacentes de la escasez de medicamentos o retiros del mercado. El Programa de Tecnología Emergente aborda no solo las tecnologías de fabricación continua, sino también otros avances como la impresión 3D, formas farmacéuticas novedosas y sistemas de contenedores novedosos. En el marco de este programa, colaboramos con la industria en las primeras etapas del proceso de desarrollo de nuevas tecnologías y analizamos cualquier cuestión reglamentaria o científica prevista que pueda formar parte de una aplicación futura.
Muchas empresas han aplicado al Programa de Tecnología Emergente en relación con su interés en la fabricación continua. El documento de la FDA titulado Avance de las Aplicaciones de Tecnología Emergente para Modernizar la Guía de Base de Fabricación Farmacéutica para la Industria proporciona información y asesoramiento sobre cómo trabajar con la agencia al principio del proceso de desarrollo.
Lea más sobre los esfuerzos de la FDA para modernizar la fabricación de medicamentos en el Blog de Voz de la FDA.