Tiene como objetivo
1) determinar la frecuencia real de sensibilización a los alérgenos de contacto más comunes presentes en los productos oftalmológicos. 2) Evaluar la relevancia clínica de los resultados y detectar fuentes de sensibilización.
Métodos
Un total de 1.881 pacientes (edad media 46,5 años, 357 hombres, 1.524 mujeres) con dermatitis periorbitaria se sometieron a pruebas de parche entre los años 2001 y 2016 y se incluyeron de forma retrospectiva en nuestro estudio.
Resultados
Conclusión
Los alérgenos más importantes en productos oftalmológicos en nuestro estudio fueron sulfato de neomicina seguido de cloruro de benzalconio.
En todos los casos de dermatitis periorbitaria se deben considerar las pruebas de parche, no solo con alérgenos de prueba comerciales, sino también con las preparaciones oftalmológicas reales del paciente.
Palabras clave
Dermatitis periorbital, Pruebas de parches, alérgenos de contacto
Introducción
La dermatitis periorbital es un problema bastante común en dermatología y también en oftalmología. Puede ser de origen alérgico o no alérgico. Las enfermedades no alérgicas incluyen dermatitis de contacto irritante, dermatitis atópica (Figura 1) y dermatitis seborreica. La dermatitis alérgica de contacto periorbital puede ser causada por productos cosméticos, esmaltes de uñas, tintes para el cabello, ciertos alérgenos de contacto en el aire (plantas, epóxido y otras resinas) o por preparaciones oftalmológicas . El aspecto clínico de la dermatitis alérgica de contacto en la región periorbital incluye enrojecimiento, a menudo con hinchazón de los párpados (Figura 2), en fase aguda a veces con exudación formando costras, en fase subaguda y crónica con menos enrojecimiento e hinchazón de las protuberancias, pero con descamación más prominente. La diferenciación de la dermatitis alérgica de la no alérgica, así como la identificación de la causa de la alergia, deben realizarse mediante las llamadas pruebas de parche. La identificación de medicamentos oftalmológicos como la causa de la dermatitis periorbitaria puede ser a veces muy difícil, ya que los pacientes con frecuencia alternan el uso de muchos productos oftalmológicos diferentes. Además, no hay una serie estandarizada de pruebas de parches oftálmicos y no hay compuestos puros para pruebas de parches . Entre los años 2001 y 2016 hemos realizado un estudio retrospectivo entre pacientes con dermatitis periorbitaria que se sometieron a pruebas de parche en la clínica de Dermatovenereología del St. Hospital de la Facultad de Anne en Brno, República Checa, con el objetivo de determinar la frecuencia real de sensibilización a los alérgenos de contacto más comunes que están presentes en los productos oftalmológicos.
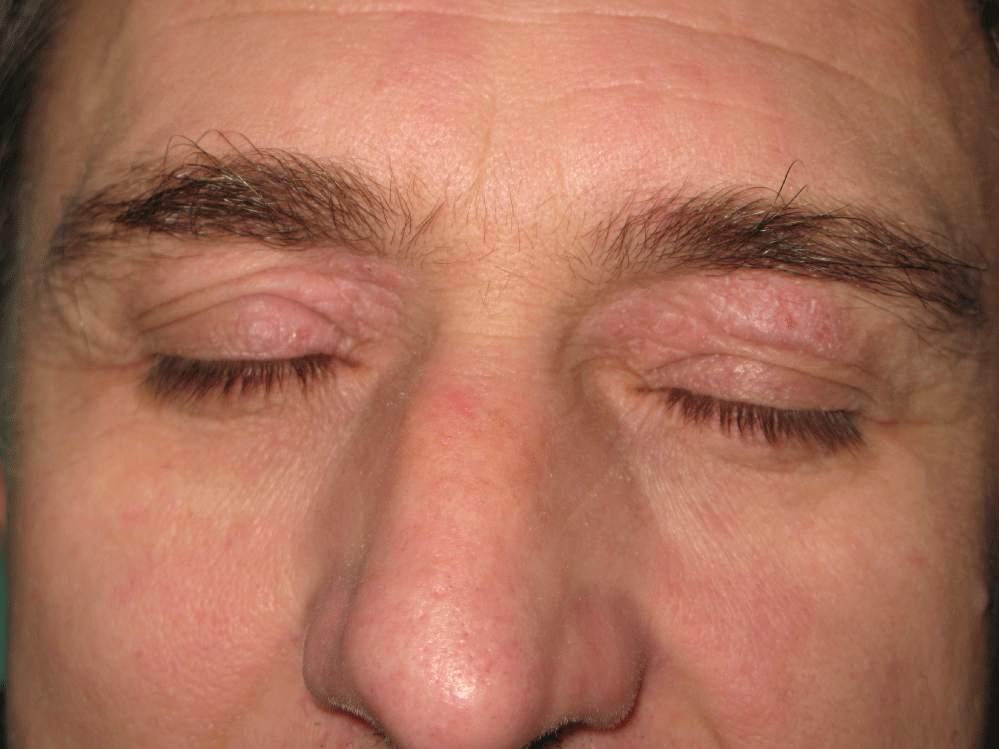 Figura 1: Dermatitis atópica en la región periorbital. Ver Figura 1
Figura 1: Dermatitis atópica en la región periorbital. Ver Figura 1
 Figura 2: Dermatitis alérgica de contacto periorbital aguda con hinchazón prominente de los párpados. Ver Figura 2
Figura 2: Dermatitis alérgica de contacto periorbital aguda con hinchazón prominente de los párpados. Ver Figura 2
Material y métodos
Entre los años 2001 y 2016 1881 pacientes (edad media 46 años.5 años) con dermatitis periorbitaria fueron incluidos en nuestro estudio. De ellos, 357 eran hombres (edad media 43,9 años) y 1.524 eran mujeres (edad media 47,0 años). Todos los pacientes se sometieron a pruebas de parche y se registraron los datos clínicos y anamnésicos antes de la prueba. Una prueba de parche (epicutánea) es un método de diagnóstico que se utiliza para identificar la causa de la dermatitis alérgica de contacto (un tipo de alergia retardada). El principio de las pruebas de parche es exponer un área pequeña de la piel (generalmente en la espalda) al alérgeno sospechoso en una cantidad, concentración y vehículo estandarizados. El parche puede ser un pequeño trozo de parche de filtro, una cámara de plástico, una cámara de aluminio o incluso un gel previamente impregnado con un alérgeno (las llamadas pruebas VERDADERAS). El alérgeno se coloca en el parche y luego se coloca en la piel de la parte superior de la espalda del paciente, donde los parches se mantienen en su lugar con tiras de cinta adhesiva, y permanecen inalterados generalmente durante 48 horas (Figura 3). Luego se retiran los parches y, en caso de alergia, se observa una reacción eczematosa (pápulas, papulovesículas) en el área examinada. La gravedad de la reacción está marcada por signos+. La evaluación se realiza al día siguiente (72 horas desde la aplicación), al día siguiente (después de 96 horas) y, en algunos casos (por ejemplo, pruebas de corticosteroides), incluso una semana después de la aplicación. Esta lectura repetida es necesaria, porque en casos de verdadera alergia, la reacción aumenta durante días consecutivos, mientras que en caso de reacción irritante (no alérgica), generalmente disminuye (la reacción más fuerte que ocurre el día en que se eliminan las pruebas, momento en el que la reacción comienza a desaparecer). La metodología de pruebas de parches ha sido estandarizada por el Grupo Internacional de Investigación de Dermatitis de Contacto (ICDRG) y seguimos estrictamente estas reglas al realizar pruebas de parches a nuestros pacientes. Con nuestras pruebas de parches, hemos utilizado alérgenos de contacto de Chemotechnique Company y Lohmann & Tiras Curatest Rauscher. Las pruebas de parche están contraindicadas en casos de dermatitis aguda, o cuando hay alguna erupción en el área de prueba, y cuando la piel del área de prueba está fuertemente bronceada. Las sustancias tóxicas o venenosas o las sustancias con un pH extremadamente alto o bajo no deben someterse a pruebas de parche. Las pruebas son problemáticas en pacientes que reciben tratamiento inmunosupresor simultáneo (pueden causar resultados falsos negativos dependiendo de la dosis de inmunosupresores). La llamada serie de referencia europea (Tabla 1) de alérgenos de contacto se probó en todos nuestros pacientes junto con alérgenos de contacto sospechosos adicionales, dependiendo de los antecedentes de los pacientes. Retrospectivamente, se evaluó la frecuencia de sensibilización a los alérgenos de contacto más comunes que están presentes en los productos oftálmicos (timerosal, cloruro de benzalconio, neomicina y mezcla de parabenos).
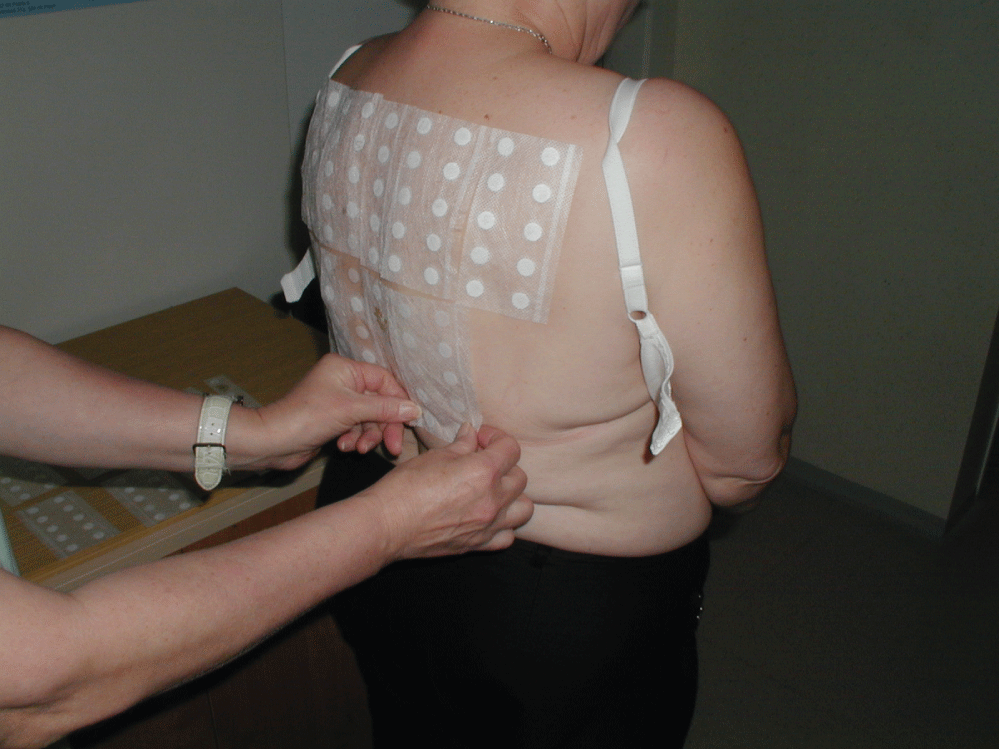 Figura 3: Aplicación de pruebas de parche. Ver Figura 3
Figura 3: Aplicación de pruebas de parche. Ver Figura 3
Tabla 1: Series basales europeas. Ver Tabla 1
Resultados
La frecuencia de sensibilización por contacto a alérgenos seleccionados, que están presentes en productos oftalmológicos, se muestra en la Tabla 2. La mayor frecuencia de sensibilización se encontró con el timerosal (9,7% de los pacientes), pero entre estos pacientes solo 1 caso de alergia fue causado por el uso de un producto oftalmológico con timerosal. La segunda frecuencia más alta se registró con sulfato de neomicina (2.6%), donde 22 pacientes sensibilizados habían utilizado previamente un producto oftalmológico que contenía sulfato de neomicina. La tercera sensibilización alérgica más alta se produjo a partir del cloruro de benzalconio (1,3%), y entre los pacientes alérgicos al cloruro de benzalconio, 3 pacientes habían estado utilizando previamente productos oftálmicos que contenían el alérgeno (Figura 4). La menos frecuente fue la sensibilización a los parabenos (0,6%), en la que ninguno de los pacientes había utilizado ningún producto oftalmológico que contuviera parabenos (Figura 5 y Figura 6).
Tabla 2: Frecuencia de sensibilización a los alérgenos seleccionados utilizados en productos oftalmológicos. View Table 2
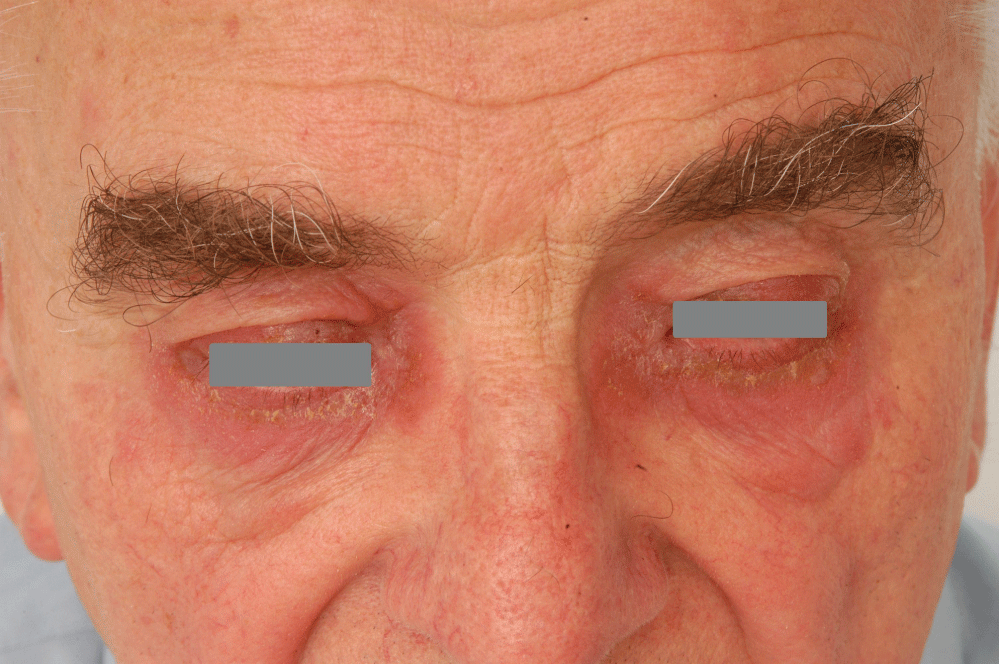 Figure 4: Allergic contact dermatitis to benzalkonium chloride. View Figure 4
Figure 4: Allergic contact dermatitis to benzalkonium chloride. View Figure 4
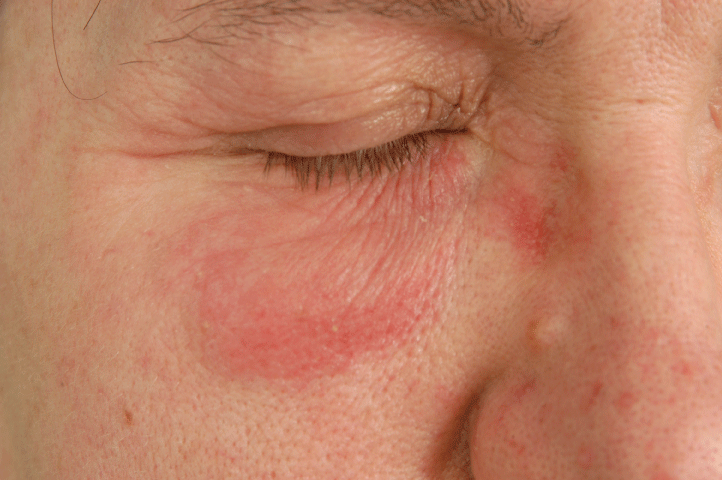 Figure 5: Allergic contact dermatitis to parabens. View Figure 5
Figure 5: Allergic contact dermatitis to parabens. View Figure 5
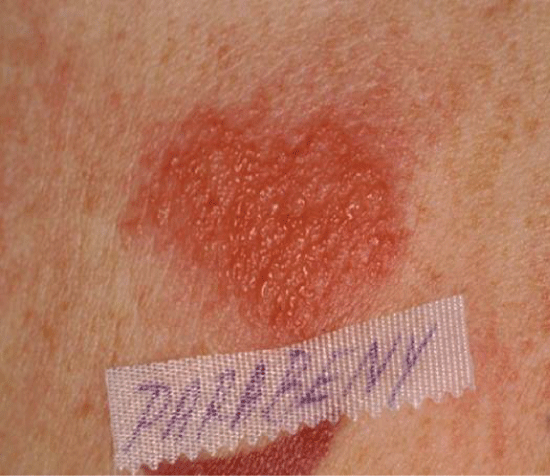 Figure 6: Positive patch test to parabens. Ver la Figura 6
Figure 6: Positive patch test to parabens. Ver la Figura 6
Discusión
El timerosal (Mertiolato o Tiomersalato) o el salicilato de etilmercurio sódico es un compuesto orgánico de mercurio que se utiliza como conservante y desinfectante en lentes de contacto y soluciones para ojos, vacunas y tintas para tatuajes. El timerosal se compone de dos radicales: un mercurio orgánico y un tiosalicilato. Aunque ambos componentes pueden causar reacciones alérgicas, la proporción de etilmercurio en el timerosal generalmente actúa como determinante alérgico . La hipersensibilidad al timerosal no significa necesariamente una alergia al mercurio . Los informes de reacciones cruzadas entre el timerosal y otros componentes del mercurio son poco frecuentes . En cuanto a la incidencia de alergias al timerosal, existe una variabilidad geográfica significativa. En los EE.UU., la incidencia de alergias al timerosal es de hasta el 15%, mientras que las tasas correspondientes en Suecia y Dinamarca son de entre el 3 y el 4% . Estas diferencias se deben a variaciones en la disponibilidad y el uso de productos que contienen timerosal en cada país. La relevancia clínica de las reacciones de timerosal es a menudo controvertida. Un estudio realizado por el Grupo de Dermatitis de Contacto de América del Norte (NACDG) encontró que la prevalencia y la relevancia clínica de las reacciones de timerosal varían de 10,9% a 16,8%, en los 4.087 individuos evaluados . La alta prevalencia de reacciones de timerosal en la población dio lugar a que la American Contact Dermatitis Society identificara la sustancia como «alergeno del año» en 2002. Sin embargo, en el mismo año, Belsito publicó un artículo declarando al timerosal como el «no alérgeno del año», debido a la falta de relevancia clínica de tales reacciones y recomendó su exclusión de la batería de pruebas cutáneas estadounidenses . Un grupo de Santa Casa de Belo Horizonte encontró que el 14,7% de los 1.406 pacientes examinados entre 2003 y 2010 tenían timerosal positivo. Sin embargo, el informe no discutió la relevancia clínica de las reacciones . Herbst, et al. alergias confirmadas al timerosal en un grupo de pacientes con dermatitis periorbital en 10.2% de los pacientes, sin comentarios sobre la relevancia . Landeck, et al. se realizó un análisis retrospectivo de los datos del parche de paciente probado en Alemania, Austria y Suiza (Red IVDK) entre enero de 2001 y diciembre de 2010 y se encontró que la frecuencia de sensibilización por contacto con timerosal era del 5,8% . Wijnmaalen, et al. se realizó un estudio retrospectivo en 90 pacientes con sospecha de alergia a medicamentos oftálmicos y se detectó una alergia de contacto al timerosal en el 7% de los pacientes . La frecuencia de sensibilización de contacto al timerosal en una cohorte de 4.055 pacientes con eccema crónico analizada entre los años 2001 y 2016 en nuestro departamento fue de hasta 9,89%. En este estudio, encontramos que la frecuencia de sensibilización de contacto al timerosal en pacientes con dermatitis periorbitaria es del 9,7%, pero con muy baja relevancia clínica (solo un paciente de 182). El uso de preparaciones oculares que contienen timerosal también puede conducir a conjuntivitis, que puede ocurrir simultáneamente con eccema de párpados, así como infiltración corneal, queratitis punctata epitelial y seudodendritas corneales . Aunque el timerosal está presente en las vacunas contra la hepatitis, el tétanos y la meningoencefalitis, las reacciones adversas significativas a estas sustancias son raras. Solo el 10% de los pacientes sensibles al timerosal notifican reacciones adversas a estas vacunas. Sin embargo, estas reacciones suelen ser de leves a moderadas y a menudo se limitan a un aumento del dolor alrededor del lugar de inyección .
La neomicina es un antibacteriano que se usa ampliamente en cremas tópicas, ungüentos, lociones, preparaciones para los ojos y gotas para los oídos . También se encuentra comúnmente en preparaciones combinadas con otros antibacterianos y corticosteroides. Estas preparaciones con y sin receta médica se utilizan para tratar una variedad de trastornos de la piel, los ojos y el oído externo que se han infectado e inflamado. También se utiliza como conservante en algunas vacunas. La dermatitis alérgica de contacto por neomicina se describió por primera vez en 1952 . Prystowsky, et al. se determinó que la frecuencia de alergia a la neomicina en la población general era del 1,1% . En 10 centros europeos, las tasas de sensibilización variaron de 1,1 do 3,8% . El Grupo Americano de Dermatitis de Contacto reveló sensibilización de hasta el 11,6%. Por lo tanto, la neomicina es el quinto alérgeno más común en América del Norte, en gran parte porque este antibiótico está ampliamente disponible en varias preparaciones de venta libre en los Estados Unidos. Puede haber una sensibilidad cruzada con otros antibacterianos del grupo aminoglicósido que están químicamente relacionados, incluyendo framicetina, gentamicina, kanamicina, estreptomicina, tobramicina, espectinomicina, paromomicina . En la República Checa, la frecuencia general de sensibilización al sulfato de neomicina fue del 1,2% en 2014 y del 1,7% en 2016 entre los pacientes sometidos a pruebas con parches (datos de la sección dermatoalergológica de la Sociedad Dermatovenerológica Checa). Herbst, et al. evidencia de alergia al sulfato de neomicina en un grupo de pacientes con dermatitis periorbitaria en el 3,8%. Landeck, et al. se realizó un análisis retrospectivo de los datos de los parches de pacientes probados en Alemania, Austria y Suiza (Red IVDK) entre enero de 2001 y diciembre de 2010 y se determinó que la frecuencia de sensibilización por contacto a la neomicina era del 5,9% . Wijnmaalen, et al. se realizó un estudio retrospectivo de 90 pacientes con sospecha de alergia a medicamentos oftálmicos y se detectó una alergia de contacto al sulfato de neomicina en el 8% de los pacientes . En nuestro estudio, hemos encontrado una frecuencia de sensibilización de contacto muy similar a la del sulfato de neomicina (2.6%) con relevancia clínica bastante significativa (20 de 48 pacientes).
El cloruro de benzalconio pertenece a un cuarto de base de amonio. Se utiliza como conservante de cosméticos y ampliamente también en la industria farmacéutica, por ejemplo, para la conservación de gotas para los ojos y ungüentos, así como en soluciones para conservar lentes de contacto. En colirio, la concentración varía de 0,004 a 0,025% . Como agente microbicida, el cloruro de benzalconio es altamente tóxico de forma dependiente del tiempo y de la dosis . Pero se supone que la sensibilización por contacto es relativamente rara, por ejemplo, Goosens informa que es 0.02%, pero entre los pacientes seleccionados (con dermatitis periorbitaria) la frecuencia parece ser mayor-Wijnmaalen, et al. se detectó una alergia de contacto al cloruro de benzalconio en el 4% de los pacientes , y Herbst, et al. encontró alergia a este conservante en el 1,9% de los pacientes . Landeck, et al. se realizó un análisis retrospectivo de los datos del parche de paciente probado en Alemania, Austria y Suiza (Red IVDK) entre enero de 2001 y diciembre de 2010 y se afirmó que la frecuencia de sensibilización por contacto al cloruro de benzalconio era del 1,6% . Se determinó que la frecuencia de sensibilización por contacto al cloruro de benzalconio fue del 1,2% en una cohorte de 2.400 pacientes con eccema crónico analizada entre los años 2001 y 2009 en nuestro departamento y del 1,85% entre 4.055 pacientes con el mismo diagnóstico analizada entre 2001 y 2016 también en nuestro departamento. También entre los pacientes de nuestro estudio con dermatitis periorbitaria, la frecuencia de sensibilización por contacto superó el 1% (1,32%) con una relevancia clínica de 3 de cada 25 pacientes.
Los parabenos son derivados del ácido p-hidroxi-benzoico. El éster metil, etil, propil, butil, isobutil e isopropílico se utiliza tanto para la conservación de productos dermatológicos como cosméticos. La sensibilización en la República Checa ha disminuido en los últimos años, con una frecuencia real de sensibilización del 0,8% en 2016 (datos de la sección dermatoalergológica de la Sociedad Dermatovenerológica Checa). El potencial de sensibilización de los parabenos es relativamente bajo, cuando se considera la aplicación a largo plazo. Durante 1999-2000 en 11 países europeos, la frecuencia de sensibilización fue del 0,5%, durante 2004-2005 en Gran Bretaña entre 6.958 pacientes; la sensibilización fue del 0,8%. Entre nuestros pacientes con dermatitis periorbitaria, la sensibilización fue del 0,6%, sin embargo, sin relevancia clínica (ninguno de los pacientes había utilizado ningún producto oftalmológico que contuviera parabenos).
Conclusión
El estudio ha demostrado que la sensibilización a los excipientes de preparaciones tópicas oftalmológicas entre pacientes con dermatitis periorbitaria es bastante significativa. El alérgeno detectado con más frecuencia fue el timerosal, aunque con una relevancia clínica muy baja, seguido del sulfato de neomicina (a la inversa, con relevancia clínica marcadamente significativa), el cloruro de benzalconio (relevancia clínica relativamente baja) y los parabenos (sin relevancia clínica). En consecuencia, con respecto a la relevancia clínica, el alérgeno más importante en los productos oftálmicos es la neomicina, seguida del cloruro de benzalconio.
Se debe considerar la prueba de parches en todos los casos de dermatitis periorbital, y no solo con alérgenos de prueba comerciales, sino también con preparaciones oftálmicas reales del paciente.
Contribuciones de los autores
Nečas y Dastychová realizaron pruebas de parche, Nečas calculó la frecuencia de sensibilización y escribió este artículo, Dastychová revisó y verificó el artículo.
Declaración de conflictos de interés
Los autores declaran que no existen conflictos de intereses.
Reconocimientos
La asistencia técnica fue proporcionada por la Enfermera Pospíšilová y el Técnico de Laboratorio Licková con la preparación de alérgenos y la aplicación de pruebas de parche.
- Herbst RA, Maibach HI (1997) Dermatitis alérgica de contacto de oftalmología: actualización de 1997. Dermatitis de contacto 37: 252-253.
- Rietschel R, Fowler JF (2008) Dermatitis de contacto de Fisher. (6th edn), Hamilton, Bc Deckerinc, Canadá.
- van’T Veen AJ, van Joost T (1994) Sensitization to thimerosal (merthiolate) is still present today. Contact Dermatitis 31: 293-298.
- Rodrigues DF, Neves DR, Pinto JM, Alves MF, Fulgencio AC (2012) Results of patchtestsfrom Santa casa de belo horizonte dermatology clinic, belo horizonte, brazil, from 2003 to 2010. An Bras Dermatol 87: 800-803.
- Moriearty P, Pereira C, Guimaraes NA (1978) Contact dermatitis in salvador, Brazil. Contact Dermatitis 4: 185-189.
- Belsito DV (2002) Timerosal: contacto (no)alergeno del año. Am J Contacto Dermat 13: 1-2.
- Herbst RA, Uter W, Pirker C, Geier J, Frosch PJ (2004) Dermatitis periorbital alérgica y no alérgica: resultados de pruebas de parches de la red de información de los Departamentos de Dermatología durante un período de 5 años. Dermatitis de contacto 51: 13-19.
- Landeck L, John SM, Geier J (2014) Agentes oftálmicos tópicos como alérgenos en dermatitis periorbitaria. Br J Ophthalmol 98: 259-262.
- Wijnmaalen AL, van Zuuren EJ, de Keizer RJ, Jager MJ (2009) Pruebas de alergia cutánea en pacientes con sospecha de reacción alérgica a medicamentos para los ojos. Ophthalmic Res 41: 225-229.
- Möller H (1994) Todas estas pruebas positivas a timerosal. Dermatitis de contacto 31: 209-213.
- Stingeni L, Lapomarda V, Lisi P (1996) ¿Qué riesgo de fotodermatitis por piroxicam en pacientes con timerosal positivo? Dermatitis de contacto 34: 60-61.
- Breithaupt A, Jacob SE (2008) Thimerosal and the relevance of patch-test reactions in children. Dermatitis 19: 275-277.
- Sasseville D (2010) Neomycin. Dermatitis 21: 3-7.
- Baer R, Ludwig JS (1952) Allergic eczematous sensitization to neomycin. Ann Allergy 10: 136-137.
- Prystowsky SD, Nonomura JH, Smith RW, Allen AM (1979) Allergic hypersensitivity to neomycin. Relationship between patch test reactions and ‘use’ tests. Arch Dermatol 115: 713-715.
- Uter W, Rämsch C, Aberer W, Ayala F, Balato A, et al. (2009) The European baseline series in 10 European Countries, 2005/2006 results results of the European Surveillance System on Contact Allergies (ESSCA). Dermatitis de contacto 61: 31-38.
- Zug KA, Warshaw EM, Fowler JF Jr, Maibach HI, Belsito DL, et al. (2009) Patch-Test Results Of The North American Contact Dermatitis Group 2005-2006. Dermatitis 20: 149-160.
- Baudouin C, Labbé A, Liang H, Pauly A, Brignole-Baudouin F (2010) Conservantes en gotas para los ojos: lo bueno, lo malo y lo feo. Prog Retin Eye Res 29: 312-334.
- Goossens A, Claes L, Drieghe J, Put E (1997) Antimicrobianos: conservantes, antisépticos y desinfectantes. Dermatitis de contacto 39: 133-134.
- Pecquet C, Bayrou O, Leynadier F (2002) Prevalencia de pruebas de parche positivas con conservantes. Dermatitis de contacto 58: 73.
- Dastychová E, Necas M (2010) Kontaktní precitlivelost na pomocné látky prípravku kosmetických a farmaceutických u ekzematiku. Ces-Slov Derm 85: 78-90.
- Wilkinson JD, Shaw S, Andersen KE, Brandao FM, Bruynzeel DP, et al. (2002) Monitoring levels of preservative sensitivity in Europe. A 10-year overview (1991-2000). Dermatitis de contacto 46: 207-210.
- Jong CT, Statham BN, Green CM, King CM, Gawkrodger DJ, et al. (2007) Contact sensitivity to conservants in the uk, 2004-2005: results of multicentre study. Dermatitis de contacto 57: 165-168.