- Introducción
- Materiales y métodos
- Análisis instrumental
- Los cultivos microbianos
- Preparación de medios
- La fermentación del Enantato de Drostanolona (1) con C. aphidicola ATCC 28300 y F. lini NRRL 2204
- 2α-Metil-3α, 14α, 17β-trihidroxi-5α-androstano (2)
- 2α-Metil-7-hidroxi-5 alfa-androstan-3,17-diona (3)
- 2α-Metil-3alfa,17β-dihidroxi-5 alfa-androstano (4)
- 2-Methylandrosta-1,4-diene-3,17-dione (5)
- 2-Methylandrosta-11α-hydroxy-1,4-diene-3,17-dione (6)
- 2-Methylandrosta-14α-hydroxy-1,4-diene-3,17-dione (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- Resultados y discusión
- Elucidación de la estructura
- Citotoxicidad contra el cáncer HeLa, PC3, H640 y HCT116, y Líneas Celulares Normales 3T3
- la Relación Estructura-Actividad
- Conclusión
- Contribuciones de los autores
- Declaración de Conflicto de Intereses
- Agradecimientos
- Supplementary Material
Introducción
La transformación microbiana es uno de los enfoques más importantes para la transformación estructural de varias clases de compuestos orgánicos. Esta técnica se ha empleado con éxito en la química verde, i. e. los programas de descubrimiento y desarrollo de fármacos, que proporcionan una excelente fuente de compuestos alrededor de las estructuras centrales, seguidos de exámenes de detección de diversas actividades biológicas. En varios casos, la transformación microbiana se ha utilizado como una herramienta importante para las conversiones regio-, quimio-y estereo selectivas de compuestos orgánicos que son difíciles de lograr por métodos convencionales (Holland y Weber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmanska et al., 2005; Borges et al., 2009; Choudhary et al., 2011; Ravindran et al., 2012). Debido a la naturaleza inactiva del esqueleto de hidrocarburo de los esteroides, a menudo son difíciles de derivar por métodos sintéticos convencionales. Por lo tanto, la transformación microbiana se usa a menudo para la alteración estructural de los esteroides. La presencia de sistemas enzimáticos citocromos P450 en hongos, hace que la biocatálisis de células enteras sea una herramienta eficiente para la hidroxilación estereoscópica y regio-específica (Choudhary et al., 2005a; Tong y Dong, 2009; Kristan y RiŽner, 2012; Baydoun et al., 2014).
Drostanolona y sus derivados de ésteres, como el propionato de drostanolona, el pentanoato de drostanolona y el enantato de drostanolona (1), son esteroides anabolizantes androgénicos (AASs) utilizados por los atletas para fortalecer sus músculos sin ganar grasa. Además, la drostanolona y sus derivados de ésteres tienen la capacidad de inhibir la producción de estrógeno. El éster de propionato de drostanolona también se utiliza para el tratamiento del cáncer de mama, bajo el nombre comercial de Masteron (Chowdhury et al., 1976; Clavel et al., 1982; Marinov et al., 1986; Vardar et al., 2002; Bahrke y Yesalis, 2004).
El cáncer se reconoce actualmente como un desafío importante para la salud pública. Los cánceres son la segunda causa principal de muerte en los Estados Unidos y en todo el mundo. Según la Organización Mundial de la Salud (OMS), la prevalencia del cáncer supera los 6 millones de casos al año. Las células cancerosas tienen una alta tasa de proliferación. Se propagan rápidamente en el sistema vivo, y pueden sobrevivir contra quimioterapéuticos fuertes y agentes dañinos para el ADN. De manera similar, los fármacos citotóxicos tienen muchos efectos adversos sobre las células normales, por lo que su uso en la quimioterapia contra el cáncer es un desafío terapéutico. Debido a esto, se necesita con urgencia el desarrollo de agentes quimioterapéuticos seguros, eficaces y selectivos contra diversos tipos de cáncer (Muñoz-Pinedo et al., 2012; Su et al., 2015; Swadogo et al., 2015; Rebecca et al., 2016).
El cáncer de mama es uno de los cánceres más comunes en 140 países del mundo. Es una causa importante de muerte relacionada con el cáncer en mujeres de todo el mundo, caracterizada por el crecimiento anormal de células en los lóbulos o conductos de la mama con una alta tasa de proliferación (Hanahan y Weinberg, 2000; Ferlay et al., 2015).
El cáncer de cuello uterino es el segundo cáncer más predominante en mujeres de todo el mundo, después del cáncer de mama. La causa principal del cáncer de cuello uterino es la formación de células malignas en los tejidos del cuello uterino (Wang et al., 2013; Hafiza y Latifah, 2014; Pariente et al., 2016). La línea celular de cáncer HeLa, obtenida de células humanas de cáncer de cuello uterino, es un modelo celular común para evaluar el potencial citotóxico de los compuestos de prueba.
El cáncer de próstata es el segundo cáncer más importante en hombres en todo el mundo después del cáncer de bronquios, y la tercera causa más común de muerte por cáncer. Es la razón más común de malignidad en los hombres. Su incidencia aumenta con la edad, siendo más común a partir de los 50 años (Henry y Omahony, 1999; De-Bono et al., 2010; Wenbin et al., 2015). La línea de células cancerosas PC-3, obtenida de células cancerosas de próstata masculinas, es un modelo ampliamente utilizado para investigar la toxicidad de los compuestos de prueba.
El cáncer de pulmón es un cáncer altamente prevalente entre los hombres en los Estados Unidos desde mediados de la década de 1950 y entre las mujeres, desde finales de la década de 1980. El cáncer de pulmón se atribuye principalmente al tabaquismo (Travis et al., 2002; Villanti et al., 2013; Mishra et al., 2016). La línea de células cancerosas H460, obtenida de células de cáncer de pulmón humano (sublina metastásica linfógena del carcinoma de pulmón de células grandes humano), a menudo se usa para evaluar la citotoxicidad de los compuestos de prueba.
Después de los cánceres de mama, pulmón y próstata, el cáncer de colon es el cuarto cáncer más prevalente en todo el mundo. Es el cáncer que se encuentra con una frecuencia aproximadamente igual en hombres y mujeres. Es la segunda causa más común de muertes relacionadas con el cáncer en los países occidentales (Levin et al., 2008; Andre et al., 2009; Ahearn et al., 2012). La línea de células cancerosas HCT116, obtenida de células de cáncer de colon humano, se usa comúnmente para evaluar la citotoxicidad de los compuestos de prueba.
En continuación de nuestros estudios sobre la transformación fúngica de esteroides bioactivos (Choudhary et al., 2005b, c, 2007, 2010; Ahmad et al., 2014; Siddiqui et al., 2017), sintetizamos análogos del enantato de drostanolona (1) a través de su transformación con Cephalosporium aphidicola y Fusarium lini. Los metabolitos 2-9, así como el sustrato 1, se evaluaron frente a líneas celulares HeLa (carcinoma de cuello uterino), PC-3 (carcinoma de próstata), H460 (cáncer de pulmón), HCT116 (cáncer de colon) y 3T3 (fibroblastos de ratón normales), utilizando el ensayo basado en células de alto rendimiento, el método de laboratorio más eficiente y conveniente, el ensayo MTT para predecir la respuesta de los compuestos de prueba en neoplasias malignas en las que mostraron especificidad frente a las células cancerosas. Por lo tanto, este estudio ha identificado metabolitos anticancerígenos del enantato de drostanolona (1) para estudios posteriores.
Materiales y métodos
Análisis instrumental
Para el análisis del grado de transformación y pureza se utilizó cromatografía de capa fina (TLC) (gel de sílice, 20 × 20, 0,25 mm de espesor, PF254, Merck, Alemania). Se utilizó cromatografía en columna de gel de sílice (malla 70-230, E. Merck, Alemania) para la purificación inicial de metabolitos. Además, para la purificación final de los metabolitos se utilizó el reciclado de fase inversa preparativo (JAI LC-908W, Japón), equipado con YMC L-80 (4-5 µm, 20-50 mm de diámetro interior). Las estructuras de los metabolitos se dilucidaron con la ayuda de espectros de 1H (400, 500 y 600 MHz) y 13C – RMN (100, 125 y 150 MHz), que se registraron en espectrómetros Bruker Avance-RMN (Francia) en CD3OD, CD3COCD3 o DMSO-d6. Los espectros HREI-MS e IR se realizaron en el espectrómetro de masas JEOL JMS-600H (Japón) (analizador de masa de sector magnético de doble enfoque) (EI, ionización de impacto de electrones) y en el espectrofotómetro Bruker Vector 22 FT-IR, respectivamente. Se registraron rotaciones ópticas de metabolitos en el polarímetro JASCO P-2000 (Japón). Se utilizó el espectrofotómetro visible UV Evolution 300 para registrar los espectros UV. Los puntos de fusión de los productos transformados se midieron utilizando el instrumento Buchi M – 560 (Suiza). Se recogieron datos de difracción de rayos X monocristalinos en el difractómetro Venture Bruker APEXII D8, equipado con detector de FOTÓN 100 (tecnología CMOS) y tubo sellado de enfoque fino con fuente de rayos X (radiaciones Cu Ka α = 1,54178 Å). Las intensidades de reflexión se integraron utilizando el software SAINT. La corrección de absorción se realizó en Multi-escaneo, y la estructura se resolvió mediante el programa SHELXTL (Gerlier y Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
Los cultivos microbianos
de C. aphidicola ATCC 28300 y F. lini NRRL 2204 se obtuvieron de la Colección de Cultivos de Tipo Americano (ATCC) y los Laboratorios de Investigación Regionales del Norte (NRRL), respectivamente. Los cultivos se cultivaron en agar de dextrosa Sabouraud (SDA) inclinado, y se mantuvieron a 4°C.
Preparación de medios
Cuatro litros de medios para el crecimiento de C. aphidicola ATCC-28300 se preparó mezclando 200 g de glucosa, 4 g de KH2PO4, 8 g de glicina, 4 g de KCl, 8 g de MgSO4.7H2O y 8 ml de oligoelementos en 4 L de agua destilada. De manera similar, se prepararon cuatro litros de medios para F. lini NRRL 2204 mezclando 40 g de glucosa, 20 g de extracto de levadura, 20 g de peptona, 20 g de KH2PO4, 20 g de NaCl y 40 ml de glicerol en 4 L de agua destilada.
La fermentación del Enantato de Drostanolona (1) con C. aphidicola ATCC 28300 y F. lini NRRL 2204
Medio para el crecimiento de C. aphidicola y F. lini se preparó mezclando los ingredientes mencionados anteriormente en 4 L de agua destilada para cada hongo, que luego se dispensó por igual en 40 matraces Erlenmeyer de 250 mL (100 mL en cada matraz). Todos estos matraces se esterilizaron en autoclave a 121°C y se inocularon con sesgos SDA de C. aphidicola ATCC 28300 y F. lini NRRL 2204 en condiciones esterilizadas. Estos frascos con cultivo de hongos se dejaron en el agitador rotativo (121 rpm) a 26 ± 2°C durante 3-4 días para obtener el máximo crecimiento de C. aphidicola y F. lini. El compuesto 1 (1 g) se disolvió en 20 ml de acetona para cada hongo, se dispensaron 0,5 ml en cada matraz y se colocaron de nuevo en un agitador giratorio durante 12 días. También se prepararon de forma análoga un control negativo (medio + cultivo fúngico), así como un control positivo (medio + sustrato) para evaluar los metabolitos fúngicos y la degradación del compuesto 1, respectivamente. Después de la incubación de 12 días, todos los matraces se filtraron y extrajeron con 20 L de diclorometano (DCM), se separó la fase orgánica y luego se evaporó a presión reducida en el evaporador rotativo. Esto produjo 1,5 g de crudo sólido amarillento pálido. Este material crudo se fraccionó sobre cromatografía en columna de gel de sílice mediante elución con hexanos gradientes y sistemas de solventes de acetona. La cromatografía en columna produjo cuatro fracciones principales (1-4), que luego se purificaron reciclando HPLC. Se purificaron los metabolitos 2 (tR = 16 min, 8 mg, 0,8%), 3 (tR = 19 min, 11 mg, 1,1%), 4 (tR = 17 min, 35 mg, 3,5%), 5 (tR = 23 min, 42 mg, 4,2%), 6 (tR = 20 min, 9 mg, 0,9%), 7 (tR = 21 min, 12 mg, 1,2%) y 9 (tR = 18 min, 5 mg, 0,5%) a partir de fracciones 1-7, respectivamente, a través de HPLC de reciclaje de fase inversa utilizando metanol – agua como sistema solvente (MeOH: H2O; 70: 30). Considerando que, el metabolito 8 se obtuvo de la fracción 8 a través de la HPLC de reciclaje de fase normal (tR = 32 min, CHCl3: MeOH; 95: 5, 7.5 mg, 0,75%).
2α-Metil-3α, 14α, 17β-trihidroxi-5α-androstano (2)
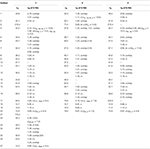
Tabla 1. Datos de desplazamiento químico de 13C y 1H-RMN (J y W1/2 en Hz) de compuestos 1-3 (δ ppm).
2α-Metil-7-hidroxi-5 alfa-androstan-3,17-diona (3)
2α-Metil-3alfa,17β-dihidroxi-5 alfa-androstano (4)
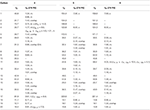
la Tabla 2. Datos de desplazamiento químico de 13C y 1H-RMN (J y W1 / 2 en Hz) de compuestos 4-6 (δ ppm).
2-Methylandrosta-1,4-diene-3,17-dione (5)
2-Methylandrosta-11α-hydroxy-1,4-diene-3,17-dione (6)
2-Methylandrosta-14α-hydroxy-1,4-diene-3,17-dione (7)
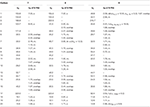
Table 3. 13C- and 1H-NMR chemical shift data (J and W1/2 in Hz) of compounds 7–9 (δ ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Las líneas celulares se cultivaron en medios DMEM F12, complementados con 10% de FBS bajo una atmósfera de 5% de CO2 a 37°C en una incubadora.
Se utilizó el ensayo colorimétrico MTT para la evaluación de la actividad metabólica celular. En este ensayo, el MTT amarillo se reduce a formazón púrpura en las mitocondrias de las células vivas (Gerlier y Thomasset, 1986). Cuantas más células vivas, más color y, por lo tanto, más absorbancia se observa por el colorímetro (Fesahat et al., 2015). Hemos utilizado este método para analizar el efecto de nuestros productos transformados en la citotoxicidad celular contra las células cancerosas. Alrededor de 10.000 células de cada línea celular (HeLa, PC3, H460, HCT116 cánceres y 3T3 normal) se sembraron en placas de 96 pocillos. Después de alcanzar un 80-90% de confluencia, se trataron con varias concentraciones de compuestos (25, 50, 75, 100 y 200 µM) durante 24 h. Todos los compuestos se disolvieron en DMSO estéril para hacer una solución madre de 200 mm. La solución se filtró y se realizaron diluciones en serie en medio de crecimiento. Se utilizaron 600 µL de cada dilución para tratar 3 pocillos (triplicado de cada uno) de placa de 96 pocillos, es decir, 200 µL cada uno. Cada experimento se realizó en tres réplicas biológicas. Se añadió MTT y se incubó durante 4 h. Después de la extracción de MTT, los cristales de formazón púrpura se disolvieron en DMSO, y se observó lectura a 540 y 570 nm para las células normales y cancerosas, respectivamente. El lector Multiskan da λmáx a 540 nm en células de fibroblastos 3T3 tratados con DMSO (que son más confluentes en morfología), mientras que en el caso de las células cancerosas, 570 nm da λmáx (Bonmati-Carrion et al., 2013; Danihelová et al., 2013). En este experimento se utilizó una amplia gama de líneas celulares de carcinoma epitelial, en las que el cisplatino era un fármaco de elección común. Se dirige al ADN, interfiere con la división celular durante la mitosis e induce la apoptosis (Eastman, 1999). Los valores de CI50 se calcularon para determinar la concentración mínima requerida para matar el 50% de las células.
Mientras que,
At = Valor de absorbancia del compuesto de prueba
Ab = Valor de absorbancia del blanco
Ac = valor de Absorbancia del control
Resultados y discusión
Elucidación de la estructura
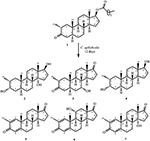
Figura 1. Biotransformación de enantato de drostanolona (1) con Cephalosporium aphidicola.
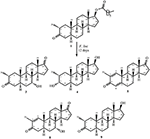
la Figura 2. Biotransformación de enantato de drostanolona (1) con Fusarium lini.
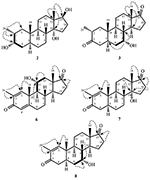
Metabolito 2 fue aislado como cristales blancos. La fórmula molecular C20H30O3 se basó en HREI-MS que mostró el at m / z 322.2517 (calcd. 322.2508, C20H34O3), sugiriendo la adición de tres átomos de hidrógeno y oxígeno, la reducción del carbonilo cetónico C-3 y la escisión hidrolítica de la cadena lateral de heptanoato en el sustrato 1. La absorbancia IR de 3.531 y 3.423 cm-1 se debió a la presencia de grupos hidroxilo. El espectro de 1H-RMN mostró una señal de protones metina adicional a δ 3,69 (Tabla 1) (hoja de datos 2). Las señales para la cadena lateral de heptanoato también se encontraron faltantes en el espectro de 1H-RMN del compuesto 2. El espectro de RMN de 13C mostró señales para un nuevo carbono metino en δ 71,4, y un nuevo carbono cuaternario en δ 84,8. Las señales de carbono para la cadena de heptanoato y el carbonilo cetónico también se encontraron ausentes en el espectro de RMN 13C. Esto sugirió una reducción del carbonilo C-3, pérdida hidrolítica de la cadena de heptanoato y adición de un OH en C-14 (Tabla 1). El grupo OH se colocó en C-3 sobre la base de las correlaciones de HMBC de H3-20 (δ 0,91, d) con C-3 (δ 71,4) (Figura 3). Esto se debió a la reducción del carbonilo C-3. El segundo grupo de OH se colocó en C-14, basado en la correlación de HMBC de H3-18 (δ 0,81, s) con C-14 (δ 84,8). El tercer OH estaba en C-17, resultado de la pérdida hidrolítica de la fracción de heptanoato. El grupo O-H en C-3 se dedujo orientado a α basado en las correlaciones NOESY de H-3 (δ 3.69, br. s) con H-2 orientado a β (δ 1,64, solapamiento) y H3-20 orientado a α (δ 0,91, d) (Figura 4). El OH-14 se dedujo orientado a α, basado en correlaciones NOESY de H-9 (δ 1,32, m) con OH-14 (δ 2,66, s) (acetona-d6). El análisis de difracción de rayos X monocristalino apoyó aún más la estructura del metabolito 2, compuesto por tres anillos en conformación de silla (A, B y C), y uno en conformación envolvente (D). Se asignaron tres grupos de OH con orientación α, α y β en C-3, C-14 y C-17 (Figura 5). Los datos de difracción monocristal del metabolito 2 se presentaron a la Colección de Datos Cristalográficos de Cambridge (CCDC 1500706). La estructura del metabolito 2 fue así deducida como 2α-metil-3α,14α, 17β-trihidroxi-5α-androstano.
la Figura 3. Correlaciones clave de HMBC (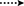 ) y COSY (
) y COSY ( ) en nuevos metabolitos.
) en nuevos metabolitos.
la Figura 4. Correlaciones clave NOESY en nuevos metabolitos.
Metabolito 3 se obtuvo como un sólido blanco. El HREI-MS mostró el at m / z 318.2192 (calcd. 318.2195, C20H30O3). Esto representó la pérdida de la cadena lateral de heptanoato y la adición de un átomo de oxígeno en el sustrato 1. El espectro IR mostró absorbancias para OH (3.436 cm-1) y carbonilos cetónicos (1.711 cm−1). En el espectro de 1H-RMN, se encontraron señales de cadena de heptanoato y protones metínicos C-17 faltantes, mientras que se observó una nueva señal de protones metínicos en el campo descendente a δ 3,92 (Tabla 1) (hoja de datos 3). Esto sugería la hidroxilación del esqueleto esteroidal y la escisión oxidativa de la fracción de heptanoato. El espectro de RMN de 13C también soportaba las inferencias anteriores. Faltaron señales de carbono para la fracción de heptanoato, mientras que aparecieron nuevas señales de carbonilo cetónico y oxi-metina en el espectro de RMN 13C (Tabla 1). Esto indicó la escisión oxidativa de la cadena de heptanoato y la hidroxilación en el sustrato 1. El protón metínico recién aparecido en δ 3,92 (H-7) mostró correlaciones de HMBC con C-5 y C-8, lo que sugiere un OH en C-7 (Figura 3). Las correlaciones de HMBC de H3-18 y H2-16 con un carbono en δ 223,8 sugirieron un carbono cetónico en C-17. OH en C-7 fue apoyado además por correlaciones acogedoras de H-7 con H2-6 y H-8. H-7 (δ 3,92, s) mostró correlaciones NOESY con H-8 orientado axialmente (δ 1,70, solapamiento), lo que sugirió una orientación α de OH en C-7 (Figura 4). Por lo tanto, la estructura del metabolito 3 se dedujo como 2α-metil-7α-hidroxi-5α-androstan-3,17-diona.
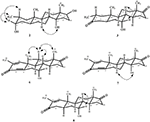
También se realizaron análisis de difracción de rayos X monocristalinos en los compuestos 1 y 5. El compuesto 1 estaba compuesto por cuatro anillos, es decir, A, B, C y D, con conformaciones de silla, silla, silla y envoltura. Un metilo estaba presente en el C-2 con orientación ecuatorial. La cadena éster de heptanoato estaba presente en el C-17 del anillo D (Figura 6). Considerando que el metabolito 5 contiene anillos A, B, C y D en conformaciones de cepilladora, silla, silla y envoltura. La cadena lateral de heptanoato estaba ausente en el metabolito 5 (Figura 7). Los datos de difracción monocristal de los metabolitos 1 y 5 se presentaron a la Recopilación de Datos Cristalográficos de Cambridge (CCDC 1500705 y CCDC 1500707, respectivamente). Los datos de análisis de difracción de rayos X monocristalinos de los compuestos 1, 2 y 5 se presentan en el Cuadro 4.
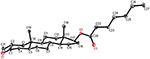
la Figura 6. Dibujo ORTEP generado por computadora del modelo final de rayos X del compuesto 1. Códigos de color: carbono, negro; oxígeno, rojo.
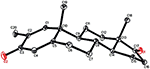
la Figura 7. Dibujo ORTEP generado por computadora del modelo final de rayos X del compuesto 5. Códigos de color: carbono, negro; oxígeno, rojo.

la Tabla 4. Análisis de difracción de rayos X de un solo cristal de los compuestos 1, 2 y 5.
Citotoxicidad contra el cáncer HeLa, PC3, H640 y HCT116, y Líneas Celulares Normales 3T3
Productos naturales, por ejemplo, flavonoides, esteroides, terpenos, etc. puede servir como una excelente fuente para la producción de muchos medicamentos, ya que se reportan para muchas actividades biológicas, como actividades anticancerígenas, antiinflamatorias, anti-leishmaniales, antibacterianas, etc. Por lo tanto, es necesario derivarlos, estudiar la relación estructura-actividad que podría ser útil para la síntesis de fármacos seguros y eficaces. En la actualidad, muchos productos farmacéuticos se sintetizan de manera eficiente a través de la biotransformación microbiana debido a la presencia de una gama de enzimas en ellos. Sobre la base de la actividad anticancerígena de drostanolona (9), propionato de drostanolona y heptanoato de drostanolona (1), se evaluó la citotoxicidad de los compuestos 1-9 contra las líneas celulares cancerosas HeLa, PC-3, H460 y HCT116. Curiosamente, todos los compuestos mostraron una actividad anticancerígena de moderada a potente. La actividad anticancerosa de los compuestos 1 a 9 se dedujo de los valores de CI50 frente a HeLa (carcinoma cervical humano), PC-3 (cáncer de próstata humano), H460 (cáncer de pulmón humano) y HCT116 (cáncer de colon humano) (Tabla 5). Sobre la base de estos resultados, también se evaluó la citotoxicidad de estos compuestos frente a la línea celular normal 3T3 (fibroblastos de ratón), en la que todos los compuestos, excepto 8 (CI50 = 74,6 ± 3,7 µM) y 9 (CI50 = 62,1 ± 1,2 µM), resultaron no citotóxicos.

la Tabla 5. Citotoxicidad de los compuestos 1-9 contra el cáncer HeLa, PC3, H460 y HCT116, y líneas celulares normales 3T3.
la Relación Estructura-Actividad
las Variaciones en las estructuras de los metabolitos efectúa su actividad anti-cáncer. El metabolito 2 con ausencia de fracción éster, y dos grupos aO-H en C-3 y C-14, y un grupo ßO-H en C-17 mostraron una menor citotoxicidad frente a líneas celulares cancerosas HeLa, H460 y HCT116, pero su actividad anticancerosa fue mayor frente a la línea celular cancerosa PC-3, en comparación con el compuesto 1. El metabolito 3 con pérdida del grupo éster y dos grupos ceto en C-3 y C-17, y el grupo aO-H en C-7 también mostró una actividad más baja contra las líneas celulares cancerosas HeLa, H460 y HCT116, pero una actividad mayor contra la línea celular cancerosa PC-3 en comparación con el sustrato 1. La reducción del carbonilo C-3 a O-H y la escisión hidrolítica de la fracción éster en el compuesto 4 aumentaron su actividad contra las líneas celulares cancerosas HeLa y PC-3 en cierta medida, pero su actividad anticancerosa contra las líneas celulares cancerosas H460 y HCT116 disminuyó en comparación con el sustrato 1. La presencia de C = C entre C-1/C-2 y C-4/C-5, junto con C = O en C-3 y C-17, convirtió al metabolito 5 en un potente agente anticancerígeno contra la línea celular de cáncer HeLa, en comparación con el sustrato 1 y el fármaco estándar (cisplatino). Además, su actividad anticancerígena contra la línea celular de cáncer PC-3 también aumentó en comparación con el sustrato 1. Curiosamente, su actividad anticancerígena contra las líneas celulares cancerosas H460 y HCT116 fue menor en comparación con el compuesto 1. La presencia de C = C entre C-1/C-2 y C-4/C-5, C = O en C-3 y C-17, junto con el grupo aO-H en C-11 en el metabolito 6 aumentó su actividad anticancerosa frente a HeLa, y las líneas celulares cancerosas PC-3 en comparación con el sustrato 1, y mostró un potencial anticanceroso similar frente a la línea celular cancerosa de HeLa como fármaco estándar (cisplatino). Sin embargo, su actividad anticancerosa contra las líneas celulares cancerosas H460 y HCT116 disminuyó en comparación con el compuesto 1. La presencia de C = C entre C-1/C-2 y C-4/C-5, C = O en C-3 y C-17, junto con el grupo aO-H en C-14 en el metabolito 7 aumentó nuevamente su actividad anticancerígena frente a las líneas celulares HeLa y PC-3, y disminuyó su actividad anticancerígena frente a las líneas celulares H460 y HCT116 en comparación con el sustrato 1. La presencia de C = C en C-1/C-2, C = O en C-3 y C-17, y aOH en C-7 convirtió al metabolito 8 en el anticancerígeno más potente contra la línea celular de cáncer HeLa en comparación con el sustrato 1 y el fármaco estándar (cisplatino). También mostró una buena actividad contra la línea celular de cáncer PC-3, pero disminuyó la actividad anticancerosa contra las líneas celulares de cáncer H460 y HCT116 en comparación con el sustrato 1. El metabolito 9 con solo hidrólisis en C-17 mostró un aumento de la actividad anticancerosa frente a las líneas celulares cancerosas HeLa, PC-3 y HCT116, pero disminuyó la citotoxicidad frente a la línea celular cancerosa H460 en comparación con el sustrato 1 y el fármaco estándar (cisplatino). Sobre la base de la discusión anterior, se puede concluir que el aumento de la actividad anticancerosa de los compuestos 5-8 contra HeLa y las líneas celulares cancerosas PC-3 se debió probablemente a la presencia de C = C en C-1/C-2, y carbonil cetona en C-3 y C-17 en comparación con el sustrato 1.
Conclusión
Contribuciones de los autores
El concepto de investigación presentada fue desarrollado y diseñado por el MIC. MIC también era el supervisor del proyecto. Todos los datos fueron analizados e interpretados por CMI, A-t-W y HC. MS, SY, MA y NF realizaron los experimentos. MIC, A-t-W y MS escribieron el manuscrito. Todos los autores revisaron el manuscrito. La versión final del manuscrito también fue aprobada por el MIC antes de su envío.
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Agradecimientos
A-t-W, y MIC reconocen el papel facilitador de la Comisión de Educación Superior, Islamabad, Pakistán, a través de un apoyo financiero bajo, «Estudios sobre la Quimioprevención de la Carcinogénesis Mamaria por Agentes Dietéticos, (20-3790/NRPU/R&D/HEC/13 / 793). SY reconoce el apoyo financiero de la Organización para la Prohibición de las Armas Químicas (OPAQ) a través de un proyecto de investigación titulado «Estudios estructurales y biológicos sobre nuevos esteroides anabólicos obtenidos por biotransformación.»HC reconoce el apoyo financiero del Decanato de Investigación Científica (DSR), Universidad Rey Abdulaziz, Ministerio de Educación, Arabia Saudita.»
Supplementary Material
Eastman, A. (1999). «El mecanismo de acción del cisplatino: de los aductos a la apoptosis», en Cisplatino: Chemistry and Biochemistry of a Leading Anticancer Drug, ed B. Lippert( Zürich: Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002/9783906390420.ch4
CrossRef Texto Completo | Google Scholar
Vardar, E., Vardar, S. A., y Cengiz, T. (2002). Abuso de esteroides anabolizantes androgénicos. Anato. J. Psychiatry 3, 104-107.