- Introducción
- Materiales y Métodos
- Materiales vegetales y Condiciones de Crecimiento
- Mediciones de PSI y PSII
- Análisis de cambios electrocrómicos
- Tratamientos fotoinhibitorios
- Análisis estadístico
- Resultados
- Discusión
- El papel de la estimulación del CEF en condiciones de poca luz
- El cambio en la Relación de oxidación de P700 con Poca Luz No Está Relacionado con pmf
- ETRII Controla la relación de oxidación de P700 con poca luz
- Conclusión
- Contribuciones de los autores
- Financiación
- Declaración de Conflicto de Intereses
Introducción
Aunque la luz es la fuerza impulsora de la fotosíntesis, la luz alta puede causar una fotoinhibición significativa del fotosistema II (PSII) para las hojas de las plantas que establecen sombra (Kitao et al., 2000; Barth et al., 2001; Krause et al., 2004; Huang et al., 2015b, 2016b, c). Sin embargo, el PSII fotoinhibido se recupera rápidamente con poca luz (He y Chow, 2003; Zhang y Scheller, 2004, Allakhverdiev et al., 2005), debido a la rápida tasa de rotación de la proteína D1 (Aro et al., 1993; Zhang y Scheller, 2004; Allakhverdiev et al., 2005). La tasa de reparación de PSII se redujo al inhibir la síntesis de ATP a través de PSI o PSII (Allakhverdiev et al., 2005), indicando que la reparación rápida de complejos PSII fotodamagados necesita una gran cantidad de ATP en poco tiempo. Un estudio previo indicó que después de la fotoinhibición de PSII inducida por enfriamiento, el flujo cíclico de electrones (CEF) se estimuló significativamente durante la recuperación con poca luz (Huang et al., 2010). Se propuso que esta estimulación de la FCE en condiciones de poca luz mejoraba la síntesis de ATP para la reparación rápida de la PSII (Huang et al., 2010). Sin embargo, se necesitan más pruebas para aclarar el papel específico de la estimulación de la FEC con poca luz después de la fotoinhibición de la PSII.
Durante el CEF, los electrones de NADPH o ferredoxina se ciclan alrededor de PSI en la piscina de plastoquinonas. Esta transferencia de electrones está acoplada a la translocación de protones y genera un gradiente de protones a través de las membranas tilacoides (ΔpH) (Shikanai y Yamamoto, 2017). Además de contribuir a la síntesis de ATP, otra función de ΔpH es la regulación descendente del transporte fotosintético de electrones mediante la acidificación del lumen tilacoide (Shikanai, 2014, 2016). Esta regulación implica dos mecanismos diferentes: uno está vinculado a la disipación de energía térmica y disipa el exceso de energía de luz absorbida como calor de las antenas PSII (Takahashi et al., 2009), y la otra es la regulación a la baja de la actividad del complejo Cyt b6/f y controla la velocidad de transferencia de electrones a PSI (Suorsa et al., 2012, 2016; Tikkanen y Aro, 2014). En angiospermas que incluyen Arabidopsis thaliana, están operando dos vías de transporte cíclico de electrones PSI (Shikanai, 2007). La primera vía de la FCE es la vía dependiente de PGR5/PGRL1 sensible a la antimicina A (Munekage et al., 2002; Sugimoto et al., 2013), y el otro depende del complejo similar a la NADH deshidrogenasa del cloroplasto (NDH) (Burrows et al., 1998; Shikanai et al., 1998). La contribución de la vía dependiente de PGR5/PGRL1 es más significativa en plantas C3. Bajo luz intensa, la activación del CEF dependiente de PGR5/PGRL1 induce la acidificación del lumen tilacoide y, por lo tanto, conduce a altos niveles de relación de oxidación de P700 (Suorsa et al., 2012, 2016; Kono et al., 2014; Yamori et al., 2016). En comparación, la relación de oxidación de P700 en condiciones de poca luz se vio poco afectada por la deficiencia de CEF dependiente de PGR5/PGRL1 (Munekage et al., 2002, 2004; Kono et al., 2014). Con fotoinhibición de PSII moderada, la estimulación de la FCE con poca luz se acompañó de un aumento en la ración de oxidación de P700 (Huang et al., 2010). Sin embargo, no está claro si este aumento de la relación de oxidación de P700 es causado por la estimulación del CEF.
Además del CEF, la transferencia de electrones desde PSII (ETRII) juega un papel importante en afectar el estado redox de PSI (Tikkanen et al., 2014; Huang et al., 2016a, c; Suorsa et al., 2016). En plantas pgr5 de A. thaliana, es probable que la fotoinhibición severa de PSII funcione como el control final de la transferencia de electrones fotosintéticos permitiendo el mantenimiento de P700 óptimamente oxidado bajo exceso de luz(Tikkanen et al., 2014). Recientemente, Suorsa et al. (2016) indicaron que las plantas pgr5 mostraron una alta relación de oxidación de P700 bajo luz elevada cuando el ETRII se redujo mediante la combinación de mutaciones knockout en los loci PsbO1, PsbP2, PsbQ1, PsbQ2 y PsbR. En hojas de tabaco refrigeradas, la fotoinhibición PSII moderada redujo el flujo de electrones a PSI y luego aumentó la relación de oxidación de P700 durante los tratamientos de enfriamiento posteriores (Huang et al., 2016a). Además, la fotoinhibición de PSII inducida por enfriamiento condujo a una depresión de ETRII, que se acompañó de un aumento en la relación de oxidación de P700 con poca luz (Huang et al., 2010). Planteamos la hipótesis de que la relación de oxidación de P700 a poca luz está controlada principalmente por el flujo de electrones de PSII.
En nuestro informe anterior, observamos que la planta generadora de sombra Panax notoginseng mostró fotoinhibición selectiva de PSII bajo un alto estrés lumínico. Después de una exposición a corto plazo a un alto estrés lumínico, el ETRII con poca luz disminuyó significativamente, pero el CEF se estimuló significativamente. Al mismo tiempo, la relación de oxidación de P700 aumentó en gran medida. Nuestros objetivos específicos eran (1) investigar si la estimulación del CEF con poca luz facilita principalmente la síntesis de ATP; y (2) determinar si el aumento en la relación de oxidación de P700 en la fotoinhibición de PSII moderada está más relacionado con ETRII que con la estimulación de la FCE o el cambio en la pmf. Para responder a estas preguntas, las hojas intactas de Panax notoginseng se trataron a 2258 µmol de fotones m-2 s-1 durante 30 min. Antes y después del tratamiento con luz alta, se determinó la distribución de energía en PSII, el estado redox de PSI y la fuerza motriz de protones (pmf) a una luz baja de 54 µmol de fotones m-2 s-1.
Materiales y Métodos
Materiales vegetales y Condiciones de Crecimiento
En el presente estudio, se utilizaron plantas de 2 años de edad de una planta de establecimiento de sombra Panax notoginseng (Burkill) F. H. Chen ex C. Chow y W. G. Huang para experimentos. Estas plantas se cultivaron en condiciones de luz solar del 10% (con una intensidad de luz máxima al mediodía de aproximadamente 200 µmol de fotones m-2 s-1). No se experimentaron tensiones de agua y nutrición para estas plantas. se utilizaron hojas completamente expandidas de 9 semanas de edad para las mediciones fotosintéticas.
Mediciones de PSI y PSII
Los parámetros del Fotosistema I y PSII se midieron a 25°C mediante un registro simultáneo con un sistema de medición Dual PAM-100 (Heinz Walz GmbH, Effeltrich, Alemania). Los parámetros de fluorescencia de clorofila se calcularon de la siguiente manera: Fv/Fm = (Fm – Fo)/Fm, Y(II) = (Fm’ – Fs)/Fm’ (Genty et al., 1989), NPQ = (Fm – Fm’)/Fm’. Fo y Fm son la fluorescencia mínima y máxima después de la aclimatación en la oscuridad, respectivamente. Fs es la fluorescencia de estado estacionario adaptada a la luz. Fo y Fm se determinaron después de la aclimatación en la oscuridad durante 30 minutos antes y después del tratamiento con luz alta. Los parámetros fotosintéticos PSI se midieron mediante PAM-100 Dual basado en la señal P700 (diferencia de intensidades de luz de medición modulada por pulso de 830 y 875 nm que llega al fotodetector) (Klughammer y Schreiber, 2008). Las señales P700+ (P) pueden variar entre un nivel mínimo (P700 completamente reducido) y un nivel máximo (P700 completamente oxidado). El nivel máximo (Pm) se determinó con la aplicación de un pulso de saturación (600 ms y 10000 µmol de fotones m-2 s-1) después de la preiluminación con luz roja lejana, y se utilizó Pm para estimar la actividad PSI. Pm ‘ se determinó de manera similar a Pm, pero con luz actínica en lugar de luz roja lejana. El rendimiento cuántico de PSI se calculó como Y (I) = (Pm’- P)/Pm. La relación de oxidación de P700 en una luz actínica dada se calculó como Y ( ND) = P/Pm. El rendimiento cuántico de la disipación de energía no fotoquímica PSI debido a la limitación del lado del aceptor se calculó como Y (NA) = (Pm-Pm’)/Pm. Los valores de estado estacionario para Y(II), NPQ, Y(I) e Y(ND) se midieron después de la aclimatación a poca luz durante 20 min.
El flujo fotosintético de electrones a través de PSI y PSII se calculó como: ETRII = Y (II) ×PPFD ×0,84 ×0,5 (Krall y Edwards, 1992), ETRI = Y (I) ×PPFD×0,84 ×0,5 (Yamori et al., 2011), donde se supone que 0,5 es la proporción de luz absorbida que alcanza PSI o PSII, y 0,84 es la absorción (la fracción de la luz incidente absorbida por las hojas). El grado de activación de la MCE se estimó en la relación ETRI/ETRII (Yamori et al., 2011, 2015). Cabe señalar que la partición de excitación 1: 1 entre PSI y PSII puede no ser real, porque las plantas de sombra tienden a aumentar la relación PSII/PSI (Lunde et al., 2003; Tikkanen et al., 2006; Grieco et al., 2012). Además, en este estudio, los parámetros PSI y PSII se midieron utilizando luz actínica roja (635 nm) proporcionada por Dual-PAM 100 (Walz, Alemania). Debido a que la luz actínica roja favorece la excitación de PSII sobre la de PSI, la distribución de energía de excitación de LHCII a PSII y PSI puede verse afectada por la luz actínica roja (Tikkanen et al., 2017).
Análisis de cambios electrocrómicos
La señal ECS se monitorizó como el cambio de absorbancia a 515 nm utilizando un módulo Dual-PAM-100 (Walz, Effeltrich, Alemania) equipado con un módulo detector emisor P515 / 535 (Walz). La señal de ECS se obtuvo después de 20 min de iluminación a 54 µmol de fotones m-2 s-1, posteriormente se midió el decaimiento de ECS apagando la luz actínica durante 30 s. El análisis de la cinética de relajación del intervalo oscuro de ECS (DIRKECS) se realizó por el método de Sacksteder et al. (2001) y Takizawa et al. (2008). La pmf total se estimó a partir de la amplitud total de la rápida desintegración de la señal ECS durante el intervalo oscuro de 300 ms. La lenta relajación de la señal ECS permitió reconocer la contribución del gradiente de protones a través de las membranas tilacoides (ΔpH). La constante de tiempo de la relajación de ECS de primer orden (TECs) es inversamente proporcional a la conductividad de protones (gH+) de la membrana tilacoide a través de la ATP sintasa (Sacksteder y Kramer, 2000; Cruz et al., 2005). Como resultado, gH + se estimó como el inverso de la constante de tiempo de desintegración .
Tratamientos fotoinhibitorios
Después de aclimatación a oscuras durante 30 min, se midieron Fv/Fm y Pm en hojas intactas. Posteriormente, estas hojas intactas fueron adaptadas a la luz a 59 µmol de fotones m-2 s-1 durante 20 min y se registraron los parámetros de fluorescencia de clorofila, señal P700 y señal ECS. Luego, la luz actínica se cambió a 2258 µmol de fotones m-2 s-1. Después de la exposición a esta luz elevada durante 30 min, la luz actínica se cambió inmediatamente a 59 µmol de fotones m-2 s-1 y los parámetros fotosintéticos se registraron después de la aclimatación de la luz durante 20 min. Finalmente, se midieron Fv/Fm y Pm después de la aclimatación en la oscuridad durante 30 min.
Análisis estadístico
Los resultados se mostraron como valores medios de cinco experimentos independientes. Se utilizó la prueba T independiente a un nivel de significación α = 0,05 para determinar si existían diferencias significativas entre los diferentes tratamientos. Todos los análisis estadísticos se realizaron con el programa SPSS 16.0.
Resultados
Durante la inducción fotosintética a 59 µmol de fotones m-2 s-1, el ETRII aumentó gradualmente y alcanzó un estado estacionario a unos 18 min (Figura 1A). En comparación, el ETRI fue constante durante esta fase de inducción (Figura 1A). Después de la aparición de esta luz baja, el ETRI fue mucho más alto que el ETRII. Sin embargo, después de una inducción fotosintética de 20 minutos, el ETRI fue menor que el ETRII. Estos resultados sugirieron la activación del CEF durante la fase inicial de inducción, de acuerdo con estudios previos (Joliot y Joliot, 2002, 2005; Makino et al., 2002). Después de esta inducción fotosintética a poca luz, las hojas se iluminaron a una luz alta de 2258 µmol de fotones m-2 s-1 durante 30 min. Curiosamente, el ETRII disminuyó gradualmente durante el tratamiento con mucha luz (Figura 1B). Mientras tanto, el valor de ETRI fue mayor que el de ETRII (Figura 1B), lo que indica la activación del CEF bajo luz elevada. Después de este tratamiento de alta luz, el P700 fotooxidable máximo (Pm) se mantuvo estable (Figura 2A). En comparación, la intensidad de fluorescencia máxima (Fm) disminuyó en un 40% y el rendimiento cuántico máximo de PSII (Fv/Fm) disminuyó de 0,80 a 0,65 (Figuras 2B,C). Estos resultados indicaron la fotoinhibición selectiva de PSII en hojas de Panax notoginseng bajo estrés de alta luz.
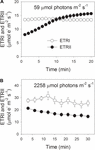
la FIGURA 1. Flujo fotosintético de electrones a poca luz (A) y a mucha luz (B). A) Las hojas aclimatadas a la oscuridad fueron expuestas a una luz baja de 59 µmol de fotones m-2 s-1 durante 20 min. B) Después de la iluminación a 59 µmol de fotones m-2 s-1 durante 20 min para activar el sumidero de electrones en la fotosíntesis, las hojas se expusieron a una luz elevada de 2.258 µmol de fotones m-2 s-1 durante 30 min. Los valores son medias ± SE (n = 5).
Después del tratamiento de alta luz, el valor de estado estacionario de Y(I) a 59 µmol de fotones m-2 s-1 no cambió (Figura 4A). Curiosamente, Y (NA) disminuyó significativamente de 0,36 a 0,23(Figura 4B), y Y (ND) aumentó significativamente de 0,1 a 0,25 (Figura 4C). Estos resultados indicaron el cambio en el estado redox de la PSI con poca luz después del tratamiento fotoinhibitorio. Mientras tanto, el valor de NPQ cambió ligeramente (Figura 4D). Como resultado, la fotoinhibición PSII moderada tuvo diferentes efectos en la relación de oxidación de P700 y NPQ con poca luz.
Para aclarar si el aumento de Y(ND) es causado por un aumento de pmf, se determinaron las señales de desplazamiento electrocromático a 54 µmol de fotones m-2 s-1 después de la aclimatación a la luz durante 20 min antes y después del tratamiento de alta luz. Curiosamente, el pmf total disminuyó significativamente en un 18% después del tratamiento con luz alta (Figura 5A), pero el nivel de ΔpH cambió insignificantemente (Figura 5B). Debido a que la formación de pmf puede verse afectada por la conductividad de protones tilacoides, la conductividad de protones (gH+) de la membrana tilacoide en esta luz baja también se examinó antes y después del tratamiento con luz alta. El resultado mostró que gH+ no cambió con el tratamiento de alta luz (Figura 5C), lo que sugiere que el tratamiento de alta luz apenas afectó la actividad de la cloroplasto ATP sintasa con poca luz. Debido a que la disminución del 30% en ETRII se acompañó de una disminución del 18% en pmf, la estimulación de la CEF con poca luz compensó en parte la formación de pmf y ΔpH.

la FIGURA 5. Valores de la fuerza motriz total de protones (pmf) (A), el gradiente de protones (ΔpH) a través de las membranas tilacoides (B) y la conductividad de protones (gH+) de la membrana tilacoide (C) con poca luz. Todos los parámetros se midieron después de la adaptación a 54 µmol de fotones m-2 s-1 durante 20 min. Los valores son medias ± SE (n = 5). El asterisco indica un cambio significativo (P < 0,05) después de un tratamiento con luz intensa.
Discusión
El papel de la estimulación del CEF en condiciones de poca luz
Se ha indicado que el CEF desempeña un papel importante en el mantenimiento de la fotosíntesis y el crecimiento de las plantas (Yamori y Shikanai, 2016). Bajo la luz de la luz, ahora se cree que el CEF es esencial para equilibrar el presupuesto de energía ATP / NADPH, así como para proteger el PSI y el PSII de daños (Munekage et al., 2002, 2004; Takahashi et al., 2009; Suorsa et al., 2012, 2016; Walker et al., 2014; Huang et al., 2015a, 2017b). A baja intensidad de luz, el CEF juega un papel importante en la optimización de la asimilación fotosintética de CO2, probablemente a través del suministro de ATP adicional (Yamori et al., 2011, 2015; Nishikawa et al., 2012; Huang et al., 2015a). El papel principal del CEF se modula de forma flexible en respuesta a la intensidad de la luz. En particular, el CEF contribuye principalmente a equilibrar el presupuesto de energía ATP/NADPH bajo intensidades de luz sub-saturadas, pero principalmente protege los aparatos fotosintéticos contra la fotoinhibición cuando se exponen a intensidades de luz saturadas a través de la acidificación del lumen tilacoide (Huang et al., 2015a). Curiosamente, Huang et al. (2010) encontraron que el CEF se estimulaba significativamente en condiciones de poca luz después de la fotoinhibición inducida por enfriamiento del PSII y plantearon la hipótesis de que esta estimulación del CEF aumentaba principalmente la síntesis de ATP para la reparación rápida del PSII. Sin embargo, se necesitaban más pruebas para apoyar esta hipótesis. En el presente estudio, observamos que el valor de ETRI/ETRII en condiciones de poca luz aumentó significativamente (Figura 3C), lo que indica la estimulación de la FCE alrededor de la PSI (Huang et al., 2011,2012, 2017a, b; Yamori et al., 2011, 2015). Concomitantemente, la amplitud de la pmf disminuyó significativamente y ΔpH disminuyó ligeramente. Estos resultados indicaron que la estimulación del CEF no desencadenó la regulación descendente dependiente de ΔpH del transporte fotosintético de electrones. En otras palabras, esta estimulación de la FCE con poca luz facilitó principalmente la síntesis de ATP.
Aunque la conductividad de protones de la cloroplasto ATP sintasa no se vio afectada por el tratamiento de alta luz, el tamaño más pequeño de la pmf resultó en una disminución en la tasa real de síntesis de ATP. Las tasas de reparación de PSII y asimilación fotosintética de CO2 con poca luz están limitadas principalmente por la tasa de síntesis de ATP (Allakhverdiev et al., 2005; Yamori et al., 2011, 2015; Nishikawa et al., 2012). Debido a que el ETRII disminuyó significativamente con la fotoinhibición de PSII, la tasa de síntesis de ATP a través de ETRII se redujo notablemente. Para equilibrar la relación ATP/NADPH requerida por el metabolismo primario y la reparación rápida de PSII, se necesita un mecanismo flexible para proporcionar ATP adicional. Bajo esta condición, el ETRII disminuyó en un 30%, pero el pmf total disminuyó en solo un 18%. Estos resultados indican que la estimulación de la FCE compensó la reducción de la formación de pmf dependiente de ETRII, potenciando la síntesis de ATP. La rápida reparación de los PSII fotodamagados depende de la síntesis de ATP (Allakhverdiev et al., 2005). La aceleración de la FCE alrededor de la PSI aumentó la concentración intracelular de ATP, acelerando así la tasa de reparación de PSII en Synechocystis (Allakhverdiev et al., 2005). En conjunto, proponemos que la estimulación de la FCE con poca luz juega un papel importante en la reparación rápida de la actividad PSII a través de una síntesis adicional de ATP.
El cambio en la Relación de oxidación de P700 con Poca Luz No Está Relacionado con pmf
Un fenómeno interesante es que la relación de oxidación de P700 con poca luz aumentó significativamente en fotoinhibición PSII moderada (Huang et al., 2010), que también se muestra en el presente estudio. En condiciones en las que la luz absorbida supera los requisitos para la fotosíntesis, la generación dependiente de CEF de ΔpH reduce la actividad del complejo Cyt b6/f y controla el flujo de electrones de PSII a PSI (Suorsa et al., 2012, 2016; Shikanai, 2014, 2016), optimizando el estado redox de P700 en PSI y minimizando la producción de ROS en PSI durante la fotosíntesis. En las plantas pgr5 de A. thaliana, el P700 es reducido por electrones en la luz debido a la pérdida de generación de pmf. Sin embargo, en la proteína flavodiiron acumulativa mutante pgr5, el nivel de pmf también se restauró al nivel de tipo silvestre, y por lo tanto P700 se oxidó como en el tipo silvestre (Yamamoto et al., 2016). En las líneas mutantes de trigo deficientes en clorofila b, el gradiente de protones tilacoides insuficiente conduce a una reducción excesiva del lado aceptor de PSI y, por lo tanto, a la fotoinhibición de PSI bajo alta luz o alta temperatura (Brestic et al., 2015, 2016). Recientemente, algunos estudios informaron que el aumento de la actividad de la ATP sintasa del cloroplasto perjudicaba la formación de pmf y causaba una reducción excesiva de la cadena fotosintética de transporte de electrones, lo que resultaba en fotodaño de PSI bajo luz elevada y luz fluctuante (Kanazawa et al., 2017; Takagi et al., 2017). Estos informes respaldan el papel fundamental de la pmf en el mantenimiento de la P700 oxidada de manera óptima bajo el exceso de energía lumínica.
Nuestros resultados actuales indicaron que después del tratamiento con luz alta durante 30 min, el pmf total formado en esta luz baja disminuyó significativamente y la formación de ΔpH cambió ligeramente (Figuras 5A,B). Mientras tanto, la relación de oxidación del P700 aumentó significativamente de 0,1 (antes del tratamiento) a 0,25 (después del tratamiento) (Figura 4C). Estos resultados indican claramente que este aumento en la relación de oxidación de P700 no puede explicarse por el cambio en la pmf, que es en gran medida diferente de la correlación entre Y(ND) y pmf bajo luz alta (Yamamoto et al., 2016; Takagi et al., 2017). Por lo tanto, el efecto regulador de pmf en la relación de oxidación del P700 es mínimo con poca luz, pero se vuelve particularmente crucial bajo luz alta o luz fluctuante. Bajo luz intensa, un valor alto de Y(ND) suele ir acompañado de un valor alto de NPQ (Munekage et al., 2002, 2004; Kono et al., 2014; Zivcak et al., 2015), debido al aumento de pmf. El deterioro de la formación de ΔpH conduce a una disminución de los niveles de Y(ND) y NPQ bajo luz intensa (Suorsa et al., 2012; Kono et al., 2014; Yamamoto et al., 2016; Kanazawa et al., 2017). La inducción de NPQ con poca luz está determinada principalmente por el nivel de acidificación del lumen. Después del tratamiento con luz alta, el grado de acidificación del lumen no cambió (Figura 5B), y el NPQ se mantuvo estable (Figura 4D). En comparación, Y(ND) aumentó significativamente. Estos resultados indican que con poca luz, Y (ND) y NPQ fueron controlados por diferentes mecanismos regulatorios.
ETRII Controla la relación de oxidación de P700 con poca luz
PSI se reduce excesivamente solo cuando el flujo de electrones de PSII excede la capacidad de los aceptadores de electrones PSI para hacer frente a los electrones. Cuando el flujo de electrones a PSI es limitado, PSI es extremadamente tolerante al estrés lumínico en las plantas pgr5 de A. thaliana(Suorsa et al., 2012, 2016; Tikkanen et al., 2014). Para la Psicotria rubra de la planta que establece la sombra, la actividad PSI fue insensible al estrés de luz alta en presencia de DCMU (Huang et al., 2016c). En hojas de tabaco refrigeradas, la fotoinhibición PSII moderada permitió el mantenimiento de P700 óptimamente oxidado y luego protegió la actividad PSI contra fotodaños adicionales (Huang et al., 2016a). Estos resultados indicaron el importante papel de ETRII en el control del estado redox de PSI bajo altas tensiones de luz o luz de enfriamiento. Nuestros resultados actuales mostraron que la fotoinhibición de PSII moderada condujo a una depresión significativa de ETRII con poca luz. Mientras tanto, la actividad PSI y la actividad de la ATP sintasa del cloroplasto cambiaron ligeramente, y el pmf total y ΔpH no aumentaron. Como resultado, la reducción de ETRII no fue causada por el control fotosintético dependiente de ΔpH a través del complejo Cyt b6/f, sino que probablemente fue inducida por la disminución de la actividad de PSII (Tikkanen et al., 2014). La disminución del suministro de electrones de PSII a PSI llevó al aumento del nivel de oxidación de P700. Por lo tanto, la relación de oxidación del P700 en condiciones de poca luz fue controlada en gran medida por ETRII.
Conclusión
Encontramos que la fotoinhibición selectiva de PSII indujo una estimulación de la FCE y un aumento en la relación de oxidación de P700 con poca luz. La estimulación del CEF no desencadenó la regulación descendente dependiente de ΔpH del transporte fotosintético de electrones. Como resultado, esta estimulación de la FCE con poca luz facilitó principalmente la síntesis de ATP, que es esencial para la reparación rápida de PSII fotodamagadas. El aumento en la relación de oxidación de P700 no pudo explicarse por el cambio en el control fotosintético dependiente de ΔpH en el complejo Cyt b6/f, pero fue causado principalmente por la disminución del suministro de electrones de PSII a PSI.
Contribuciones de los autores
WH, S-BZ y TL concibieron y diseñaron la investigación. WH y Y-JY llevaron a cabo los experimentos. WH, Y-JY, S-BZ y TL analizaron los datos. WH escribió el primer borrador del manuscrito, que fue editado intensamente por todos los autores.
Financiación
Este estudio fue apoyado por la Fundación Nacional de Ciencias Naturales de China (31670343), la Asociación de Promoción de la Innovación Juvenil de la Academia China de Ciencias (2016347) y los Principales Programas de Ciencia y Técnica en la provincia de Yunnan (2016ZF001).
Declaración de Conflicto de Intereses
Los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un posible conflicto de intereses.
Kono, M., Noguchi, K., and Terashima, I. (2014). Roles del flujo cíclico de electrones alrededor de la PSI (CEF-PSI) y las vías alternativas dependientes de O2 en la regulación del flujo fotosintético de electrones en luz fluctuante a corto plazo en Arabidopsis thaliana. Fisiol de Células Vegetales. 55, 990–1004. doi: 10.1093/pcp/pcu033
Resumen de PubMed | Texto completo cruzado/Google Scholar
Shikanai, T. (2016). Red reguladora de la fuerza motriz de protones: contribución del transporte cíclico de electrones alrededor del fotosistema I. Fotosíntesis. Res. 129, 253 a 260. doi: 10.1007 / s11120-016-0227-0
Resumen de PubMed / Texto completo cruzado / Google Scholar
Yamori, W., Makino, A., and Shikanai, T. (2016). Un papel fisiológico del transporte cíclico de electrones alrededor del fotosistema I en el mantenimiento de la fotosíntesis bajo luz fluctuante en el arroz. Sci. República 6:20147. doi: 10.1038/srep20147
Resumen de PubMed / Texto completo cruzado / Google Scholar
Yamori, W., and Shikanai, T. (2016). Funciones fisiológicas del transporte cíclico de electrones alrededor del fotosistema I en el mantenimiento de la fotosíntesis y el crecimiento de las plantas. Annu. Modif. De La Planta Biol. 67, 81–106. doi: 10.1146 / annurev-arplant-043015-112002
Resumen PubMed | Texto completo cruzado | Google Scholar
Yamori, W., Shikanai, T., and Makino, A. (2015). El flujo cíclico de electrones del fotosistema I a través del complejo similar a la NADH deshidrogenasa del cloroplasto desempeña un papel fisiológico para la fotosíntesis en condiciones de poca luz. Sci. República 5:13908. doi: 10.1038/srep13908
Resumen PubMed / Texto completo cruzado / Google Scholar
Zhang, S. P., and Scheller, H. V. (2004). Fotoinhibición del fotosistema I a temperatura de enfriamiento y posterior recuperación en Arabidopsis thaliana. Fisiol de Células Vegetales. 45, 1595–1602. doi: 10.1093 / pcp/pch180
Resumen de PubMed / Texto completo de CrossRef / Google Scholar