INTRODUCCIÓN
El hematoma intramural aórtico (HMI) es una de las diversas afecciones incluidas en el síndrome aórtico agudo (AAS).1,2 En términos morfológicos se caracteriza por hemorragia en la capa media de la pared aórtica en ausencia de desgarro intimal-medial, lo que significa que no hay comunicación con la luz aórtica. Algunos autores han sugerido que la HMI es el resultado de la ruptura espontánea del vasa vasorum aórtico. La frecuencia de HMI en pacientes con sospecha clínica de AAS oscila entre el 5 y el 20% de los casos.2-4
Como es el caso similar a la disección aórtica clásica, la HMI se distingue en dos tipos según la clasificación de Stanford: tipo A, cuando hay compromiso de la aorta ascendente, y tipo B, cuando la aorta ascendente no está afectada.
Actualmente se acepta que el tratamiento de la HMI tipo A es esencialmente quirúrgico, mientras que el tipo B puede tratarse inicialmente con terapia médica, reservando la cirugía o la colocación de stent para los casos con complicaciones añadidas. La mortalidad asociada a la HMI en los primeros meses no es despreciable; los principales factores predictivos independientes de muerte son el diámetro aórtico >50 mm y el compromiso de la aorta ascendente.5
Todavía hay algunas incertidumbres en cuanto a la historia natural de esta enfermedad y el tratamiento más adecuado para los pacientes afectados. Clásicamente, se aconseja evitar la anticoagulación en pacientes con AAS principalmente por dos razones: para limitar la progresión de la disección del hematoma y para evitar el taponamiento cardíaco en pacientes con derrame pericárdico.
El objetivo del presente estudio es describir las características clínicas y radiológicas, así como la evolución de un subgrupo de pacientes con IMH que recibieron tratamiento anticoagulante durante la hospitalización.
MÉTODOS
Todos los pacientes ingresados en nuestro hospital con diagnóstico de AA entre enero de 2000 y diciembre de 2005 fueron evaluados prospectivamente. Entre estos pacientes, seleccionamos a todos los que tenían una HMI y habían recibido tratamiento anticoagulante durante la hospitalización. Se recopiló información demográfica, así como datos clínicos, radiológicos y de seguimiento.
El diagnóstico de AAS se estableció mediante tomografía computarizada (TC) con y sin realce de contraste. Los estudios de imágenes de seguimiento posteriores se realizaron con TC y / o resonancia magnética (RM).
Todos los pacientes estudiados recibieron tratamiento médico dirigido al control estricto de la presión arterial (PA ≤120/80 mm Hg), que incluyó betabloqueantes en todos los casos, excepto cuando hubo contraindicaciones para este tratamiento.
RESULTADOS
Durante el período de estudio, ingresaron en nuestro centro 95 pacientes con diagnóstico de AA. Doce (25.6%) de estos pacientes presentaron HMI (4 tipo A y 8 tipo B). Tres pacientes con HMI que recibieron tratamiento anticoagulante durante la hospitalización (uno con HMI tipo A y 2 con HMI tipo B) son objeto de este informe.
Las características clínicas y la información demográfica principal de los pacientes con HMI que recibieron anticoagulación se describen a continuación y se presentan en la Tabla.
Caso 1
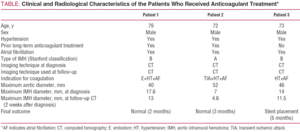
los 79 años de edad con hipertensión arterial no controlada a pesar del tratamiento farmacológico y fibrilación auricular crónica. La historia clínica de la paciente incluyó un episodio de embolia arterial en el miembro superior derecho 5 años antes, que había sido tratado con anticoagulación oral. Fue ingresado por un dolor intenso de inicio repentino en la región intercapular, que irradiaba al abdomen y estaba acompañado de sudoración profusa y mareos. La tomografía computarizada realizada en la unidad de urgencias identificó una HMI tipo B que se extendía desde el origen de la arteria subclavia izquierda hasta la bifurcación aortoilíaca y afectaba a los primeros centímetros de la arteria ilíaca común izquierda (Figura 1). En el momento del ingreso, el paciente fue tratado con labetalol y nitroprusiato por perfusión y se suspendió la anticoagulación. Tras la interrupción de este tratamiento, la paciente presentó un nuevo episodio de embolia arterial en el miembro superior izquierdo que requirió embolectomía. Por esta razón, se estableció la anticoagulación, inicialmente con heparina sódica y posteriormente con acenocumarol.
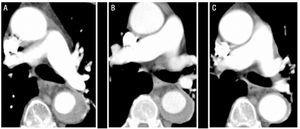
la Figura 1.Evolución radiológica del hematoma intramural aórtico tipo B (HMI) en el paciente 1. Cortes de TC seriados en la bifurcación de la arteria pulmonar muestran disminución progresiva del grosor de la lesión y resolución final. A: Grosor de la HMI en el momento del diagnóstico. B: espesor en el primer seguimiento de TC (2 semanas de evolución). C: Espesor IMH a los 2 meses.
Caso 2
Varón de 72 años con hipertensión arterial de larga evolución bajo tratamiento farmacológico y antecedentes de fibrilación auricular crónica, para la que estaba recibiendo digoxina y acenocumarol. Vino a nuestro centro por un dolor opresivo en el pecho medio de aparición repentina que irradiaba a la espalda. La tomografía computarizada inicial mostró una HMI tipo A con compromiso de la aorta ascendente, el arco aórtico y la aorta descendente hasta el origen de la arteria mesentérica superior. Se suspendió la anticoagulación. Durante la hospitalización, el paciente presentó un episodio de pérdida de conciencia con hemiparesia izquierda, de la que se recuperó sin secuelas. La TC cerebral no mostró signos de isquemia o hemorragia intracraneal, por lo que el episodio fue interpretado como un ataque isquémico transitorio de origen embólico. Debido a esta complicación, se reinició el tratamiento anticoagulante con heparina sódica en perfusión seguida de acenocumarol durante la hospitalización.
Caso 3
Varón de 73 años, fumador, con insuficiencia renal crónica y antecedentes de hipertensión de larga evolución; tenía fibrilación auricular crónica y estaba recibiendo terapia antiagregante plaquetaria. El paciente vino a nuestro hospital por un dolor interescapular severo que se irradia a ambos flancos. La tomografía computarizada inicial estableció el diagnóstico de hematoma intramural tipo B confinado a la aorta torácica descendente. En el segmento distal del hematoma, se observó una imagen en forma de lágrima (proyección en forma de úlcera) dentro del hematoma (Figura 2). A pesar de que el paciente nunca había tenido un episodio de embolia, el tratamiento anticoagulante se inició al ingreso debido a su alto perfil de riesgo embólico.
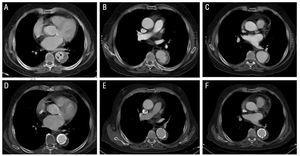
la Figura 2. Evolución radiológica del hematoma intramural aórtico tipo B (HMI) en el paciente 3. Panel superior: imágenes en el momento del diagnóstico (A) y durante el seguimiento (B y C). R: observe la imagen en forma de lágrima (proyección en forma de úlcera) dentro de la HMI (flechas). B: disección localizada durante el seguimiento (2 meses después). C: dilatación progresiva del diámetro aórtico. Panel inferior: imágenes a los 5 meses del diagnóstico (D-F). La dilatación progresiva del hematoma dicta la implantación de dos stents.
Seguimiento radiológico
El diámetro máximo de la aorta y el diámetro máximo de la HMI en el momento del diagnóstico, así como la evolución de la lesión en cada paciente, se muestran en la Tabla.
Durante el seguimiento radiológico, todos los pacientes mostraron una disminución gradual del grosor de la HMI. En los pacientes 1 y 2, el diámetro máximo de la HMI en el momento del diagnóstico fue de 17,6 y 7 mm, respectivamente. En el estudio de seguimiento por TC de 2 semanas, los diámetros fueron de 13 y 4,6 mm, respectivamente.
En el paciente 3, el grosor de la HMI fue de 14 mm en la TC inicial y de 11,5 mm en la exploración de seguimiento. Además, el paciente presentó una imagen en forma de lágrima en el extremo distal de la HMI, que midió 4×??6 mm en el momento del diagnóstico. Algunos autores han interpretado esto como un signo que indica una úlcera aórtica (proyección tipo úlcera). Tras el alta hospitalaria, el paciente desarrolló una disección localizada con posterior dilatación progresiva del segmento aórtico afectado (pseudoaneurisma) que requirió la implantación de 2 stents (Excluyente 34×??10 mm y 40??×10 mm). La evolución posterior fue favorable (Figura 2).
DISCUSIÓN
Durante el período de estudio estudiado, 3 pacientes con HMI recibieron tratamiento anticoagulante. A pesar de que la HMI es una lesión hemorrágica, la evolución clínica y morfológica fue favorable en este subgrupo de pacientes, con regresión progresiva del tamaño de la lesión en las evaluaciones radiológicas de seguimiento, a pesar de que se administró anticoagulación. El paciente 3 desarrolló una complicación durante el seguimiento en un segmento de la aorta en el que la lesión inicial puede haber sido una úlcera aórtica penetrante (PAU). Sin embargo, el hematoma sufrió inicialmente cambios similares a los observados en los otros dos pacientes, con una disminución gradual del diámetro durante la fase aguda. El papel que la anticoagulación podría haber desempeñado en la patogénesis y la evolución a un pseudoaneurisma es difícil de establecer.
No hay datos definitivos en la literatura científica sobre el uso de anticoagulación en pacientes con AA, aunque la interrupción de este tratamiento es una práctica común. Es probable que la anticoagulación no modifique el curso natural de la HMI. Tres argumentos apoyan esta hipótesis: a) dado que la hemostasia no tiene un papel importante en la patogénesis de la lesión, es poco probable que tenga un impacto en su resolución; b) la HMI es una afección confinada al interior de la pared aórtica y no está en contacto con la luz del vaso, por lo que es improbable que el anticoagulante penetre en la lesión; y c) los estudios epidemiológicos no han demostrado una mayor incidencia de HMI en pacientes con alteraciones congénitas o adquiridas de los componentes de la hemostasia.
Concluimos que en situaciones en las que es necesaria la anticoagulación (pacientes con alto riesgo de embolia) se puede mantener este tratamiento, a partir de los resultados de este estudio en el que la anticoagulación no parecía tener un impacto en la evolución clínica o morfológica de la HMI. Naturalmente, se requieren más estudios con series de pacientes más grandes para sacar conclusiones definitivas.