El primer fármaco biológico, la insulina humanizada (5,8 kDa), se puso a disposición en 1982 tras el advenimiento de la biotecnología, y marcó una nueva era en la industria farmacéutica. Los avances modernos en biotecnología permiten síntesis de productos biológicos a gran escala de manera más o menos rentable. Habiendo comenzado con péptidos grandes y proteínas recombinantes, los biológicos hoy en día incluyen una amplia gama de otras entidades, como anticuerpos, anticuerpos monoclonales y, más recientemente, nanobodios y objetos relacionados, receptores solubles, ADN recombinante, conjugados anticuerpo-fármaco (ADC), proteínas de fusión, inmunoterapéuticos y vacunas sintéticas.
La «estrella en ascenso» de los medicamentos biológicos ha estado captando la atención cada vez mayor de los profesionales farmacéuticos y los analistas de la industria, ya que este paradigma alternativo de descubrimiento de medicamentos representa un desafío comercial sustancial para el paradigma de descubrimiento de medicamentos de moléculas pequeñas más tradicional que define la industria farmacéutica durante más de un siglo.
Entonces surge la pregunta: ¿las moléculas pequeñas están perdiendo «atractivo» como objetos de investigación para el descubrimiento de fármacos en el mundo moderno de los avances biológicos? Algunos expertos se mantienen optimistas sobre el potencial de las moléculas pequeñas para liderar la carrera en las futuras tuberías farmacéuticas, otros perciben que «el dinero está cambiando de bolsillos», y la investigación de moléculas pequeñas será cada vez más descuidada por los accionistas e inversores en favor de los productos biológicos.
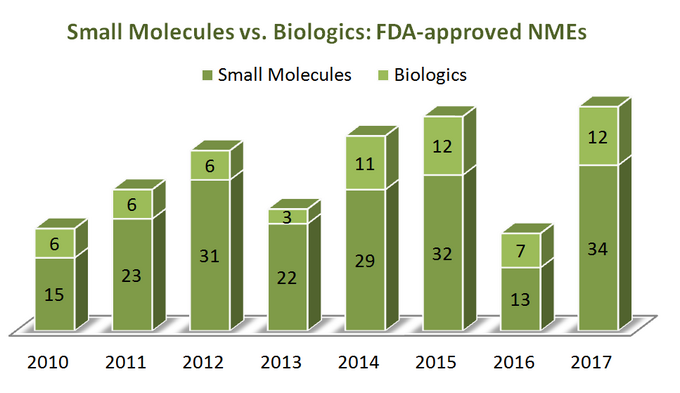
Para averiguar hacia dónde se dirige la industria, comencemos primero con un poco de estadísticas. Durante un período de 7 años (2010-2017) de estados UNIDOS La Administración de Alimentos y Medicamentos (FDA) aprobó un total de 262 nuevas entidades moleculares (EMN), excluyendo varios agentes de diagnóstico por imágenes y 1 análogo de insulina (ref). Parece que el 76% de ellas son moléculas pequeñas (199) y solo una cuarta parte son biológicas. Curiosamente, no hay un crecimiento aparente en las aprobaciones de las EMN biológicas en relación con las moléculas pequeñas, ya que ambas categorías de terapias tienen una tendencia bastante similar, como se muestra en el diagrama a continuación. Sin embargo, dado que los productos biológicos tienen un precio muy diferente al de las moléculas pequeñas (son mucho más caros), el panorama es diferente cuando se mira el crecimiento total de las ventas y los ingresos: durante el período comprendido entre 2011 y 2017, los ingresos por ventas biológicas han crecido un 70%, alcanzando los 232 mil millones de dólares. La cuota del mercado farmacéutico total que poseen los productos biológicos aumentó del 16% en 2006 al 25% en 2016, sin signos aparentes de desaceleración (ref).
Si bien hay ventajas distintivas de los biológicos sobre las moléculas pequeñas de varias maneras (por ejemplo, su profunda selectividad), las cosas no son «en blanco y negro» al comparar estas dos categorías de terapias por sus atributos, ya que ambas tienen pros y contras sustanciales a considerar durante la toma de decisiones estratégicas. Por lo tanto, parece un poco lamentable ver cómo numerosos informes dejaron de lado a SMs en comparación con los productos biológicos en busca de «frescura» de sus puntos de vista.
Una tabla a continuación resume algunos aspectos fuertes y débiles de ambas categorías (ref, ref) que ilustran los desafíos y oportunidades disponibles en ambos «campamentos» (note los colores: gris-ninguna ventaja aparente en ninguno de los dos campamentos; verde-situación ventajosa; amarillo-situación desventajosa):
Moléculas Pequeñas |
Biología |
|---|---|
|
Propiedades generales |
|
|
Bajo peso molecular (0,1 – 1 kDa); generalmente química y térmicamente estable, amplia gama de polaridad. |
Muy grandes pesos moleculares >1 kDa; generalmente polar, sensible al calor, fácilmente degradable (con la excepción de algunos tipos de larga vida, como los anticuerpos monoclonales) |
|
Selectividad, seguridad |
|
|
Bastante promiscuo, generalmente a varios sitios fuera del objetivo, produciendo efectos secundarios o toxicidad. Finalmente, a los desarrolladores biológicos les ha sido más fácil obtener patentes porque había poco o ningún estado de arte en el campo, cuando se descubrieron los éxitos de taquilla actuales. |
Altamente específico para los objetivos, generalmente de menor toxicidad (con una excepción importante que es la de inmunogenicidad, que puede influir seriamente en la eficiencia, la seguridad y la disposición de los productos biológicos). |
|
Permeabilidad celular |
|
|
Los SMS se unen a objetivos como receptores acoplados a proteínas G (GPCR), canales iónicos dependientes de ligandos y receptores de tirosina quinasas en el extracelular o dominios intracelulares. Pueden acceder a blancos en las regiones intracelulares, citosoles, núcleos e incluso blancos del SNC, separados por la estrecha barrera hematoencefálica (BBB). |
Una gran proporción de dianas farmacológicas están incrustadas y, por lo tanto, son inaccesibles para los productos biológicos. Especialmente, cuando se trata del sistema nervioso central (SNC), la presencia de la barrera hematoencefálica es un obstáculo importante en el camino de cualquier molécula mayor a 600 Da que restrinja hasta el 98% de los SMS y prácticamente todos los productos biológicos. |
|
Entrega |
|
|
en Gran medida caer en la «Regla de los cinco» para la absorción oral, por lo que es adecuado para administración oral. La permeabilidad adicional a través del epitelio intestinal está mediada principalmente por una combinación de difusión pasiva y transporte paracelular. |
La inestabilidad intrínseca y las masas moleculares altas hacen que casi todos los productos biológicos sean inactivos por vía oral. Principalmente, entrega invasiva, o tecnologías alternativas no invasivas en progreso. |
|
Distribución |
|
|
Los SMS se distribuyen a través de la circulación sanguínea, lo que permite alcanzar concentraciones de selección rápidamente. |
Para moléculas más grandes (por ejemplo, > 10 kDa), un sistema linfático más lento (entre 100 y 500 veces) se vuelve dominante en el proceso de distribución. Los productos biológicos más grandes se distribuyen a través de la sangre y los sistemas linfáticos, el transporte convectivo en movimiento, la endocitosis mediada por receptores, la fagocitosis y la pinocitosis. El resultado de esta situación es que los productos biológicos más grandes tienen semividas más largas, volúmenes de distribución limitados y necesitan más tiempo para alcanzar las concentraciones máximas, en comparación con los SMS. |
|
Disposición (metabolismo) |
|
|
La mayoría de los SMS se eliminan por órganos no dirigidos, a través de metabolismos citocromos o no citocromos, filtración renal o excreción fecal. |
Los productos biológicos tienen interacciones más estrechas con los blancos, por lo que su disposición se ve directamente afectada por su unión (disposición de los medicamentos mediada por los receptores), incluyendo el aclaramiento de los productos biológicos por proteasas y peptidasas. |
|
Interacciones farmacológicas |
|
|
Los SMS son propensos a interacciones farmacológicas que pueden ocurrir debido a la presencia de medicamentos concomitantes que afectan sus vías de transporte, metabolismo, transporte o eliminación. |
Los productos biológicos son menos propensos a las interacciones medicamentosas tradicionales, ya que se metabolizan y eliminan como sustratos endógenos. Sin embargo, hay cambios documentados mediados por citocinas en las enzimas metabolizadoras de fármacos, por lo tanto, las interacciones fármaco-biológicas deben evaluarse en el caso de que el fármaco pueda influir en la expresión de enzimas metabólicas. |
|
aspectos del Negocio |
|
|
precios Bajos para SM drogas. |
Normalmente, los precios de los tratamientos biológicos son muy altos. Se considera que esta es una de las razones por las que los productos biológicos parecen ofrecer mejores rendimientos económicos generales en comparación con los SMS. |
|
Alta tasa de desgaste (el estudio de 2009 del Grupo KMR mostró que solo el 7,1% de los SMS que ingresaron a las pruebas preclínicas finalmente llegaron al mercado). |
Tasa de desgaste relativamente baja (el mismo estudio del Grupo KMR reveló que el 24,4% de los productos biológicos en estadio preclínico sobrevivieron hasta la fase de mercado). |
|
Severe competition from chemical generics after patents expiration. |
Biologics developers face less severe competition from biosimilars, after patents expiration. |
|
Simpler drug discovery/development process. |
More expensive and complex drug discovery and development process, compared to biologics. |
Teniendo en cuenta la comparación anterior, se hace obvio que los productos biológicos no son una «bala mágica» y la industria no estará dominada por los productos biológicos en el futuro previsible, sino que se mantendrá un equilibrio competitivo entre moléculas pequeñas, productos biológicos y formas híbridas de terapias, como ADC — con dominio de cada forma en áreas terapéuticas más adecuadas, casos de uso, etc.
Además, a continuación se muestra una lista de varios impulsores de la industria que están jugando del lado de las moléculas pequeñas y podrían influir en el equilibrio de poderes en el mercado farmacéutico total en favor de los puntos de partida químicos:
El auge de la inteligencia artificial (IA) en el descubrimiento de medicamentos
Tras los avances en algoritmos de aprendizaje profundo (2012) y, más recientemente, la creación de redes generativas de confrontación (GANs), capaces de sobresalir en una serie de tareas de investigación, el interés todas las industrias. Muchas herramientas impulsadas por IA se han convertido rápidamente en la corriente comercial, como chatbots, asistentes personales, pilotos automáticos, etc.– que es una prueba de concepto de viabilidad de IA en el mundo real.
El descubrimiento de medicamentos no es una excepción a esta «tendencia impulsada por la IA», y el número de nuevas empresas que intentan aplicar la IA para impulsar el descubrimiento de medicamentos de diferentes maneras ha crecido sustancialmente en solo varios años, habiendo llegado a más de cien empresas activas hasta la fecha (aquí hay una lista de algunas de ellas).
Curiosamente, la mayoría de las startups impulsadas por IA se centran en el descubrimiento de fármacos de moléculas pequeñas, en lugar de en productos biológicos, lo que, probablemente, no es sorprendente. Históricamente, incluso los métodos computacionales no basados en IA (quiminformática) se utilizaron principalmente para terapias de moléculas pequeñas debido a sus estructuras moleculares y patrones de interacción sustancialmente más simples.
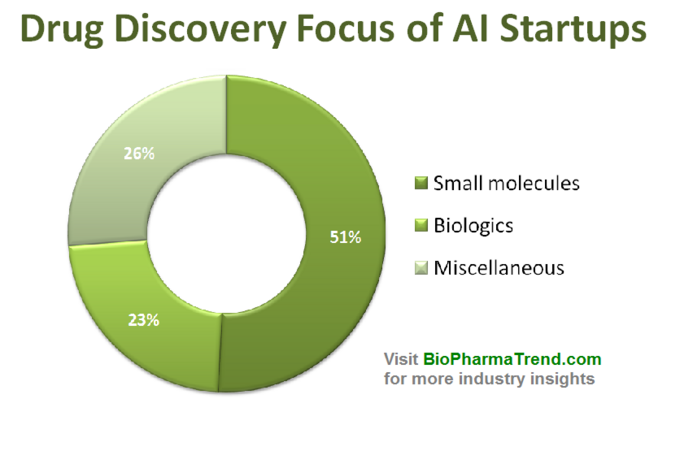
El siguiente diagrama muestra una estadística estimada de 61 startups de descubrimiento de medicamentos comercializadas activamente que desarrollan o aplican herramientas de inteligencia artificial especializadas en su flujo de trabajo de investigación. Como se puede ver, la mitad de todas las empresas (51%, 31 startups) se centran en moléculas pequeñas, mientras que solo el 23% (14 startups) participan en el descubrimiento/desarrollo de fármacos biológicos (anticuerpos, vacunas, etc.). La desproporción hacia las moléculas pequeñas también está bien ilustrada por la cantidad de fondos de capital riesgo recaudados colectivamente por 61 startups impulsadas por IA revisadas (solo rondas divulgadas públicamente), donde se invirtieron 770 millones en aquellas compañías involucradas en moléculas pequeñas y solo un poco más de 200 millones se asignaron para startups centradas en productos biológicos, como se muestra a continuación.
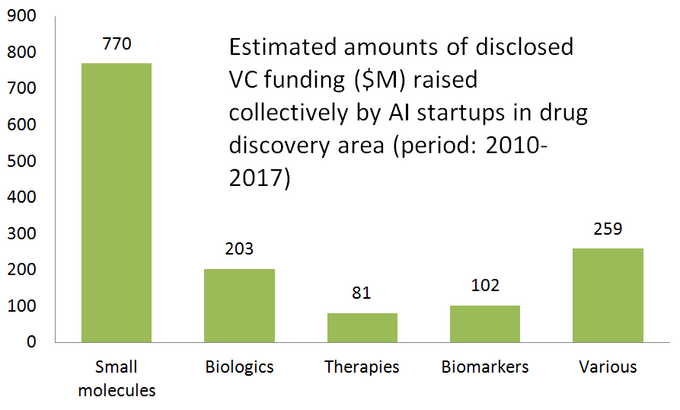
Esta situación sugiere que los avances recientes en algoritmos de IA y una tendencia a aplicar el aprendizaje automático para la investigación farmacéutica en etapas tempranas tienden a impulsar un mayor crecimiento en el descubrimiento de medicamentos de moléculas pequeñas, en comparación con el descubrimiento de productos biológicos, al menos por ahora. Esto podría llevar a más inversiones futuras en proyectos centrados en moléculas pequeñas respaldados por tecnologías impulsadas por IA.
Alcanzar objetivos «no drogables»
Objetivos tan importantes como, por ejemplo, las interacciones proteína-proteína (IBP), están tradicionalmente dominados por los biológicos (MAB) como actores potenciales, mientras que las moléculas pequeñas se habían considerado durante mucho tiempo inadecuadas en este caso debido a su pequeño tamaño.
Con los avances en farmacogenómica, esta situación puede cambiar con bastante rapidez tras las aprobaciones maraviroc (514 Da) y tirofiban (441 Da). Se reveló computacionalmente que los SMS en realidad pueden tener afinidades relativamente altas a interfaces específicas de proteínas y, lo que es más importante, pueden modular las «regiones proteicas intrínsecamente desordenadas» vinculadas a un conjunto de enfermedades de sistemas complejos. Aquí hay un interesante encubrimiento de este tema que resume algunas de las ideas importantes sobre la maquinaria de PPI obtenidas en las últimas décadas.
Otra área de rápido crecimiento para el descubrimiento de fármacos de moléculas pequeñas es el ácido ribonucleico (ARN). Este tema se enumeró en «Las 7 principales tendencias en Investigación Farmacéutica En 2018», y también hubo una revisión detallada del tema en Biología Química Celular y un buen encubrimiento de la industria en C&EN.
Otra nueva idea para liberar el poder de las moléculas pequeñas se discutió en un artículo reciente,»Los degradadores de proteínas dirigidos están redefiniendo el aspecto y el comportamiento de las moléculas pequeñas», publicado en C&EN en 2018. La estrategia aquí es desarrollar pequeñas moléculas bifuncionales capaces de dirigir una proteína dirigida por completo al proteasoma, la máquina de eliminación de basura de la célula, en lugar de simplemente inhibir la acción de la proteína como en un enfoque «tradicional».
Superar las limitaciones de las tecnologías de detección
Todavía no se ha realizado un gran potencial de investigación de moléculas pequeñas debido a las diversas limitaciones tecnológicas de los enfoques de detección utilizados para identificar puntos de partida en los programas de descubrimiento de fármacos.
Un ejemplo es el enfoque de detección fenotípica, que está experimentando un renacimiento hoy en día debido a varios avances tecnológicos, incluida la creciente capacidad para desarrollar modelos celulares fisiológicamente relevantes, lecturas y tecnologías de detección sofisticadas que ayudan a revelar mecanismos de acción (MoA) de manera más eficiente, minimizando la incertidumbre. Por otro lado, la implementación de técnicas de perfilado a gran escala y métodos computacionales ofrece un nuevo nivel de análisis de sistemas y comprensión de fenotipos de moléculas pequeñas.
Otro paradigma prometedor de cribado es el uso de bibliotecas codificadas por ADN (DELs). Debido a su disposición única, la tecnología DEL proporciona una forma adecuada de probar cientos de millones e incluso miles de millones de moléculas novedosas en programas de descubrimiento de fármacos basados en objetivos. Si bien esta tecnología no está exenta de desafíos (por ejemplo, limitaciones de la química compatible con el ADN, incertidumbre con los resultados de detección, etc.), el área está creciendo rápidamente e incluso se considera «revolucionaria» para el descubrimiento de fármacos de moléculas pequeñas.
Superar la barrera de sintetizabilidad
Una de las piedras de tropiezo del descubrimiento temprano de fármacos de moléculas pequeñas es una limitación del espacio químico accesible sintéticamente while mientras que muchas ideas químicas prometedoras se pueden generar computacionalmente, o de otra manera, siempre existe el riesgo de que sintetizar todo el conjunto de compuestos para validar tales ideas sea costoso, o incluso inviable.
Se han realizado avances recientes en esta área, una vez más, utilizando software basado en IA que ofrece un rendimiento de planificación de síntesis a nivel humano. Por ejemplo, BenevolentAI publicó recientemente un artículo en Nature, describiendo cómo utilizaron redes neuronales profundas en combinación con algoritmos modernos de búsqueda de árboles para planificar la síntesis de moléculas novedosas con una tasa de éxito y velocidad notables.
Derek Lowe publicó aquí y aquí varios encubrimientos interesantes con comentarios enriquecidos que proporcionan un poco más de información sobre esta fascinante área de la química orgánica y medicinal.
Una estrategia más empírica fue desarrollada por un productor químico Enamina, que se conoce como Espacio Químico REAL, y actualmente incluye más de 3.8 mil millones de moléculas sintéticamente accesibles y buscables para la exploración de hit y otras tareas de química medicinal. El concepto se reduce a aplicar un conjunto de rutas químicas validadas internamente (más de 100 reacciones) a un gran conjunto de bloques de construcción químicos disponibles en stock propio (más de 100 mil compuestos) — con el objetivo de combinarlos de manera combinatoria para producir una cascada de moléculas más grandes «similares al plomo» o «similares a drogas». Una vez que se logra un cierto grado de reproducibilidad y rendimiento en un conjunto suficientemente grande de experimentos (al menos el 80%), se lleva a cabo una enumeración computacional adicional para construir un espacio químico más amplio basado en los casos validados experimentalmente.
Nuevo R& D mercados y roles para moléculas pequeñas
En general, se puede pasar por alto o malinterpretar el tamaño y el potencial de crecimiento de las tuberías de moléculas pequeñas, como se mencionó durante una mesa redonda en Interphex. Actualmente, alrededor de 8000 moléculas pequeñas están activas en R& D, un crecimiento del 25% en los últimos dos años. Los factores de crecimiento mencionados anteriormente pueden conducir a un mayor crecimiento acelerado en este sector.
También es importante tener en cuenta que los medicamentos de moléculas pequeñas podrían desempeñar un papel importante en algunos medicamentos de próxima generación, haciéndolos dependientes de tuberías de moléculas pequeñas. Por ejemplo, en el caso de la terapia con células madre, las moléculas pequeñas pueden desencadenar reacciones terapéuticas.
Como destacó Jeffrey Shumway de Milliporesiigma durante CPhI Norteamérica, los productos de moléculas pequeñas tienden a volverse más complejos, alterando su papel en la industria (bio)farmacéutica.
Finalmente, el área futura para moléculas pequeñas son los conjugados anticuerpo-fármaco y objetos relacionados, que emergieron como una clase prometedora de terapias debido a la convergencia natural de dos paradigmas de descubrimiento de fármacos y múltiples tendencias tecnológicas.
Descargo de responsabilidad: La información es solo para conocimiento general, y no es un consejo legal/financiero/de comercio de acciones/médico de ningún tipo. Usted lo lee a su propia voluntad y cualquier uso de esta información es bajo su propio riesgo. Es su responsabilidad evaluar la utilidad y seguridad de la información en esta publicación, y de Internet en general, y cómo se aplica a su propia situación, y luego consultar a los expertos pertinentes para obtener asesoramiento profesional si es necesario.
Temas: Tendencias de la Industria