Si desarrolla productos, especialmente dispositivos médicos, entonces ha escuchado los términos validación de diseño y verificación de diseño(también llamados V& V). Aquí explicaremos cuáles son las dos actividades, la diferencia entre ellas, además de compartir consejos para aprovechar al máximo sus esfuerzos.
Nota: Para validar que este contenido le sería útil, nos conectamos con Megan Martin, consultora de dispositivos médicos V&V con más de 30 años de experiencia en dispositivos médicos V&V, software de dispositivos médicos, calidad de productos y software, y presentaciones reglamentarias de dispositivos estadounidenses e internacionales. ¡Encontrarás sus ideas y ejemplos a lo largo de todo!
Siga o vaya a la sección que busca:
- Validación de diseño vs. Verificación de diseño
- ¿Qué es Exactamente la Validación de diseño?
- ¿Qué es la Verificación de diseño para la FDA?
- Resumen de Validación vs Verificación
- Fundamentos del Proceso de Validación de Diseño
- Fundamentos del Proceso de Verificación de Diseño
- 6 Consejos para una mejor validación & Verificación
- Vídeo: Simplifique V & V
- V&V: Glosario de Términos
- Validación de diseño vs. Verificación de diseño: ¿Cuál es la diferencia?
- ¿Qué Es La Validación De Diseño Exactamente?
- Ejemplo de validación de diseño
- Necesidad del usuario
- ¿Qué es la Verificación de diseño para la FDA?
- Ejemplo de verificación de diseño
- los Requisitos del Producto
- Especificaciones de Diseño
- Resumen de validación vs Verificación
- Fundamentos del proceso de validación del diseño
- Fundamentos del Proceso de verificación de diseño
- Identificar y preparar
- Planificación
- Desarrollo de
- Ejecutar los procedimientos de prueba
- La presentación de informes
- 6 Consejos para una mejor Validación & Verificación
- Planifique con anticipación (Y Realice la Prueba con anticipación)
- Usar nomenclatura compartida
- Use herramientas con trazabilidad de extremo a extremo
- Construya Su Matriz de trazas A medida que avanza
- Integrar Trazabilidad de requisitos & Realizar pruebas con Seguimiento de anomalías
- Elija Herramientas Que Puede Personalizar según Su Método
- Reunir todo
- Simplificar V&V Con Hélice ALM
- V& V: Glosario de términos
- Acrónimos comunes de Validación de Diseño
Validación de diseño vs. Verificación de diseño: ¿Cuál es la diferencia?
¿Cuál es la diferencia entre validación y verificación? En pocas palabras, la validación del diseño determina si está construyendo el producto correcto. ¿Funciona el dispositivo según lo previsto para los usuarios finales? La verificación de diseño determina si está construyendo el producto correctamente. ¿Las salidas de diseño coinciden con las entradas de diseño?
Esa es la diferencia simple que se muestra claramente en el gráfico a continuación.
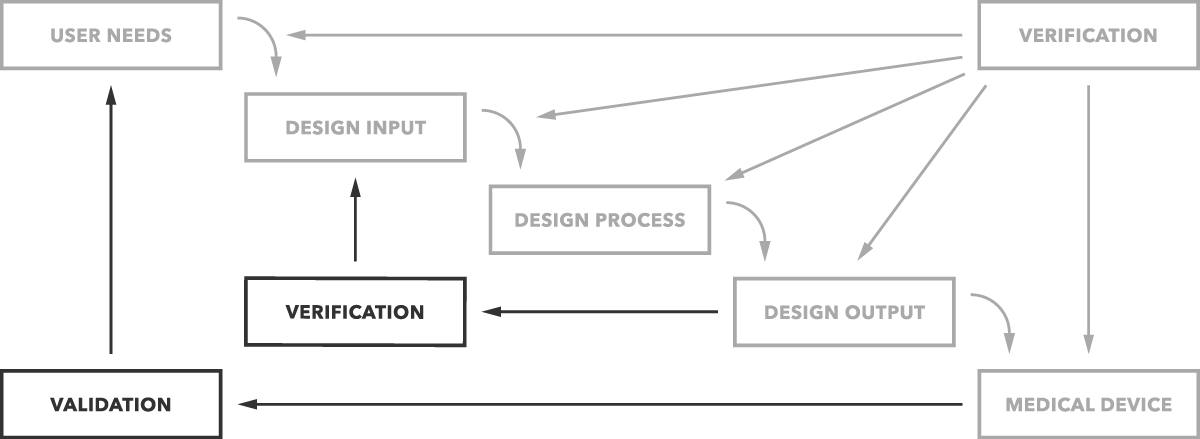
Pero desea obtener más detalles y ejemplos, por supuesto. Empezaremos con la validación.
¿Qué Es La Validación De Diseño Exactamente?
La validación de diseño es un proceso de prueba mediante el cual se demuestra («validar») que el dispositivo que se ha creado funciona para el usuario final según lo previsto.
La palabra oficial de la FDA(21 CFR 820.3) establece que la validación del diseño es «establecer mediante evidencia objetiva que las especificaciones de los dispositivos se ajustan a las necesidades del usuario y al uso previsto (s).»
Ejemplo de validación de diseño
Imaginemos que estamos construyendo un ventilador que mantiene la respiración del paciente y que el usuario desea que funcione durante el transporte del paciente.
Primero, debemos definir las necesidades de nuestros usuarios. El usuario quiere mover a los pacientes mientras están en el ventilador. Pero, ¿qué están tratando de hacer en realidad? El «transporte» puede incluir el traslado del paciente dentro del hospital. O puede incluir transporte en ambulancia o por aire. Una necesidad del usuario, por ejemplo, podría tener el siguiente aspecto.
Necesidad del usuario
| UsNe-0001 | El ventilador es adecuado para su uso durante el transporte hospitalario de pacientes. |
Esta necesidad del usuario será desglosado en los requisitos del producto y especificaciones de diseño para diseñar y construir el producto. (Los veremos en un momento bajo verificación de diseño.)
Antes de eso, examinemos la necesidad del usuario y veamos qué casos de prueba de validación de diseño podrían ser necesarios. Las pruebas de validación de las necesidades de nuestros usuarios podrían verse así.
| Usuario Necesita |
Validación Prueba |
||
|---|---|---|---|
| UsNe-0001 | El ventilador es adecuado para su uso durante el transporte intrahospitalario de los pacientes.Conjunto de pruebas de validación | TCase-0001 | : Pruebe que 15 miembros del personal de transporte del hospital pueden enrollar fácilmente el ventilador. |
| TCase-0002 | Conjunto de pruebas de validación: Pruebe que el ventilador funciona dentro de sus especificaciones mientras se enrolla por los pasillos, sobre los atascos de las puertas y sobre los umbrales de los ascensores. | ||
| TCase-0003 | Conjunto de pruebas de validación: Pruebe que el ventilador funciona dentro de sus especificaciones mientras realiza la transición entre la alimentación de CA y el funcionamiento con batería. | ||
Las pruebas de validación incluirían casos de prueba, conjuntos de pruebas o incluso ensayos clínicos diseñados para demostrar que el producto, tal como está construido, funciona de acuerdo con las expectativas del usuario en las condiciones en las que pretende usarlo. Dado que estas pruebas deben realizarse en unidades de producción o equivalentes a la producción, las pruebas de validación de diseño son a menudo las últimas pruebas realizadas.
Básicamente, en la validación de diseño, necesitamos demostrar que el producto satisface las necesidades del usuario.
Por cierto, la tabla anterior también muestra la trazabilidad entre las necesidades del usuario y los casos de prueba. Esta matriz de trazas proporciona parte de la evidencia V&V que la FDA requiere.
¿Qué es la Verificación de diseño para la FDA?
La verificación de diseño es donde se prueba («verifica») que las salidas de diseño coinciden con las entradas de diseño.
De nuevo, de acuerdo con la FDA, la verificación del diseño es «la confirmación mediante el examen y la provisión de pruebas objetivas de que se han cumplido los requisitos especificados.»
Tenga en cuenta que, si bien implicará pruebas, hay otras actividades de verificación aceptables.
Pueden incluir pruebas, inspecciones y análisis (para obtener más información, consulte la Guía de Control de diseño de la FDA).
Ejemplo de verificación de diseño
Volvamos a nuestro ejemplo de ventilador. Hemos identificado las necesidades de nuestros usuarios; ahora identifiquemos qué tiene que hacer el dispositivo y cómo tiene que hacerlo.
Para lograrlo, necesitamos definir los requisitos específicos del producto. Por ejemplo:
- ¿Cuál es la carga máxima para un paciente? (¿ Cuánto aire necesita el ventilador para moverse?)
- ¿Cuánto tiempo debe durar la batería? (¿Cuánto tarda el transporte?)
- ¿Qué condiciones encontrarán durante el transporte? (Atascos de puerta? Los ascensores?)
- ¿Hay alguna norma reglamentaria que deba cumplirse? (Normas de seguridad?)
» Los requisitos claros, completos, inequívocos y comprobables son un componente clave en un proyecto de desarrollo exitoso. Requisitos inadecuados conducen a pérdida de tiempo, errores de diseño, reelaboración extensa y productos frágiles o propensos a errores.»- Megan Martin, V& V Consultant
Esta es la parte» qué » de definir las características del dispositivo. ¿Qué tendrá que hacer exactamente el dispositivo? Los requisitos del producto (que a menudo se incluyen en un documento de requisitos del producto) para nuestras necesidades de usuario pueden verse a continuación.
los Requisitos del Producto
|
PrRq-0001 |
El ventilador tendrá un valor máximo de 2 litros de volumen controlado respiraciones a 20 respiraciones por minuto. |
|
PrRq-0002 |
El ventilador debe funcionar con alimentación de batería al máximo la configuración de un mínimo de 90 minutos. |
|
PrRq-0003 |
El ventilador deberá ser capaz de ser montado en un rodillo de soporte de apoyo. |
|
PrRq-0004 |
El ventilador y el soporte deben poder atravesar los umbrales típicos de puertas y ascensores del hospital. |
por último, tenemos la especificación de diseño. «Ya hemos definido lo vamos a lograr, y ahora tenemos que definir cómo vamos a hacerlo», dice Megan. Esto se puede lograr de una variedad de maneras, incluyendo especificaciones escritas, dibujos eléctricos o mecánicos, especificaciones de compra de componentes u otros métodos.
Por ejemplo, las especificaciones de diseño y los dibujos pueden mostrar lo siguiente.
Especificaciones de Diseño
|
DSpec-0001 |
Una turbina que puede generar hasta 40 litros de aire por minuto. |
|
DSpec-0002 |
Una batería de iones de litio capacidad nominal para a menos de 100 Amperios Horas. |
|
DSpec-0003 |
El soporte para el soporte de rodadura utiliza una abrazadera de acero con acción de palanca clasificada para 22 lbs. |
|
DSpec-0004 |
La base del soporte es de 22″ de ancho con 5 ruedas. |
|
DSpec-0005 |
El soporte de ruedas de 4″ de diámetro. |
La verificación del diseño proporciona pruebas (resultados de pruebas) de que las salidas de diseño (producto real) cumplen con las entradas de diseño (requisitos del producto y especificaciones de diseño). Dependiendo del elemento que se verifique, se ejecutará un caso de prueba o conjunto de pruebas, o se realizará una inspección o análisis para proporcionar la evidencia requerida.
Las siguientes tablas ilustran cómo podría verse eso. También muestran la trazabilidad que espera la FDA.
| Requisito del producto | Prueba de verificación | ||
|---|---|---|---|
| PrRq-0001 | El ventilador deberá tener un ajuste máximo de volumen de 2 litros-respiraciones controladas a 20 respiraciones por minuto. | Caso de prueba TCase-0004 | : Verifique los ajustes máximos de respiración o las combinaciones de ajustes de respiración. |
| PrRq-0002 | El ventilador funcionará con batería a la máxima configuración durante un mínimo de 90 minutos.conjunto de pruebas | TCase-0005 | : Verifique el tiempo de ejecución en la configuración máxima con una batería nueva completamente cargada. |
| TCase-0006 | Conjunto de pruebas: Verifique el tiempo de ejecución en la configuración máxima con una batería que haya pasado por 50 ciclos de carga. | ||
| PrRq-0003 | El ventilador podrá montarse en un soporte rodante. | TCase-0007 | Prueba de demostración: Demuestre que el ventilador se puede conectar y separar del soporte rodante. |
| PrRq-0004 | El ventilador y el soporte deben poder atravesar los umbrales típicos de puertas y ascensores del hospital. | TCase-0008 | Prueba externa: Prueba ejecutada por un servicio de pruebas para verificar que el ventilador y el soporte se puedan rodar por encima de un umbral sin inclinarse según la norma Eléctrica médica IEC 60601-1. |
La verificación de los requisitos del producto, como se indica anteriormente, muestra que el producto hace lo que dijimos que haría.
La verificación de las especificaciones de diseño, que mostraremos a continuación, muestra que el producto lo hace de la manera en que dijimos que lo haría.
| Especificación de Diseño | Prueba de Verificación | ||
|---|---|---|---|
| DSpec-0001 | Una turbina que puede generar 40 litros de aire por minuto.conjunto de pruebas | TCase-0009 | : Verifique la generación de aire por turbina a 40 lpm con alimentación de CA o de batería. |
| DSpec-0002 | Un paquete de baterías de iones de litio con capacidad para 100 Amperios / Hora.Prueba de inspección | TCase-0010 | : Verifique que la especificación de compra de la batería muestre que el tipo es de iones de litio. |
| Prueba de análisis TCase-0011 | : Recopile datos de prueba y realice análisis de datos para demostrar que el rendimiento de la batería durante la vida útil de la batería alcanzará o excederá los 100 Amperios Horas. | ||
| DSpec-0003 | El soporte para el soporte de rodadura utiliza una abrazadera de acero con acción de palanca clasificada para 22 lbs.Prueba de inspección | TCase-0012 | : Verifique que la especificación de la pieza sea para una abrazadera de acción de palanca de acero con capacidad de 22 libras o más. |
| DSpec-0004 | La base del soporte es de 22″ de ancho con 5 ruedas. |
TCase-0013 |
Caso de prueba: Mida el diámetro de la base; cuente las ruedas; mida el diámetro de la rueda |
| DSpec-0005 | Las ruedas de soporte tienen un diámetro de 4″. | ||
Esencialmente, en la verificación de diseño, necesitamos demostrar que el producto que construimos es el producto que dijimos que construiríamos.
Cuando se recopilan en un informe V&V, la combinación de los resultados de las pruebas de verificación y validación, junto con la trazabilidad hasta las necesidades del usuario, los requisitos del producto y las especificaciones de diseño, proporciona parte de la evidencia que la FDA requiere al enviar un dispositivo médico para su autorización.
Resumen de validación vs Verificación
Aquí hay un breve resumen, aunque ligeramente simplificado, de las diferencias clave.
|
Design Verification |
Design Validation |
|
Design output is as expected. |
Final design meets user’s needs. |
|
System, subsystem and unit testing. |
System testing. |
|
During development. |
After development. |
|
Test individual module or completed system under any conditions. |
Test conditions per user needs. |
|
Incluye sistema de inspecciones, análisis y pruebas. |
Incluye el ensayo de unidades equivalentes de producción en condiciones de uso real. |
|
Incluye informes de las pruebas realizadas, los resultados de las pruebas y la trazabilidad. Los informes son revisados, aprobados y firmados. |
Incluye el informe final, con los resultados de las pruebas y la trazabilidad, listo para la revisión reglamentaria. Los informes son revisados, aprobados y firmados. |
Fundamentos del proceso de validación del diseño
El proceso de validación del diseño consistirá en gran medida en probar el dispositivo. Puede llevar a cabo esto de varias maneras, dependiendo de las circunstancias. Las actividades pueden incluir:
- Comparar con equipos similares que funcionan para fines similares.
- Simulación de funcionalidad a través del modelado matemático.
- Probando el diseño final para probar que el sistema funciona según lo definido en las necesidades del usuario.
El plan de pruebas, los casos de prueba, los registros de ejecución de pruebas y los resultados de las pruebas deben documentarse y mantenerse como parte de los registros de diseño. La validación, en su totalidad, no es el resultado de una sola actividad, sino la recopilación de resultados de todas las actividades de validación.
Fundamentos del Proceso de verificación de diseño
La verificación se puede reducir a un proceso simple de cinco pasos.
Identificar y preparar
Identificar el mejor enfoque para llevar a cabo la verificación. Defina lo que va a medir y cómo lo va a medir. También querrá considerar los recursos, la mano de obra y las herramientas necesarios para una verificación exitosa.
Planificación
La planificación para la verificación se lleva a cabo durante todo el ciclo de vida del proyecto. Desarrollarás el plan de prueba, que captura hitos críticos. El plan debe actualizarse cada vez que se realicen cambios en las entradas de diseño.
Desarrollo de
¡Comienza el desarrollo de productos! Se lleva a cabo utilizando la metodología de elección (Scrum, Cascada, híbrido, etc.). Esta parte del proceso también incluye la escritura, la prueba de manejo y la aprobación de los casos de prueba que se utilizarán para la verificación.
Ejecutar los procedimientos de prueba
se ejecutan según lo previsto. Los resultados no válidos se documentan y revisan, y se aceptan o registran como defectos. Los defectos en el producto se resuelven y liberan, y se realizan pruebas de regresión. Se crea una matriz de trazabilidad para verificar que las entradas de diseño identificadas en el plan de pruebas de verificación se han probado y aprobado.
La presentación de informes
se realiza al final de cada fase de verificación. Los informes detallados incluyen la gestión de la configuración y los informes de versiones, los resultados de las pruebas por tipo de prueba o versión del producto y los problemas encontrados durante la actividad de verificación. Un informe de trazabilidad de verificación de diseño muestra los resultados de las pruebas y la cobertura de los requisitos. Finalmente, las revisiones se completan y aprueban después de cada actividad de verificación de diseño.
6 Consejos para una mejor Validación & Verificación
Aquí hay consejos para asegurarse de aprovechar al máximo sus actividades de verificación de validación &.
Planifique con anticipación (Y Realice la Prueba con anticipación)
Tenga un plan sólido por adelantado y haga que todos participen. Incluya ingenieros de pruebas en las primeras etapas de la planificación del desarrollo para asegurarse de que los requisitos y el diseño sean claros, completos y comprobables. Megan dice: «El desarrollo temprano de métodos de prueba puede arrojar luz sobre los problemas tecnológicos antes de que se conviertan en obstáculos importantes.»El desarrollo temprano de pruebas también puede proporcionar herramientas de prueba. Estos se pueden utilizar para acelerar el proceso de desarrollo del producto, así como para proporcionar pruebas durante las pruebas formales.
Usar nomenclatura compartida
Conseguir que tu equipo esté en la misma página es fundamental para una validación de diseño exitosa & verificación. Parte de estar en la misma página significa usar una terminología compartida. Usar los mismos términos elimina la confusión para los miembros del equipo (no solo para los nuevos miembros, sino también para los veteranos). Consulte el glosario de términos y acrónimos comunes a continuación para ayudar a desarrollar su base de terminología.
Use herramientas con trazabilidad de extremo a extremo
En su forma más simple, la trazabilidad se puede lograr con documentos de Word y hojas de cálculo, pero generan tanto trabajo manual (y son tan propensos a errores) que deseará comenzar con una herramienta dedicada.
» Una matriz de trazas precisa es invaluable al hacer análisis de regresión para determinar qué se debe volver a probar después de un cambio de producto o una corrección de errores.»- Megan Martin, V& V Consultant
El uso de una herramienta con una sólida capacidad de rastreo de requisitos, pruebas y resultados le ayudará a identificar agujeros en la cobertura y a dar advertencias tempranas en áreas frágiles o no probadas en el producto.
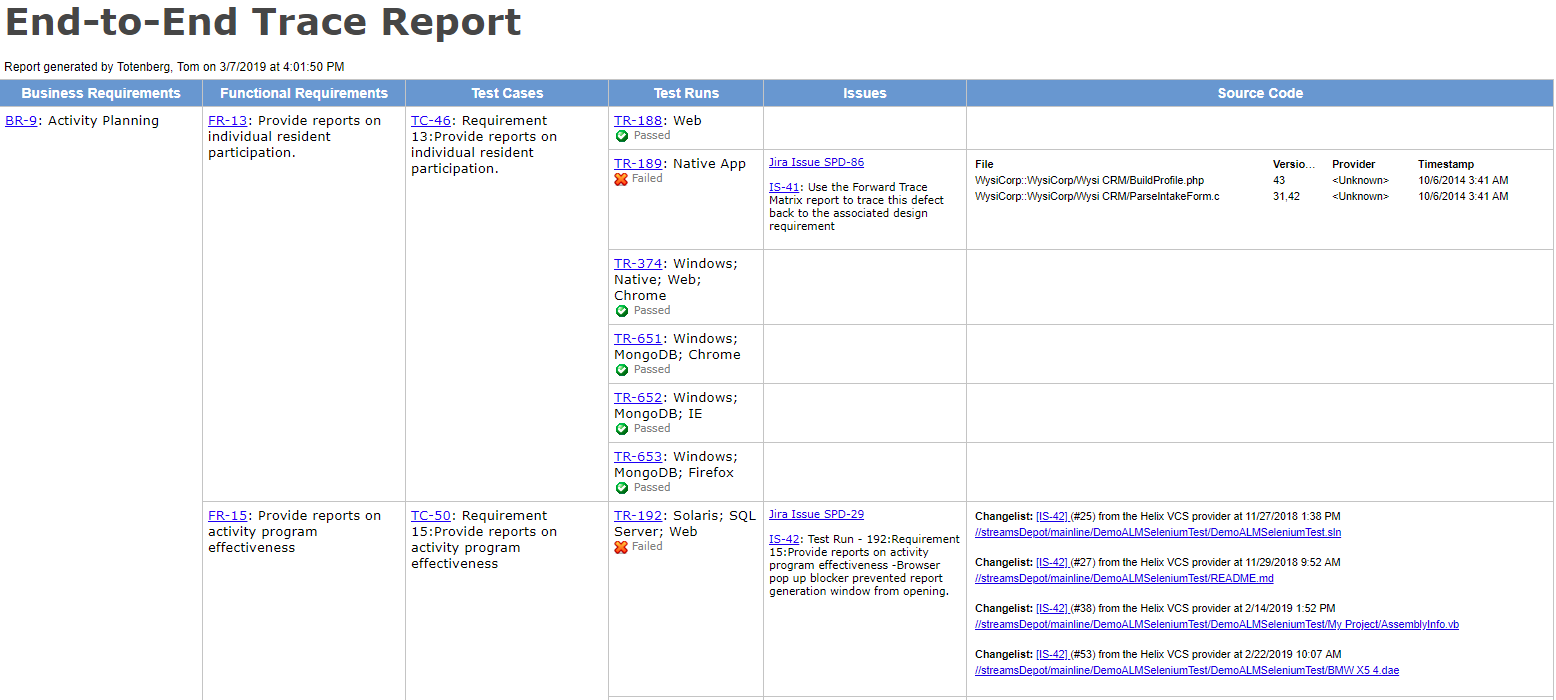
Obtenga trazabilidad de extremo a extremo ahora
Construya Su Matriz de trazas A medida que avanza
«Puede ser tentador posponerla, pero no espere para construir su matriz de trazas!»dice Megan. Construir su trazabilidad a medida que avanza evitará que los agujeros se desarrollen desapercibidos. Pocas cosas son más difíciles de recuperar que descubrir que ha perdido requisitos críticos, características de mitigación de riesgos o pruebas esenciales justo cuando cree que su trabajo de desarrollo está completo.
Se necesita mucho menos esfuerzo de mantenimiento para mantener la trazabilidad a medida que evolucionan sus requisitos, diseños y pruebas que para reparar agujeros críticos en el diseño y el desarrollo en la hora 11. Este esfuerzo también puede ayudarlo a identificar cuánto trabajo queda, dónde podría necesitar agregar personal de desarrollo o pruebas, o cuándo debería reevaluar los horarios de entrega.
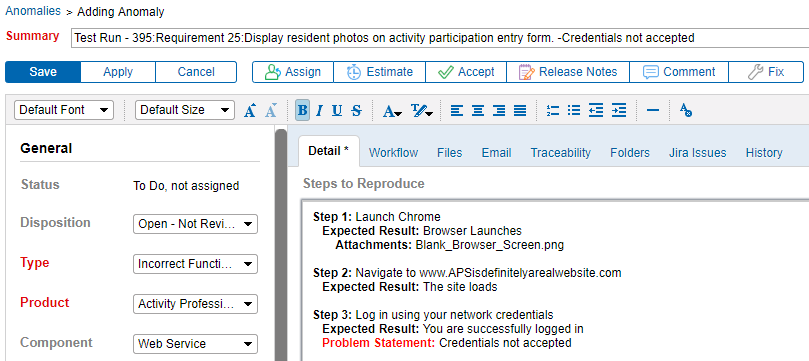
Integrar Trazabilidad de requisitos & Realizar pruebas con Seguimiento de anomalías
Poder vincular anomalías directamente a un requisito mejora la comunicación entre los evaluadores y los desarrolladores. Es extremadamente útil. Generar anomalías directamente a partir de un fallo del protocolo de prueba significa que se capturan más detalles sobre el problema. Como resultado, los problemas se pueden documentar, reproducir, corregir y volver a probar más fácilmente.
Elija Herramientas Que Puede Personalizar según Su Método
«Cualquiera que sea el modelo de desarrollo que haya seleccionado, Ágil, iterativo, Cascada modificada, desea elegir V& Herramientas V que le sirvan adaptándose a su proceso, en lugar de obligarle a adaptar su proceso para servir a la herramienta», aconseja Megan.
Las herramientas de desarrollo de dispositivos médicos que elija deben aumentar la precisión y la eficacia del trabajo que realiza su equipo, y no agregar gastos generales innecesarios a sus tareas diarias. Una buena herramienta proporciona barandillas para garantizar que las cosas importantes siempre se hagan. Le da flexibilidad a su equipo para producir vistas e informes ad hoc para usar (y explorar) mejor los datos que ha capturado. Proporciona V&V captura y generación de informes de datos específicos para que la producción de informes sea simple y repetible.
Tómese el tiempo para definir cómo desea que las herramientas apoyen a su equipo antes de elegir. Luego, configure sus herramientas según las necesidades de su equipo.
Reunir todo
La validación y verificación del diseño son componentes esenciales para el desarrollo exitoso del dispositivo. Con la comprensión compartida entre el equipo, así como las herramientas adecuadas, tiene un marco sólido para llevar su dispositivo al mercado.
VER LA DEMOSTRACIÓN de TODO AHORA >>
Simplificar V&V Con Hélice ALM
Ver cómo Hélice ALM puede acelerar el desarrollo de dispositivos médicos.
Explore Helix ALM
*De nuevo, gracias a la experta Megan Martin de V & V que proporcionó información invaluable a este blog!
V& V: Glosario de términos
Resultado real: Lo que hace un sistema cuando se realiza una acción.
Anomalía – Cuando un sistema no actúa como se espera. Por ejemplo, un error, error o fallo de prueba.
Entregable-Un objeto obligatorio producido como resultado de la ejecución del proyecto, generalmente documentos en esfuerzos de validación.Desviación
: Cuando un proceso o procedimiento no se puede ejecutar según lo definido y se utiliza un método o material alternativo.
Resultado esperado: Lo que debe hacer un sistema cuando se realiza una acción.
Prueba de integración: Prueba realizada utilizando dos o más subsistemas para verificar la interacción y las interdependencias de los subsistemas.Protocolo
: Una colección de casos de prueba utilizados para documentar las pruebas del sistema.Calificación
: Un protocolo de prueba que designa que un sistema cumple con una colección definida de requisitos.
Garantía de calidad: Miembros del equipo encargados de garantizar la calidad del producto o la integridad del proceso.
Requisito: Algo que un sistema debe ser capaz de hacer.
Validación Retrospectiva – Validación de un sistema que ya existe.Especificación
: Documento que describe los requisitos de un sistema o componente.Ensayo de subsistema
: Ensayo realizado en un subsistema o grupo de componentes principales.
Sistema: La cosa que se está validando.
Propietario del sistema: El individuo que es responsable en última instancia de un sistema.
Prueba del sistema-Pruebas realizadas utilizando el sistema en su conjunto.Caso de prueba
– Un procedimiento documentado, utilizado para probar que un sistema cumple con un requisito o una colección de requisitos.Plan de pruebas
: Metodología de pruebas establecida para garantizar que un sistema cumpla con los requisitos. Paso de prueba
: Una línea individual de un caso de prueba. Debe incluir instrucciones, resultado esperado y resultado real.
Trazabilidad: la capacidad de garantizar que se hayan probado los requisitos descritos en las especificaciones. A menudo se captura en una matriz de trazabilidad de requisitos. Prueba unitaria
– Pruebas realizadas en una unidad de software o hardware o en un módulo de bajo nivel.Validación
: Establecer mediante pruebas objetivas que las especificaciones de los dispositivos se ajustan a las necesidades del usuario y al uso o usos previstos.
Paquete de validación-Una colección de documentos producidos durante un proyecto de validación.Verificación: confirmación mediante examen y presentación de pruebas objetivas de que se han cumplido los requisitos especificados.
V& Plan V-Un plan que define los requisitos que deben verificarse y validarse, y la mano de obra, las personas responsables, las herramientas, los métodos, los recursos y el cronograma para el esfuerzo V&V.
Acrónimos comunes de Validación de Diseño
CC – Control de cambios
Tablero de Control de Cambios CCB (un grupo de individuos que controlan qué cambios se realizan y cuándo)
DS – Especificación de diseño
FAT – Prueba de Aceptación de fábrica
FS – Especificación Funcional
FRS – Especificación de Requisitos Funcionales (Consulte Especificación Funcional)
GCP – Buenas Prácticas Clínicas (directrices de calidad para operaciones clínicas)
/p>
BPL – Buenas Prácticas de Laboratorio (directrices de calidad para operaciones de laboratorio farmacéutico)
BPF – Buena fabricación Práctica (pautas de calidad para la fabricación de dispositivos o productos farmacéuticos)
Matriz de Trazabilidad de Requisitos RTM
SAD – Documento de Arquitectura de Software o Documento de Arquitectura de Sistema
Prueba de Aceptación de SAT – Sitio
SCCB – Tablero de Control de Cambios de Software (igual que CCB, pero para software)
SDD – Documento de Diseño Detallado de Software
SDS – Especificación de Diseño de Software
TM – Matriz de trazabilidad
UAT – Prueba de Aceptación del usuario
URS – Requisito del usuario Specification
UUT – Unit Under Test
VMP – Validation Master Plan
VP – Validation Plan
V&V – Verification and Validation