- Johdanto
- materiaalit ja menetelmät
- instrumentaalinen analyysi
- Mikrobiviljelmät
- Väliainevalmiste
- Drostanolone Enanthate (1): n käyminen C. aphidicola ATCC 28300: n ja F. lini NRRL 2204: n kanssa
- 2α-metyyli-3α,14α,17β-trihydroksi-5α-androstaani (2)
- 2α-metyyli-7α-hydroksi-5α-androstan-3,17-dioni (3)
- 2α-metyyli-3α,17β-dihydroksi-5α-androstaani (4)
- 2-Metyyliandrosta-1,4-dieeni-3,17-dioni (5)
- 2-Metyyliandrosta-11α-hydroksi-1,4-dieeni-3,17-dioni (6)
- 2-Metyyliandrosta-14α-hydroksi-1,4-dieeni-3,17-dioni (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- tulokset ja keskustelu
- rakenteen selvittäminen
- sytotoksisuus HeLa -, PC3 -, H640-ja HCT116-syöpiä ja 3T3-normaaleja solulinjoja vastaan
- rakenne-Aktiivisuussuhde
- johtopäätös
- Tekijäosuudet
- Eturistiriitalausunto
- kiitokset
- Supplementary Material
Johdanto
Mikrobimuutos on yksi tärkeimmistä lähestymistavoista orgaanisten yhdisteiden eri luokkien rakennemuutoksessa. Tätä tekniikkaa on käytetty menestyksekkäästi vihreässä kemiassa, ts. huumeiden löytö-ja kehitysohjelmat, jotka tarjoavat erinomaisen yhdisteiden lähteen ytimen rakenteiden ympärille, minkä jälkeen seulotaan erilaisia biologisia toimintoja. Useissa tapauksissa mikrobimuunnosta on käytetty tärkeänä työkaluna orgaanisten yhdisteiden regio-, chemo-ja stereoselektiivisissä muunnoksissa, joita on vaikea saavuttaa tavanomaisilla menetelmillä (Holland and Weber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmanska et al., 2005; Borges et al., 2009; Choudhary et al., 2011; Ravindran et al., 2012). Steroidien hiilivetyrakenteen inaktiivisuuden vuoksi niitä on usein vaikea johtaa tavanomaisilla synteettisillä menetelmillä. Siksi mikrobimuunnosta käytetään usein steroidien rakennemuutokseen. P450-sytokromientsyymijärjestelmien esiintyminen sienissä tekee kokosoluanalyysistä tehokkaan työkalun stereo-ja regio-spesifiseen hydroksylaatioon (Choudhary et al., 2005a; Tong and Dong, 2009; Kristan and RiŽner, 2012; Baydoun et al., 2014).
Drostanoloni ja sen esterijohdannaiset, kuten drostanolonipropionaatti, drostanolonipentanoaatti ja drostanolonenantaatti (1) ovat anabolis-androgeenisia steroideja (Aas), joita urheilijat käyttävät vahvistamaan lihaksiaan lihomatta. Lisäksi drostanolonilla ja sen esterijohdannaisilla on kyky estää estrogeenin tuotantoa. Drostanolonin propionaattiesteriä käytetään myös rintasyövän hoitoon Masteronin (Chowdhury et al., 1976; Clavel et al., 1982; Marinov ym., 1986; Vardar ym., 2002; Bahrke and Yesalis, 2004).
syöpä on nykyisin tunnustettu merkittäväksi kansanterveydelliseksi haasteeksi. Syövät ovat toiseksi yleisin kuolinsyy Yhdysvalloissa ja kaikkialla maailmassa. Maailman terveysjärjestön WHO: n mukaan syövän esiintyvyys ylittää 6 miljoonaa tapausta vuodessa. Syöpäsoluilla on korkea proliferaatioaste. Ne leviävät nopeasti elävässä järjestelmässä ja voivat selviytyä vahvoja solunsalpaajia ja DNA: ta vahingoittavia aineita vastaan. Samoin sytotoksisilla lääkkeillä on monia haitallisia vaikutuksia normaaleihin soluihin, ja siksi niiden käyttö syövän solunsalpaajahoidossa on terapeuttinen haaste. Tämän vuoksi turvallisten, tehokkaiden ja selektiivisten kemoterapia-aineiden kehittämistä tarvitaan kiireellisesti eri syöpiä vastaan (Munoz-Pinedo et al., 2012; Su et al., 2015; Swadogo et al., 2015; Rebecca et al., 2016).
rintasyöpä on yksi yleisimmistä syövistä 140 maailman maassa. Se on merkittävä syy syöpään liittyvän kuoleman naisilla kaikkialla maailmassa, ominaista epänormaali kasvu solujen rintojen lobules tai kanavat korkea proliferaatio (Hanahan and Weinberg, 2000; Ferlay et al., 2015).
kohdunkaulan syöpä on kautta maailman toiseksi yleisin naisten syöpä rintasyövän jälkeen. Kohdunkaulan syövän pääsyy on pahanlaatuisten solujen muodostuminen kohdunkaulan kudoksissa (Wang et al., 2013; Hafiza and Latifah, 2014; Pariente et al., 2016). Ihmisen kohdunkaulan syöpäsoluista saatu HeLa-syöpäsolulinja on yleinen solumalli, jolla arvioidaan testiyhdisteiden sytotoksisuutta.
eturauhassyöpä on maailmanlaajuisesti miesten toiseksi yleisin syöpä keuhkoputken syövän jälkeen ja kolmanneksi yleisin syöpäkuoleman aiheuttaja. Se on yleisin syy maligniteettiin miehillä. Sen esiintyvyys kasvaa iän myötä, yleisempää yli 50 vuoden iässä (Henry and Omahony, 1999; De-Bono et al., 2010; Wenbin et al., 2015). Miehen eturauhassyöpäsoluista saatu PC-3-syöpäsolulinja on laajalti käytetty malli testiyhdisteiden myrkyllisyyden tutkimiseen.
keuhkosyöpä on erittäin yleinen syöpä miesten keskuudessa Yhdysvalloissa 1950-luvun puolivälistä ja naisten keskuudessa 1980-luvun lopulta lähtien. Keuhkosyöpä johtuu useimmiten tupakoinnista (Travis et al., 2002; Villanti et al., 2013; Mishra et al., 2016). H460 syöpäsolulinjaa, joka on saatu ihmisen keuhkosyöpäsoluista (ihmisen suurisoluisen keuhkosyövän lymfogeeninen metastaattinen alalinja), käytetään usein testiyhdisteiden sytotoksisuuden arviointiin.
rinta -, keuhko-ja eturauhassyöpien jälkeen paksusuolen syöpä on neljänneksi yleisin syöpä koko maailmassa. Se on syöpä löytyy suunnilleen yhtä usein miehillä ja naisilla. Se on toiseksi yleisin syöpäkuolemien aiheuttaja länsimaissa (Levin ym., 2008; Andre et al., 2009; Ahearn et al., 2012). Ihmisen paksusuolen syöpäsoluista saatavaa hct116-syöpäsolulinjaa käytetään yleisesti testiyhdisteiden sytotoksisuuden arviointiin.
jatkotutkimuksissamme bioaktiivisten steroidien sienimuunnoksesta (Choudhary et al., 2005b, c, 2007, 2010; Ahmad et al., 2014; Siddiqui et al., 2017) syntetisoimme analogeja drostanolone enanthate (1) kautta sen muutoksen Cephalosporium aphidicola ja Fusarium lini. Metaboliitit 2-9 ja substraatti 1 arvioitiin HeLa-(kohdunkaulan karsinooma), PC-3-(eturauhassyöpä), h460 – (keuhkosyöpä), hct116 – (paksusuolisyöpä) ja 3T3 – (hiiren fibroblasti normaali) solulinjoja vastaan käyttämällä suurikapasiteettista solupohjaista määritystä, joka on tehokkain ja kätevin laboratoriomenetelmä, MTT-määritys, jolla ennustetaan maligniteeteissa esiintyvien testiyhdisteiden vaste silloin, kun ne osoittivat spesifisyyttä syöpäsoluja vastaan. Tässä tutkimuksessa on siten tunnistettu drostanoloni-enanthaatin (1) syöpämetaboliitteja lisätutkimuksia varten.
materiaalit ja menetelmät
instrumentaalinen analyysi
ohutkerroskromatografia (TLC) (silikageeli, 20 × 20, 0, 25 mm paksu, Pf254, Merck, Saksa) käytettiin transformaatioasteen ja puhtausasteen määrittämiseen. Metaboliittien alkupuhdistuksessa käytettiin silikageelikolonnikromatografiaa (70-230 mesh, E. Merck, Saksa). Lisäksi metaboliittien loppupuhdistukseen käytettiin valmistavaa käänteisfaasikierrätystä (Jai LC-908W, Japani), joka oli varustettu YMC L-80: llä (4-5 µm, 20-50 mm i.d.). Metaboliittien rakenteet selvitettiin 1H- (400, 500 ja 600 MHz) ja 13c-NMR (100, 125 ja 150 MHz) spektrien avulla, jotka tallennettiin Bruker Avance-NMR-spektrometrillä (Ranska) cd3od -, CD3COCD3-tai DMSO-d6-spektrillä. HREI-MS ja IR spectra suoritettiin JEOL jms-600h (Japani) (kaksitarkenteinen magneettinen sektori massa analysaattori) massaspektrometri (EI, electron impact ionization), ja Bruker vektori 22 FT-IR Spektrofotometri, vastaavasti. Metaboliittien Optiset kiertoliikkeet kirjattiin JASCO P-2000 polarimetrillä (Japani). UV-spektrien tallentamiseen käytettiin Evolution 300 UV-näkyvää spektrofotometriä. Muunnettujen tuotteiden sulamispisteet mitattiin Buchi M-560 (Switzerland) – mittalaitteella. Yksikiteinen Röntgendiffraktiotieto kerättiin bruker APEXII D8 Venture-diffraktometrillä, joka on varustettu fotoni 100-detektorilla (CMOS-Tekniikka) ja hienotarkennusputkella, jossa on Röntgenlähde (Cu Kau-säteily α = 1.54178 Å). Heijastusintensiteetit integroitiin SAINT-ohjelmiston avulla. Absorptiokorjaus tehtiin Moniskannauksella ja rakenne ratkaistiin SHELXTL-ohjelmalla (Gerlier and Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
Mikrobiviljelmät
C. aphidicola ATCC 28300: n ja F. lini NRRL 2204: n Mikrobiviljelmät saatiin American Type Culture Collection (ATCC): stä ja Northern Regional Research Laboratories (Nrrl): stä. Viljelmät kasvatettiin Sabouraud dekstroosi agar (SDA)-vinossa, ja niitä pidettiin 4°C: ssa.
Väliainevalmiste
neljä litraa väliainetta C. aphidicola ATCC-28300 valmistettiin sekoittamalla 200 g glukoosia, 4 g KH2PO4: ää, 8 g glysiiniä, 4 g KCl: ää, 8 g MgSO4.7H2O: ta ja 8 mL hivenaineita 4 litraan tislattua vettä. Samoin valmistettiin neljä litraa väliainetta F. lini NRRL 2204: lle sekoittamalla 40 g glukoosia, 20 g hiivauutetta, 20 g peptonia, 20 g KH2PO4: ää, 20 g NaCl: ää ja 40 mL glyserolia 4 litraan tislattua vettä.
Drostanolone Enanthate (1): n käyminen C. aphidicola ATCC 28300: n ja F. lini NRRL 2204: n kanssa
kasvualusta C. aphidicolan ja F. Linin kasvualustaksi valmistettiin sekoittamalla edellä mainitut ainesosat 4 litraan tislattua vettä kutakin sientä kohti, joka sitten annosteltiin tasan 40: een 250 mL: n Erlenmeyer-pulloon (100 mL kussakin pullossa). Kaikki nämä pullot autoklavoitiin 121°C: n lämpötilassa, ja niihin inokuloitiin steriloiduissa olosuhteissa C. aphidicola ATCC 28300: n ja F. lini NRRL 2204: n SDA-vinoilla. Näitä pulloja sisältäviä sieniviljelmiä jätettiin pyörivään ravistelijaan (121 rpm) 26 ± 2°C: n lämpötilassa 3-4 päivän ajan, jotta C. aphidicola-ja F. lini-kasvustot olisivat mahdollisimman suuret. Yhdiste 1 (1 g) liuotettiin 20 mL: aan asetonia kutakin sientä kohti ja annosteltiin 0, 5 mL kuhunkin pulloon ja asetettiin uudelleen pyörivään ravistimeen 12 päiväksi. Myös negatiivinen kontrolli (väliaine + sieniviljelmä) ja positiivinen kontrolli (väliaine + substraatti) valmistettiin vastaavasti yhdisteen 1 sienimetaboliittien ja hajoamisen arvioimiseksi. 12 päivän inkubaation jälkeen kaikki pullot suodatettiin ja uutettiin 20 litralla dikloorimetaania (DCM), orgaaninen faasi erotettiin ja sitten haihdutettiin alennetussa paineessa pyöröhaihduttimella. Näin saatiin 1,5 grammaa vaaleankeltaista kiinteää raakaöljyä. Tämä raaka aine fraktioitiin silikageelikolonnikromatografiassa eluutiolla gradienttiheksaaneilla ja asetoniliuotinjärjestelmillä. Kolonnikromatografiassa saatiin neljä pääfraktiota (1-4), jotka sitten puhdistettiin kierrättämällä HPLC. Metaboliitit 2 (tR = 16 min, 8 mg, 0, 8%), 3 (tR = 19 min, 11 mg, 1, 1%), 4 (tR = 17 min, 35 mg, 3, 5%), 5 (tR = 23 min, 42 mg, 4, 2%), 6 (tR = 20 min, 9 mg, 0, 9%), 7 (tR = 21 min, 12 mg, 1, 2%) ja 9 (tR = 18 min, 5 mg, 0, 5%) puhdistuivat jakeista 1-7 käänteisfaasikierrätyksellä HPLC: llä käyttäen liuottimena metanolivettä (meoh: H2o; 70: 30). Metaboliitti 8 saatiin fraktiosta 8 normaalin faasikierrätyksen HPLC: n avulla (tR = 32 min, CHCl3: MeOH; 95: 5, 7.5 mg, 0, 75%).
2α-metyyli-3α,14α,17β-trihydroksi-5α-androstaani (2)
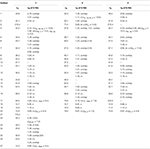
Taulukko 1. 13C-ja 1H-NMR-yhdisteiden kemialliset siirtymätiedot (J ja W1/2 hertseinä) yhdisteistä 1-3 (δ ppm).
2α-metyyli-7α-hydroksi-5α-androstan-3,17-dioni (3)
2α-metyyli-3α,17β-dihydroksi-5α-androstaani (4)
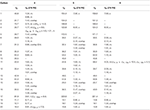
taulukko 2. 13C-ja 1H-NMR-yhdisteiden kemialliset siirtymätiedot (J ja W1/2 hertseinä) yhdisteistä 4-6 (δ ppm).
2-Metyyliandrosta-1,4-dieeni-3,17-dioni (5)
2-Metyyliandrosta-11α-hydroksi-1,4-dieeni-3,17-dioni (6)
2-Metyyliandrosta-14α-hydroksi-1,4-dieeni-3,17-dioni (7)
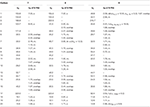
taulukko 3. 13C-ja 1H-NMR-yhdisteiden kemialliset siirtymätiedot (J ja W1/2 hertseinä) 7-9 (δ ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Solulinjat kasvatettiin dmem F12-väliaineessa, jota täydennettiin 10% FBS: llä 5% CO2-ilmakehän alla 37°C: n lämpötilassa inkubaattorissa.
kolorimetristä määritystä MTT käytettiin solujen metabolisen aktiivisuuden arviointiin. Tässä määrityksessä keltainen MTT pelkistyy violetiksi formatsoniksi elävien solujen mitokondrioissa (Gerlier and Thomasset, 1986). Mitä enemmän eläviä soluja, sitä enemmän väriä ja siten enemmän absorbanssia havaitaan kolorimetrillä (Fesahat et al., 2015). Olemme käyttäneet tätä menetelmää analysoidaksemme muuntuneiden tuotteidemme vaikutusta solujen sytotoksisuuteen syöpäsoluja vastaan. Noin 10 000 solua kustakin solulinjasta (HeLa, PC3, H460, HCT116-syövät ja 3T3 normaali) kylvettiin 96-kuoppalevyille. Saavutettuaan 80-90% konfluenssia niitä käsiteltiin erilaisilla pitoisuuksilla yhdisteitä (25, 50, 75, 100 ja 200 µM) 24 tunnin ajan. kaikki yhdisteet liuotettiin steriiliin DMSO: han 200 mM: n kantaliuokseksi. Liuos suodatettiin ja sarjalaimennoksia tehtiin kasvualustassa. Kutakin laimennosta käytettiin 600 µL 3 kuopan (kunkin kolminkertainen määrä) käsittelyyn 96 kuoppalevyllä eli 200 µL kullakin. Jokaisessa kokeessa tehtiin kolme biologista toisintoa. MTT lisättiin ja inkuboitiin 4 tuntia.MTT: n poistamisen jälkeen violetit formatsonikiteet liuotettiin DMSO: han, ja lukema havaittiin 540 nm: ssä normaaleille soluille ja 570 nm: ssä syöpäsoluille. Multiskan-lukija antaa λmax 540 nm: ssä DMSO: lla käsitellyissä 3T3 fibroblastisoluissa (jotka ovat morfologialtaan konfluenttisempia), kun taas syöpäsolujen tapauksessa 570 nm antaa λmax: n (Bonmati-Carrion et al., 2013; Danihelová et al., 2013). Tässä kokeessa käytettiin laajaa valikoimaa epiteelikarsinooman solulinjoja, joissa sisplatiini oli yleinen valittu lääkeaine. Se kohdistuu DNA: han, häiritsee solujen jakautumista mitoosin aikana ja aiheuttaa apoptoosin (Eastman, 1999). IC50-arvot laskettiin määritettäessä vähimmäispitoisuutta, joka tarvitaan 50%: n solujen tappamiseen.
kun taas
at = Testiyhdisteen Absorbanssiarvo
Ab = nollan Absorbanssiarvo
Ac = kontrollin Absorbanssiarvo
tulokset ja keskustelu
rakenteen selvittäminen
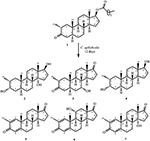
kuva 1. Drostanoloni-enantaatin (1) biotransformaatio Cephalosporium aphidicolan kanssa.
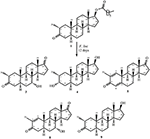
kuva 2. Drostanoloni-enantaatin (1) biotransformaatio Fusarium Linin kanssa.
metaboliitti 2 eristettiin valkoisina kiteinä. Molekyylikaava C20H30O3 perustui hrei-MS: ään, jonka osoittama at M/z 322.2517 (kalsd. 322.2508, C20H34O3), mikä viittaa kolmen vedyn ja happiatomin lisäämiseen, C-3 ketonikarbonyylin pelkistämiseen ja heptanoaatin sivuketjun hydrolyyttiseen pilkkoutumiseen substraatissa 1. IR-absorbanssi 3 531 ja 3 423 cm-1 johtui hydroksyyliryhmistä. 1h-NMR-spektrissä näkyi ylimääräinen metiiniprotonisignaali δ 3.69: ssä (Taulukko 1) (datalehti 2). Heptanoaatin sivuketjun signaalit puuttuivat myös yhdisteen 2 1h-NMR-spektristä. 13C-NMR-spektri osoitti signaalit uudelle metiinihiilelle arvolla δ 71,4 ja uudelle kvaternaarihiilelle arvolla δ 84,8. Myös heptanoaattiketjun ja ketonikarbonyylin hiilisignaalit puuttuivat 13C-NMR-spektristä. Tämä viittasi C-3 karbonyylin vähenemiseen, heptanoaattiketjun hydrolyyttiseen häviöön ja OH: n lisäämiseen c-14: ssä (Taulukko 1). OH-ryhmä sijoitettiin C-3: een H3-20: n (δ 0, 91, d) ja C-3: n (δ 71, 4) hmbc-korrelaatioiden perusteella (kuva 3). Tämä johtui C-3 karbonyylin pelkistymisestä. Toinen OH-ryhmä sijoitettiin c-14: ään H3-18: n (δ 0, 81, s) ja C-14: n (δ 84, 8) hmbc-korrelaation perusteella. Kolmas OH oli C-17: ssä, joka johtui heptanoaattiosion hydrolyyttisestä menetyksestä. O-h-ryhmä C-3: ssa pääteltiin α-orientoituneeksi H-3: n (δ 3.69, br. s) β-orientoituneella H-2: lla (δ 1.64, limitys) ja α-orientoituneella H3-20: llä (δ 0.91, d) (kuva 4). Oh-14 pääteltiin α-orientoituneeksi h-9: n (δ 1,32, m) ja OH-14: n (δ 2,66, s) (asetoni-d6) noesy-korrelaatioiden perusteella. Yksikiteinen Röntgendiffraktioanalyysi tuki edelleen metaboliitti 2: n rakennetta, joka koostuu kolmesta tuolin konformaatiossa olevasta renkaasta (A, B ja C) ja yhdestä vaipassa olevasta konformaatiosta (D). Kolmelle Oh-ryhmälle C-3, C-14 ja c-17 osoitettiin α -, α-Ja β-orientaatio (kuva 5). Metaboliitin 2 yksikidefraktiotiedot toimitettiin Cambridgen Kristallografiseen tiedonkeruuseen (CCDC 1500706). Metaboliitin 2 rakenteesta pääteltiin siten 2α-metyyli-3α,14α,17β-trihydroksi-5α-androstaani.
kuva 3. Avain HMBC ( ) ja COSY (
) ja COSY ( ) korrelaatiot uusissa metaboliiteissa.
) korrelaatiot uusissa metaboliiteissa.
kuva 4. Uusien metaboliittien Keskeiset NOESY-korrelaatiot.
metaboliitti 3 saatiin valkoisena kiinteänä aineena. Hrei-MS näytti at M / z 318.2192 (calcd. 318, 2195, C20H30O3). Tämä edusti heptanoaatin sivuketjun häviämistä ja happiatomin lisäämistä substraattiin 1. IR-spektri osoitti OH: n (3 436 cm−1) ja ketonikarbonyylien (1 711 cm−1) absorbanssit. 1h-NMR-spektristä heptanoaattiketjun ja C-17 metiiniprotonin signaalit puuttuivat, kun taas Uusi alakentän metiiniprotonisignaali havaittiin arvolla δ 3.92 (Taulukko 1) (tietolomake 3). Tämä viittasi steroideihin kuuluvan luurangon hydroksylaatioon ja heptanoaattiosan oksidatiiviseen pilkkoutumiseen. Myös 13C-NMR-spektri tuki edellä mainittuja päätelmiä. Heptanoaattiosion hiilisignaalit puuttuivat, kun taas 13C-NMR-spektriin ilmestyi uusi ketonikarbonyyli-ja oksimetiinisignaali (Taulukko 1). Tämä viittasi heptanoaattiketjun oksidatiiviseen pilkkoutumiseen ja hydroksylaatioon substraatissa 1. Vasta ilmaantunut metiiniprotoni δ 3.92 (H-7) osoitti HMBC-korrelaatioita C-5: n ja C-8: n kanssa, mikä viittaa OH: n syntymiseen c-7: ssä (kuva 3). H3-18: n ja H2-16: n hmbc: n korrelaatiot hiileen δ 223.8: ssa viittasivat ketoniseen hiileen C-17: ssä. OH at c-7: ää tukivat edelleen H-7: n COSY-korrelaatiot H2-6: n ja H-8: n kanssa. H-7 (δ 3.92, s) osoitti noesy-korrelaatioita aksiaalisesti orientoituneen h-8: n kanssa (δ 1.70, limitys), mikä viittasi OH: n α-orientaatioon c-7: ssä (kuva 4). Näin metaboliitin 3 rakenteeksi pääteltiin 2α-metyyli-7α-hydroksi-5α-androstan-3,17-dioni.
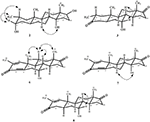
yksikiteisiä Röntgendiffraktioanalyysejä tehtiin myös yhdisteille 1 ja 5. Yhdiste 1 koostui neljästä renkaasta eli, A, B, C ja D tuoli, tuoli, tuoli ja kirjekuori konformaatioita. C-2: ssa oli metyyli, jolla oli ekvatoriaalinen suunta. Heptanoaattiesteriketju esiintyi D-renkaan C-17: ssä (kuva 6). Kun taas metaboliitti 5 sisältää renkaita A, B, C ja D höylässä, tuolissa, tuolissa ja vaipassa. Heptanoaatin sivuketju puuttui metaboliitista 5 (kuva 7). Metaboliittien 1 ja 5 yksikidefraktiotiedot toimitettiin Cambridgen Kristallografiseen tiedonkeruuseen (CCDC 1500705 ja CCDC 1500707). Yksikiteisen Röntgendiffraktioanalyysin tiedot yhdisteistä 1, 2 ja 5 on esitetty taulukossa 4.
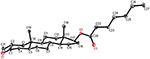
kuva 6. Tietokoneella luotu ORTEP-piirros yhdisteen lopullisesta Röntgenmallista 1. Värikoodit: hiili, musta; happi, punainen.
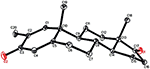
kuva 7. Tietokoneella luotu ORTEP-piirros yhdisteen lopullisesta Röntgenmallista 5. Värikoodit: hiili, musta; happi, punainen.

Taulukko 4. Yksikiteinen Röntgendiffraktioanalyysi yhdisteistä 1, 2 ja 5.
sytotoksisuus HeLa -, PC3 -, H640-ja HCT116-syöpiä ja 3T3-normaaleja solulinjoja vastaan
luonnontuotteet, kuten flavonoidit, steroidit, terpeenit jne. voi toimia erinomaisena lähteenä monien lääkkeiden tuotannolle, koska ne on raportoitu monista biologisista toiminnoista, kuten syövän, anti-inflammatoristen, anti-leishmaniaalisten, anti-bakteerien toiminnasta jne. Siksi ne on johdettava, jotta voidaan tutkia rakenne-aktiivisuussuhdetta, joka voi olla hyödyllinen turvallisten ja tehokkaiden lääkkeiden synteesiin. Tällä hetkellä monet lääkevalmisteet syntetisoidaan tehokkaasti mikrobien biotransformaation kautta, koska niissä on useita entsyymejä. Drostanolonin (9), drostanolonipropionaatin ja drostanoloniheptanoaatin (1) raportoidun syöpäaktiivisuuden perusteella yhdisteiden 1-9 sytotoksisuutta HeLa -, PC-3 -, H460-ja HCT116-syöpäsolulinjoja vastaan arvioitiin. Mielenkiintoista on, että kaikki yhdisteet osoittivat kohtalaista tai voimakasta syövän vastaista aktiivisuutta. Yhdisteiden 1-9 syöpäaktiivisuus on päätelty IC50-arvoista HeLa: ta (ihmisen kohdunkaulan syöpä), PC-3: a (ihmisen eturauhassyöpä), h460: tä (ihmisen keuhkosyöpä) ja HCT116: ta (ihmisen paksusuolen syöpä) vastaan (Taulukko 5). Näiden tulosten perusteella näiden yhdisteiden sytotoksisuutta arvioitiin myös 3T3: n (hiiren fibroblasti) normaalista solulinjasta, jossa kaikki yhdisteet, paitsi 8 (IC50 = 74, 6 ± 3, 7 µM) ja 9 (IC50 = 62, 1 ± 1, 2 µM), todettiin ei-sytotoksisiksi.

Taulukko 5. Yhdisteiden 1-9 sytotoksisuus HeLa -, PC3 -, H460-ja HCT116-syöpää sekä 3T3-normaaleja solulinjoja vastaan.
rakenne-Aktiivisuussuhde
muutokset metaboliittien rakenteissa vaikuttivat niiden syöpäaktiivisuuteen. Metaboliitti 2, jossa esteriosaa ei ole, ja kaksi ao-H-ryhmää C-3: ssa ja C-14: ssä sekä ßO-H-ryhmä C-17: ssä osoittivat pienemmän sytotoksisuuden HeLa -, H460-ja HCT116-syöpäsolulinjoja vastaan, mutta sen syövän vastainen aktiivisuus oli suurempi PC-3-syöpäsolulinjaa vastaan yhdisteeseen 1 verrattuna. Metaboliitti 3, jossa esteriryhmä ja kaksi ketoryhmää C-3: ssa ja C-17: ssä, ja aO-H-ryhmä C-7: ssä, osoittivat myös vähäisempää aktiivisuutta HeLa -, H460-ja HCT116-syöpäsolulinjoja vastaan, mutta lisääntynyt aktiivisuus PC-3-syöpäsolulinjaa vastaan verrattuna substraattiin 1. C-3 karbonyylin pelkistyminen O-H: ksi ja esteriosan hydrolyyttinen pilkkominen yhdisteessä 4 lisäsi sen aktiivisuutta sekä HeLa-että PC-3-syöpäsolulinjoja vastaan jonkin verran, mutta sen syöpälääkitys H460-ja HCT116-syöpäsolulinjoja vastaan väheni verrattuna substraattiin 1. C = C: n esiintyminen C-1/C-2: n ja C-4/C-5: n välillä yhdessä C = O: n kanssa C-3: ssa ja C-17: ssä teki metaboliitista 5 voimakkaan syöpälääkkeen HeLa-syöpäsolulinjaa vastaan verrattuna substraattiin 1 ja standardilääkkeeseen (sisplatiini). Lisäksi sen syövänvastainen aktiivisuus PC-3 syöpäsolulinjaa vastaan oli myös lisääntynyt verrattuna substraattiin 1. Mielenkiintoista on, että sen syöpälääkitys h460-ja HCT116-syöpäsolulinjoja vastaan oli pienempi verrattuna yhdisteeseen 1. C = C: n esiintyminen C-1/C-2: n ja C-4/C-5: n välillä, c = O c-3: n ja C-17: n välillä sekä ao-h-ryhmän C-11: n esiintyminen metaboliitissa 6 lisäsi sen syöpälääkitystä HeLa: ta ja PC-3: n syöpäsolulinjoja vastaan verrattuna substraattiin 1 ja osoitti samanlaista syöpälääkitystä HeLa: n syöpäsolulinjaa vastaan kuin tavallinen lääke (sisplatiini). Sen syöpälääkitys H460-ja HCT116-syöpäsolulinjoja vastaan kuitenkin väheni yhdisteeseen 1 verrattuna. C = C: n esiintyminen C-1/C-2: n ja C-4/C-5: n välillä, c = O c-3: n ja C-17: n välillä sekä ao-h-ryhmän C-14: n esiintyminen metaboliitissa 7 lisäsi jälleen sen syöpälääkitystä HeLa: ta ja PC-3: n syöpäsolulinjoja vastaan ja vähensi sen syöpälääkitystä h460: tä ja HCT116: n solulinjoja vastaan verrattuna substraattiin 1. C = C C: n esiintyminen C-1/C-2: ssa, C = O C-3: ssa ja C-17: ssä ja aOH c-7: ssä tekivät metaboliitista 8 voimakkaimman syövän HeLa-syöpäsolulinjaa vastaan verrattuna substraattiin 1 ja standardilääkkeeseen (sisplatiini). Se osoitti myös hyvää aktiivisuutta PC-3 syöpäsolulinjaa vastaan, mutta vähensi syövän vastaista aktiivisuutta H460-ja HCT116-syöpäsolulinjoja vastaan verrattuna substraattiin 1. Metaboliitti 9, jonka hydrolyysi tapahtui vain C-17: ssä, osoitti lisääntynyttä syöpälääkitystä HeLa -, PC-3-ja HCT116-syöpäsolulinjoja vastaan, mutta vähensi sytotoksisuutta H460-syöpäsolulinjaa vastaan verrattuna substraatti 1: een ja standardilääkkeeseen (sisplatiini). Edellä esitetyn perusteella voidaan päätellä, että yhdisteiden 5-8 lisääntynyt syöpäaktiivisuus HeLa: ta ja PC-3: n syöpäsolulinjoja vastaan johtui todennäköisesti C = C: n esiintymisestä C-1/C-2: ssa ja karbonyyliketonin esiintymisestä C-3: ssa ja C-17: ssä verrattuna substraattiin 1.
johtopäätös
Tekijäosuudet
esitetyn tutkimuksen käsitteen kehitti ja suunnitteli MIC. MIC toimi myös projektin valvojana. Kaikki tiedot analysoitiin ja tulkittiin MIC, a-t-W, ja HC. MS, SY, MA ja NF suorittivat kokeet. Mic, A-t-W ja MS kirjoittivat käsikirjoituksen. Kaikki kirjoittajat tarkistivat käsikirjoituksen. Mic hyväksyi myös lopullisen version käsikirjoituksesta ennen sen toimittamista.
Eturistiriitalausunto
kirjoittajat toteavat, että tutkimus tehtiin ilman kaupallisia tai taloudellisia suhteita, joita voitaisiin pitää mahdollisena eturistiriitana.
kiitokset
a-t-W ja MIC tunnustavat Islamabadissa, Pakistanissa sijaitsevan Higher Education Commissionin mahdollistavan aseman myöntämällä rahoitustukea ”Studies on the Chemoprevention of Mammard Carcinogenesis by Dietary Agents, (20-3790/NRPU/r&D/HEC/13 / 793).”SY tunnustaa taloudellisen tuen OPCW (Organization for the Prohibition of Chemical Weapons) kautta tutkimushanke otsikolla ”Structural and biological studies on new anabolic steroids obtained by biotransformation.”HC tunnustaa taloudellisen tuen” Deanship of Scientific Research (DSR), kuningas Abdulaziz University, Opetusministeriö, Saudi-Arabia.”
Supplementary Material
Eastman, A. (1999). ”Sisplatiinin vaikutusmekanismi: addukteista apoptoosiin” Sisplatiinilla: Chemistry and Biochemistry of a Leading Anticancer Drug, ed B. Lippert (Zürich: Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002/9783906390420.ch4
CrossRef Full Text/Google Scholar
Vardar, E., Vardar, S. A., and Cengiz, T. (2002). Anabolinen-androgeeni steroidi väärinkäyttö. Anato. J. Psychiatry 3, 104-107.