- Interaction spécifique à l’hôte Entre le Rhizobium et les Partenaires végétaux
- Développement de nodules déterminé et indéterminé
- La croissance des Cellules Symbiotiques Implique une amplification du génome Hôte par des cycles d’endoréduplication
- Différents destins des Bactérioïdes Fixateurs d’azote
- Les peptides hôtes régissent la différenciation des bactérioïdes
- NCR247 : Un exemple pour l’analyse du Transcriptome de l’Effecteur Hôte Multi-Cibles
- Conclusion
- Déclaration sur les conflits d’intérêts
- Remerciements
Interaction spécifique à l’hôte Entre le Rhizobium et les Partenaires végétaux
Les bactéries qui forment une symbiose fixatrice d’azote avec les plantes légumineuses appartenant à divers groupes de protéobactéries α et β sont collectivement appelées rhizobies (Chen et al., 2003; MacLean et coll., 2007). De nombreuses α-protéobactéries sont engagées dans des interactions à long terme avec des eucaryotes supérieurs. Ces interactions vont de la colonisation de surface aux relations symbiotiques facultatives pour obliger les modes de vie d’agents pathogènes intracellulaires ou d’endosymbiotes. Les gènes symbiotiques nécessaires à la formation de nodules, à l’infection des cellules hôtes et à la fixation de l’azote ont été acquis par transfert latéral de gènes qui est la principale source de diversité génétique de la rhizobie. Par conséquent, la rhizobie pourrait être plus étroitement liée aux agents pathogènes (tels que Agrobacterium ou Brucella) qu’entre eux. Les rhizobies ont tendance à avoir de gros génomes (jusqu’à 10.5 Mbp) qui, chez les rhizobies à croissance rapide, sont dispersées sur plusieurs réplicons (MacLean et al., 2007). Par exemple, Sinorhizobium meliloti, l’endosymbiote de l’espèce Medicago, a un génome à trois parties; un chromosome de 3,65 Mbp et deux mégaplasmides, pSymA et pSymB (1,35 et 1,68 Mbp) qui sont tous deux indispensables et portent la majorité des gènes symbiotiques. Cependant, de nombreuses souches de S. meliloti contiennent d’autres plasmides auxiliaires de taille moyenne et, par conséquent, le génome de S. meliloti peut contenir jusqu’à 9 000 gènes (Barnett et al., 2001; Capela et coll., 2001). Contrairement à la rhizobie, les endosymbiontes obligatoires des insectes possèdent généralement un génome fortement réduit (160-450 Kbp) qui assure leur multiplication et code pour quelques voies biosynthétiques spécifiques, y compris celles qui répondent aux besoins de l’hôte (Moran et al., 2008; Price et coll., 2011). Ces génomes incroyablement réduits sont néanmoins amplifiés compensant le génome diminué avec une teneur en ADN polyploïde.
Les plantes partenaires de rhizobia appartiennent à la famille des Leguminosae/Fabaceae. La symbiose fixatrice d’azote a évolué dans plusieurs lignées, mais toutes les légumineuses ne forment pas une symbiose. Jusqu’à présent, 12 000 espèces de légumineuses nodulées sont connues et chacune a son propre partenaire Rhizobium. La symbiose est déclenchée par la privation d’azote de la plante hôte qui doit sélectionner son partenaire Rhizobium parmi des milliards de bactéries de la rhizosphère. Ceci est réalisé par la sécrétion de molécules de signal flavonoïdes à partir de la racine qui agissent comme chimio-attractants mais surtout comme inducteurs des gènes de nodulation du Rhizobium (Oldroyd, 2013). Ces gènes sont nécessaires à la production de molécules de signaux bactériens; les facteurs Nod (NFs) qui déclenchent le programme de développement des nodules chez la plante hôte (Walker et Downie, 2000). Les NFS sont des molécules lipochitooligosaccharidiques qui portent des substitutions spécifiques de l’hôte sur les résidus de sucre terminaux et les chaînes lipidiques caractéristiques, qui sont reconnues par les récepteurs hôtes de type LysM et sont nécessaires à la fois au développement des nodules et à l’infection bactérienne. Fait intéressant, l’ancienne symbiose des plantes terrestres avec des champignons mycorhiziens arbusculaires (AM) fonctionne avec des molécules de signal lipochitooligosaccharides similaires, les facteurs Myc qui sont perçus par des récepteurs de type LysM similaires mais différents comme les NFs (Abdel-Lateif et al., 2012; Oldroyd, 2013). Les facteurs Myc et NFs activent une voie de signalisation commune mais après l’implication des gènes symbiotiques communs conservés chez les plantes, les voies s’écartent; l’une conduisant à la nodulation, l’autre à la symbiose AM.
L’infection des plantes et la formation de nodules sont des processus complexes; Les facteurs de nod jouent un rôle distinct dans l’organogenèse des nodules et l’infection des poils des racines. De plus, outre les facteurs Nod, divers polysaccharides de surface bactériens sont cruciaux pour une infection efficace (Fraysse et al., 2003). Chez la plupart des légumineuses, la rhizobie pénètre dans l’hôte par les poils racinaires où, par invagination de la membrane plasmique, un fil d’infection (IT) se forme qui contient les bactéries multiplicatrices et se développe vers le cortex racinaire. Un mode d’infection moins fréquent et ancien se produit par des fissures à la surface des racines de certaines légumineuses.
Développement de nodules déterminé et indéterminé
Le développement de nodules nécessite une réactivation mitotique des cellules corticales conduisant à la formation de primordium de nodules qui se différencient ensuite en nodules racinaires fixateurs d’azote fournissant une condition microaérobie dans la zone centrale pour le fonctionnement de l’enzyme nitrogénase sensible à l’oxygène chez les bactérioïdes. Selon la nature transitoire et persistante de la prolifération des cellules hôtes, les nodules peuvent être de type déterminé ou indéterminé (Terpolilli et al., 2012; Kondorosi et coll., 2013). Les nodules déterminés n’ont pas de méristème et contiennent une population homogène de cellules symbiotiques. Des nodules déterminés se développent par exemple sur les racines de Phaseolus vulgaris et de Lotus japonicus.
Au contraire, la division cellulaire active est maintenue dans les nodules indéterminés. Un méristème nodule est présent dans la région apicale (zone I) qui, par la génération constante de nouvelles cellules, provoque une croissance continue et une forme de nodule allongée. Les cellules sortant du méristème ne se divisent plus et entrent dans une phase de différenciation. Le fil d’infection libère les bactéries dans les cellules submeristématiques, qui se différencient progressivement le long des 12 à 15 couches cellulaires de la zone d’infection (zone II), conduisant au développement de cellules symbiotiques fixatrices d’azote dans la zone nodule III (Figure 1; Franssen et al., 1992). Medicago sativa, M. truncatula, Vicia sativa et Pisum sativum sont des exemples de plantes formant des nodules indéterminés.
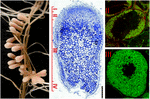
FIGURE 1. Structure des nodules racinaires fixateurs d’azote formés dans la symbiose de S. meliloti-M. truncatula. Les différentes zones nodules sont indiquées sur la section nodule longitudinale : (I) méristème, (II) zone d’infection, (III) zone de fixation de l’azote, (IV) zone de sénescence. Les cellules symbiotiques de la zone II contiennent les endosymbiontes différenciants tandis que dans la zone III, le cytoplasme de l’hôte est entièrement emballé avec de longs bactérioïdes fixateurs d’azote. Les endosymbiontes colorés avec Syto9 ont une fluorescence verte.
La croissance des Cellules Symbiotiques Implique une amplification du génome Hôte par des cycles d’endoréduplication
Un élargissement extrême des cellules végétales peut être observé dans les nodules déterminés et indéterminés. Le cytoplasme d’une cellule symbiotique fixatrice d’azote héberge environ 50 000 bactérioïdes. Pour accueillir un nombre aussi élevé d’endosymbiontes, les cellules hôtes se développent. Chez les nodules de M. truncatula, le volume des cellules fixatrices d’azote est 80 fois plus grand que celui des cellules méristématiques diploïdes. La croissance des cellules infectées se produit par étapes dans la zone II et est la conséquence d’une endoréduplication répétée (ER) du génome sans mitose. Dans la zone II, la machinerie du cycle cellulaire est toujours active mais l’absence de cyclines mitotiques inhibe la mitose et transforme les cycles mitotiques en cycles d’endoréduplication (Cebolla et al., 1999). Ceci est réalisé par la protéine CCS52A de commutation de cycle cellulaire qui, par la destruction des cyclines mitotiques, induit des cycles répétés de duplication du génome conduisant à la formation de cellules polyploïdes en croissance progressive (Roudier et al., 2003; Kondorosi et Kondorosi, 2004). Chez les espèces de Medicago, les niveaux de ploïdie peuvent atteindre 64C, ce qui représente une teneur en ADN 64 fois supérieure à celle des cellules haploïdes (C correspond à la teneur en ADN haploïde; Vinardell et al., 2003). La régulation à la baisse du CCS52A chez M. truncatula n’a eu aucun effet sur la formation du primordium, mais a été préjudiciable à la différenciation des nodules, ce qui indique que les cycles ER et la formation de grandes cellules hautement polyploïdes sont essentiels au fonctionnement des nodules (Vinardell et al., 2003). Fait intéressant, les cellules corticales contenant des champignons AM sont également polyploïdes, ainsi que les cellules racinaires géantes nourrissant les nématodes (Favery et al., 2002; Genre et coll., 2008). De même, les cellules symbiotiques des insectes, les bactériocytes hébergeant des endosymbiontes intracellulaires sont également gros et polyploïdes (Nakabachi et al., 2010). Chez les plantes angiospermes, la polyploïdie est fréquente et le modèle héréditaire spécifique de la polyploïdie dans différents organes, tissus et types cellulaires suggère qu’elle pourrait être une source majeure de la physiologie spécialisée des cellules hôtes (Nagl, 1976; Edgar et al., 2014). Outre la croissance cellulaire, les multiples copies de gènes, l’absence de condensation chromosomique peut contribuer à des activités transcriptionnelles et métaboliques plus élevées. Cependant, l’association de la polyploïdie avec différentes fonctions cellulaires suggère un impact de la polyploïdie également sur l’architecture des nucléosomes et sur l’épigénome contrôlant l’activation ou la répression de régions génomiques spécifiques. En conséquence, le contenu du génome polyploïde des cellules symbiotiques semble être une condition préalable à la différenciation des nodules et à l’expression de la plupart des gènes hôtes symbiotiques (Maunoury et al., 2010).
Différents destins des Bactérioïdes Fixateurs d’azote
Les bactéries libérées de l’IT sont présentes dans le cytoplasme de l’hôte sous forme de structures ressemblant à des organites, appelées symbiosomes. Les bactéries n’ont pas de contact direct avec le cytoplasme car elles sont entourées d’une membrane péribactérioïde, également appelée membrane symbiosomique (SM). Le bactérioïde, le SM et l’espace entre eux constituent le symbiosome (Catalano et al., 2004). Le SM lors de sa formation reflète son origine membranaire plasmatique, des modifications ultérieures de sa composition ouvrent de nouveaux rôles spécialisés à l’interface hôte-endosymbiote (Limpens et al., 2009; Ivanov et coll., 2012; Brear et coll., 2013; Sinharoy et coll., 2013). Les bactérioïdes se multiplient dans les cellules nodules hôtes en croissance jusqu’à une certaine densité cellulaire, s’adaptent aux conditions de vie endosymbiotiques et microaérobies et mûrissent pour devenir des bactérioïdes fixateurs d’azote. La forme et la physiologie des bactérioïdes peuvent cependant être très différentes selon les légumineuses. Chez certains hôtes légumineuses, les bactérioïdes fixateurs d’azote ont la même morphologie que les cellules cultivées ; ce type de bactérioïdes peut revenir à la forme libre. Dans d’autres associations, les bactérioïdes sont irréversiblement transformés en endosymbiontes polyploïdes, élargis et non cultivables. Ces bactérioïdes différenciés en phase terminale peuvent être allongés et même ramifiés et 5 à 10 fois plus longs que les cellules vivantes libres ou peuvent être sphériques de 8 à au moins 20 fois amplifiés du génome selon l’hôte (Mergaert et al., 2006; Nakabachi et coll., 2010). La différenciation terminale des bactérioïdes est contrôlée par l’hôte, elle a évolué dans de multiples branches de la famille des Légumineuses, ce qui indique un avantage pour l’hôte et des performances symbiotiques probablement plus élevées (Oono et al., 2010). La différenciation terminale des bactérioïdes est la mieux élucidée dans la symbiose S. meliloti–M. truncatula. En M. les nodules de troncatules, les événements les plus visibles de différenciation des bactérioïdes terminaux se produisent dans la zone II. La multiplication des bactérioïdes s’arrête au milieu de la zone II où l’allongement cellulaire et l’amplification uniforme des réplicons multiples par cycles d’endoréduplication commencent. Le long de 2-3 couches cellulaires à la frontière de la zone II et III (appelée interzone), une croissance soudaine des bactérioïdes est visible atteignant pratiquement leur taille finale, cependant, la fixation de l’azote n’a lieu que dans la zone III.
Les peptides hôtes régissent la différenciation des bactérioïdes
La comparaison des transcriptomes de nodules de légumineuses à différenciation bactérioïde réversible et irréversible a révélé l’existence de plusieurs centaines de petits gènes qui n’étaient présents que dans le génome des plantes hôtes où la différenciation des bactérioïdes était terminale. Chez M. truncatula, les cellules nodules produisent au moins 600 peptides symbiotiques spécifiques aux nodules (symPEPs). Les gènes symPEP ne sont activés que dans les cellules symbiotiques polyploïdes infectées par S. meliloti (Kevei et al., 2002; Mergaert et coll., 2003), cependant certains ensembles au début, d’autres aux derniers stades du développement des nodules. Une grande partie, plus de 500 gènes codent des peptides riches en cystéine (NCR) spécifiques aux nodules (Mergaert et al., 2003; Alunni et coll., 2007; Nallu et coll., 2014). Les peptides NCR sont ciblés sur les bactérioïdes et lorsque leur délivrance aux endosymbiontes a été bloquée, la différenciation des bactérioïdes a été abolie démontrant que les peptides sont responsables de la différenciation terminale des bactérioïdes de S. meliloti (Van de Velde et al., 2010). La grande variété de séquences et les schémas d’expression caractéristiques des gènes NCR suggèrent une diversité dans leurs fonctions, leurs modes d’action et leurs cibles bactériennes à différents stades de maturation des bactérioïdes (figure 2). Cependant, pourquoi la cellule hôte produit-elle un arsenal de RCN? Quel peut être l’avantage d’un répertoire peptidique aussi diversifié? Est-ce nécessaire pour l’interaction de l’hôte avec diverses bactéries? Les partenaires symbiotiques de M. truncatula sont S. meliloti et S. medicae, mais dans le sol, il existe d’innombrables variantes de souches des deux espèces. M. truncatula est également représenté par de nombreux écotypes et accessions différents qui diffèrent par le nombre, les séquences et le profil d’expression des gènes de la RCN et par leurs interactions symbiotiques avec différentes souches de S. meliloti et de S. medicae (Nallu et al., 2014; Roux et coll., 2014). Alors qu’un nodule contient un seul type de bactérie, les différents nodules d’un même système racinaire peuvent posséder des populations bactériennes distinctes. Il est possible que la plante reconnaissant les différents endosymbiontes les manipule avec un répertoire de peptides spécifique à la souche. Ces différences peuvent ajouter un niveau de contrôle supplémentaire pour la spécificité hôte-symbiote et donc pour l’efficacité de la nodulation.

FIGURE 2. Expression différentielle des gènes symPEP dans les nodules de M. truncatula. Signal noir : hybridation in situ, signal bleu : Activité GUS des fusions promoteur symPEP-GUS dans les nodules transgéniques.
Bien que les symPEPs représentent des classes peptidiques uniques, leurs structures ressemblent à des peptides antimicrobiens (AMP). Les AMP à large spectre d’activité de destruction cellulaire microbienne sont le plus souvent cationiques provoquant la mort cellulaire par formation de pores, perturbation de la membrane et lyse conséquente des cellules microbiennes. Le fait que la capacité de division cellulaire soit définitivement perdue lors de la différenciation des endosymbiotes indique qu’au moins certains symPEPs ont des activités antimicrobiennes. Le traitement des bactéries par des RCN cationiques synthétiques a en effet provoqué une élimination dépendante de la dose rapide et efficace de diverses bactéries Gram négatives et Gram positives, y compris d’importants pathogènes humains et végétaux (Van de Velde et al., 2010; Tiricz et coll., 2013). Cet effet de destruction ex-planta est corrélé à la perméabilisation des membranes microbiennes, cependant, les symPEPs dans leur environnement naturel – dans les cellules nodules – ne perméabilisent pas les membranes bactériennes et ne tuent pas les endosymbiontes. Très probablement, les concentrations de peptides dans les nodules sont significativement plus faibles que celles appliquées dans les dosages in vitro. De plus, des peptides cationiques sont produits avec des peptides anioniques et neutres dans la même cellule, et une combinaison possible de quelques dizaines ou centaines de peptides de différentes charges et hydrophobicité pourrait neutraliser l’effet bactéricide direct des peptides cationiques.
L’implication d’AMP ou de peptides de type AMP n’est pas unique pour la symbiose Rhizobium-légumineuse. Chez le charançon Sitophilus, les cellules symbiotiques produisent le peptide antimicrobien coléoptéricine-A (ColA) qui provoque le développement d’endosymbiontes filamenteux géants en inhibant la division cellulaire et protège les tissus des insectes voisins de l’invasion bactérienne (Login et al., 2011). Dans ce système, un seul peptide est suffisant pour la différenciation de l’endosymbionte à transmission verticale obligatoire contrairement aux nodules qui fonctionnent avec des centaines de symPEPs et peuvent héberger d’innombrables variantes de souches comme endosymbiontes. Dans la symbiose puceron-Buchnère, les cellules hôtes produisent également des peptides spécifiques aux bactériocytes, y compris des peptides riches en cystéine (BCR) qui ressemblent aux peptides de la RCN de Medicago, mais les fonctions de ces peptides symbiotiques n’ont pas encore été rapportées (Shigenobu et Stern, 2013).
NCR247 : Un exemple pour l’analyse du Transcriptome de l’Effecteur Hôte Multi-Cibles
de M. les nodules tronqués à différents stades de leur développement, la microdissection au laser des régions nodules, l’hybridation in situ, l’immunolocalisation de peptides sélectionnés et les fusions de gènes promoteur-rapporteur symPEP dans les nodules transgéniques permettent de cartographier l’action des peptides individuels dans les cellules symbiotiques depuis le début de l’infection jusqu’à l’état de fixation tardive de l’azote. Le NCR247 est exprimé dans les couches cellulaires plus anciennes de la zone II et dans l’interzone où la division cellulaire bactérienne s’arrête et où se produit un allongement remarquable des endosymbiontes (Farkas et al., 2014). Ce petit peptide cationique a efficacement tué divers microbes in vitro et l’analyse in silico a indiqué ses capacités extrêmes de liaison aux protéines. Le NCR247 marqué par le FITC est entré dans le cytosol bactérien où ses interactions avec de nombreuses protéines bactériennes étaient possibles. Des partenaires de liaison ont été identifiés par traitement de bactéries ou de bactérioïdes de S. meliloti avec des peptides marqués StrepII/FLAG, suivi d’une chromatographie d’affinité et de l’identification de partenaires en interaction avec LC-MS/MS et une analyse occidentale (Farkas et al., 2014).
L’un des interacteurs était la protéine de division cellulaire FtsZ jouant un rôle crucial dans la division cellulaire. Un certain nombre de peptides antibiotiques sont connus pour exercer un effet bactéricide ou bactériostatique par l’interaction avec la FtsZ, inhibant sa polymérisation, empêchant ainsi la formation correcte du cycle Z et du septum (Handler et al., 2008). Le NCR247 a été co-purifié avec le FtsZ à partir du cytoplasme bactérien et il a été démontré qu’il perturbait la formation du septum. NCR035 présentant in vitro également un effet bactéricide et produit dans les mêmes cellules symbiotiques que NCR247 s’accumule au niveau du septum de division ce qui indique une action simultanée ou consécutive de ces peptides et l’évolution de stratégies hôtes multiples pour inhiber la prolifération de l’endosymbiont. Une autre étude a montré que l’expression de gènes de division cellulaire importants, y compris les gènes nécessaires à la fonction du cycle Z, était fortement atténuée dans les cellules traitées par NCR247 (Penterman et al., 2014). Le prétraitement des bactéries avec des concentrations sublétales de NCR247 a aboli la localisation du FITC-NCR035 au septum et provoqué l’élongation cellulaire (Farkas et al., 2014).
Les protéines ribosomiques étaient les partenaires d’interaction NCR247 les plus abondants. On a observé que le NCR247 inhibait fortement la synthèse des protéines bactériennes de manière dose-dépendante à la fois in vivo et in vitro (Farkas et al., 2014). Ces résultats suggèrent qu’un mode d’action du peptide NCR247 se lie aux ribosomes à la fois dans les cellules bactériennes et les bactérioïdes. Fait intéressant, un modèle modifié et une complexité réduite des protéines en interaction ont été observés chez les bactérioïdes. En conséquence, le niveau d’expression général des protéines ribosomiques était en moyenne 20 fois plus faible chez les bactérioïdes que dans les cellules libres avec une abondance relative différente des transcrits des protéines ribosomiques individuelles. La diversification des ribosomes chez les bactérioïdes peut jouer un rôle important en contribuant à la traduction avancée de protéines spécifiques, soutenant ainsi la physiologie spécialisée et exigeante en énergie d’une fonction de fixation de l’azote très abondante.
Le chaperon de GroEL était également un partenaire d’interaction directe du NCR247 (Farkas et al., 2014). Sur les 5 protéines de GroEL, GroEL1 ou GroEL2 est suffisant pour la survie tandis que GroEL1 exprimé à un niveau élevé dans le nodule est essentiel à la symbiose (Bittner et al., 2007). Il est nécessaire pour l’activation complète des gènes de nodulation et l’assemblage du complexe nitrogénase. GroEL possède une polyvalence fonctionnelle extrême en interagissant avec des centaines de protéines. L’interaction NCR247-GroEL1 peut avoir des conséquences directement sur GroEL mais aussi indirectement sur les substrats de GroEL et les processus biologiques associés. L’absence de GroEL1 a gravement affecté l’infection bactérienne et le maintien et la différenciation des bactérioïdes démontrant un besoin général de GroEL1 à tous les stades du développement des nodules fixateurs d’azote.
L’implication des peptides de GroEL et de l’hôte dans les interactions microbe-hôte n’est pas unique pour la symbiose Rhizobium-légumineuse. Dans les cellules symbiotiques du charançon, la coléoptéricine-A (ColA) interagit également avec GroEL (Login et al., 2011). GroEL joue également un rôle important dans le maintien des endosymbiontes (Moran, 1996; Kupper et al., 2014). Comme la plupart des systèmes symbiotiques sont encore inexplorés et que des outils génomiques et protéomiques à haut débit ne sont disponibles que récemment, nous ne pouvons que prédire que la différenciation des endosymbiontes médiée par les peptides de l’hôte, de même que l’amplification du génome des cellules hôtes et les endosymbiontes différenciés en phase terminale sont des stratégies générales de symbiose.
Conclusion
Les bactéries symbiotiques et pathogènes utilisent des approches similaires pour interagir avec leurs hôtes et survivre dans les cellules hôtes, même si les résultats de ces interactions sont remarquablement différents. Les plantes et les animaux peuvent générer des réponses immunitaires innées aux micro-organismes lors de la perception des MAMP (modèles moléculaires associés aux micro-organismes). Cette perception entraîne l’activation de cascades de signalisation et la production d’effecteurs antimicrobiens. Peptides hôtes de type AMP tels que le M. les peptides truncatula NCR ou le peptide antimicrobien weevil ColA jouent un rôle central et multiforme dans le contrôle de la multiplication et de la différenciation des endosymbiontes, limitant ainsi la présence de bactéries aux cellules symbiotiques. Ainsi, les organismes hôtes utilisent ces peptides effecteurs pour apprivoiser et même embaucher des envahisseurs microbiens sélectionnés pour le service.
Déclaration sur les conflits d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
Le travail dans nos laboratoires est soutenu par la Subvention avancée « SYM-BIOTICS » du Conseil Européen de la Recherche à Éva Kondorosi (numéro de subvention 269067) et par TÁMOP-4.2.2.A-11/1/KONV-2012-0035 soutenu par l’Union européenne et cofinancé par le Fonds social européen.
Abdel-Lateif, K., Bogusz, D., et Hocher, V. (2012). Le rôle des flavonoïdes dans l’établissement des endosymbioses des racines des plantes avec des champignons mycorhizes arbusculaires, des bactéries rhizobia et Frankia. Signal de plante. Se comporter. 7, 636–641. doi: 10.4161/ psb.20039
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alunni, B., Kevei, Z., Redondo-Nieto, M., Kondorosi, A., Mergaert, P., and Kondorosi, E. (2007). Genomic organization and evolutionary insights on GRP and NCR genes, two large nodule-specific gene families in Medicago truncatula. Mol. Plant Microbe Interact. 20, 1138–1148. doi: 10.1094/MPMI-20-9-1138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barnett, M. J., Fisher, R. F., Jones, T., Komp, C., Abola, A. P., Barloy-Hubler, F., et al. (2001). Séquence nucléotidique et fonctions prédites de l’ensemble du Sinorhizobium meliloti pSymA megaplasmid. Proc. Natl. Acad. Sci. États-Unis 98, 9883-9888. doi: 10.1073/pnas.161294798
Résumé Pubmed / Texte intégral Pubmed | Texte intégral CrossRef
Bittner, A. N., Foltz, A., et Oke, V. (2007). Un seul des cinq gènes de groEL est requis pour la viabilité et le succès de la symbiose chez Sinorhizobium meliloti. J. Bacteriol. 189, 1884–1889. doi: 10.1128/JB.01542-06
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brear, E. M., Day, D. A., and Smith, P. M. (2013). Iron: an essential micronutrient for the legume-Rhizobium symbiosis. Front. Plant Sci. 4:359. doi: 10.3389/fpls.2013.00359
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Catalano, C. M., Lane, W. S., and Sherrier, D. J. (2004). Biochemical characterization of symbiosome membrane proteins from Medicago truncatula root nodules. Electrophoresis 25, 519–531. doi: 10.1002/elps.200305711
Résumé Pubmed / Texte Intégral Pubmed | Texte intégral CrossRef
Capela, D., Barloy-Hubler, F., Gouzy, J., Bothe, G., Ampe, F., Batut, J., et al. (2001). Analyse de la séquence chromosomique de la légumineuse symbiote Sinorhizobium meliloti souche 1021. Proc. Natl. Acad. Sci. États-Unis 98, 9877-9882. doi: 10.1073/pnas.161294398
Résumé Pubmed | Texte Intégral Pubmed / Texte intégral Croisé
Cebolla, A., Vinardell, J. M., Kiss, E., Oláh, B., Roudier, F., Kondorosi, A., et al. (1999). L’inhibiteur mitotique ccs52 est nécessaire à l’endoréduplication et à l’élargissement des cellules dépendantes de la ploïdie chez les plantes. EMBO J. 18, 4476-4484. doi: 10.1093/emboj/18.16.4476
CrossRef Texte intégral
Chen, W. M., Moulin, L., Bontemps, C., Vandamme, P., Béna, G. et Boivin-Masson, C. (2003). La fixation symbiotique de l’azote des légumineuses par les β-protéobactéries est répandue dans la nature. J. Bacteriol. 185, 7266–7272. doi: 10.1128/JB.185.24.7266-7272.2003
CrossRef Texte intégral
Edgar, B. A., Zielke, N., et Gutierrez, C. (2014). Endocycles: une innovation évolutive récurrente pour la croissance cellulaire post-mitotique. NAT. Rév. Mol. Cellule. Biol. 15, 197–210. doi: 10.1038/nrm3756
Résumé Pubmed |Texte Intégral Pubmed/Texte intégral CrossRef
Farkas, A., Maróti, G., Dürgõ, H., Györgypál, Z., Lima, R. M., Medzihradszky, K. F., et al. (2014). Le peptide symbiotique Medicago truncatula NCR247 contribue à la différenciation des bactérioïdes par de multiples mécanismes. Proc. Natl. Acad. Sci. États-Unis 111, 5183-5188. doi: 10.1073/pnas.1404169111
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Favery, B., Complainville, A., Vinardell, J. M., Lecomte, P., Vaubert, D., Mergaert, P.,et al. (2002). The endosymbiosis-induced genes ENOD40 and CCS52a are involved in endoparasitic-nematode interactions in Medicago truncatula. Mol. Plant-Microbe Interact. 15, 1008–1013. doi: 10.1094/MPMI.2002.15.10.1008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franssen, H. J., Vijn, I., Yang, W. C., and Bisseling, T. (1992). Developmental aspects of the Rhizobium-legume symbiosis. Plant Mol. Biol. 19, 89–107. doi: 10.1007
CrossRef Full Text
Fraysse, N., Couderc, F., and Poinsot, V. (2003). Surface polysaccharide involvement in establishing the Rhizobium–legume symbiosis. Eur. J. Biochem. 270, 1365–1380. doi: 10.1046/j.1432-1033.2003.03492.x
CrossRef Full Text
Genre, A., Chabaud, M., Faccio, A., Barker, D. G., and Bonfante, P. (2008). L’assemblage de l’appareil de prépénétration précède et prédit les schémas de colonisation des champignons mycorhiziens arbusculaires dans le cortex racinaire de Medicago truncatula et de Daucus carota. Cellule végétale 20, 1407-1420. doi: 10.1105/ tpc.108.059014
Résumé Pubmed /Texte intégral Pubmed |Texte intégral CrossRef
Gestionnaire, A. A., Lim, J.E. et Losick, R. (2008). Inhibiteur peptidique de la cytokinèse lors de la sporulation chez Bacillus subtilis. Mol. Microbiol. 68, 588–599. doi: 10.1111/j.1365-2958.2008.06173.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ivanov, S., Fedorova, E. E., Limpens, E., De Mita, S., Genre, A., Bonfante, P.,et al. (2012). Rhizobium–legume symbiosis shares an exocytotic pathway required for arbuscule formation. Proc. Natl. Acad. Sci. U.S.A. 109, 8316–8321. doi: 10.1073/pnas.1200407109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kevei, Z., Vinardell, J. M., Kiss, G. B., Kondorosi, A., and Kondorosi, E. (2002). Les protéines riches en glycine codées par une famille de gènes spécifiques aux nodules sont impliquées dans différents stades de développement des nodules symbiotiques chez Medicago spp. Mol. Les Microbes végétaux Interagissent. 15, 922–931. doi: 10.1094/ MPMI.2002.15.9.922
Résumé Pubmed /Texte intégral Pubmed /Texte intégral croisé
Kondorosi, E., et Kondorosi, A. (2004). Endoréduplication et activation du complexe favorisant l’anaphase pendant le développement des cellules symbiotiques. FEBS Lett. 567, 152–157. doi: 10.1016/ j. febslet.2004.04.075
Résumé Pubmed / Texte intégral Pubmed | Texte intégral CrossRef
Kondorosi, E., Mergaert, P., et Kereszt, A. (2013). Un paradigme pour la vie endosymbiotique: différenciation cellulaire des bactéries Rhizobium provoquée par des facteurs de plantes hôtes. Annu. Rév. Microbiol. 67, 611–628. doi:10.1146/annurev-micro-092412-155630
CrossRef Texte intégral
Kupper, M., Gupta, S. K., Feldhaar, H. et Gross, R. (2014). Rôles polyvalents de la chapéronine dans les interactions micro-organismes-insectes. Microbiol FEMS. Lett. 353, 1–10. doi: 10.1111/1574-6968.12390
Résumé Pubmed |Texte Intégral Pubmed/ Texte intégral CrossRef
Limpens, E., Ivanov, S., van Esse, W., Voets, G., Fedorova, E., et Bisseling, T. (2009). Les symbiosomes fixateurs de N2 de Medicago acquièrent le marqueur d’identité endocytaire Rab7 mais retardent l’acquisition de l’identité vacuolaire. Cellule végétale 21, 2811-2828. doi: 10.1105/ tpc.108.064410
Résumé Pubmed / Texte Intégral Pubmed | Texte intégral CrossRef
Login, F. H., Balmand, S., Vallier, A., Vincent-Monégat, C., Vigneron, A., Weiss-Gayet, M., et coll. (2011). Les peptides antimicrobiens maintiennent les endosymbiontes des insectes sous contrôle. Science 334, 362-365. doi: 10.1126 / science.1209728
Résumé Pubmed / Texte intégral Pubmed | Texte intégral CrossRef
MacLean, A. M., Finan, T. M. et Sadowsky, M. J. (2007). Génomes des bactéries symbiotiques fixatrices d’azote des légumineuses. Physiol végétal. 144, 615–622. doi:10.1104/pp.107.101634
Résumé Pubmed |Texte Intégral Pubmed / Texte Intégral Croisé
Maunoury, N., Redondo-Nieto, M., Bourcy, M., Van de Velde, W., Alunni, B., Laporte, P., et coll. (2010). La différenciation des cellules symbiotiques et des endosymbiontes est couplée à deux commutateurs de transcriptome dans la nodulation de la troncature de Medicago. PLoS UN 5: e9519. doi: 10.1371 / journal.pone.0009519
Résumé Pubmed | Texte Intégral Pubmed / Texte intégral CrossRef
Mergaert, P., Nikovics, K., Kelemen, Z., Maunoury, N., Vaubert, D., Kondorosi, A., et al. (2003). Une nouvelle famille dans Medicago truncatula composée de plus de 300 gènes spécifiques aux nodules codant pour de petits polypeptides sécrétés avec des motifs de cystéine conservés. Physiol végétal. 132, 161–173. doi: 10.1104/pp.102.018192
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mergaert, P., Uchiumi, T., Alunni, B., Evanno, G., Cheron, A., Catrice, O.,et al. (2006). Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis. Proc. Natl. Acad. Sci. U.S.A. 103, 5230–5235. doi: 10.1073/pnas.0600912103
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Moran, N. A. (1996). Évolution accélérée et cliquet de Muller chez les bactéries endosymbiotiques. Proc. Natl. Acad. Sci. États-Unis 93, 2873-2878. doi: 10.1073/pnas.93.7.2873
CrossRef Texte intégral
Moran, N. A., McCutcheon, J. P., et Nakabachi, A. (2008). Génomique et évolution des symbiotes bactériens héritables. Annu. Rév. Genet. 42, 165–690. doi: 10.1146/annurev.genet.41.110306.130119
CrossRef Texte intégral
Nakabachi, A., Koshikawa, S., Miura, T. et Miyagishima, S. (2010). Taille du génome de Pachypsylla venusta (Hémiptères: Psyllidae) et la ploïdie de son bactériocyte, la cellule hôte symbiotique qui abrite des bactéries mutualistes intracellulaires avec le plus petit génome cellulaire. Taureau. Entomol. Rés. 100, 27 à 33. doi: 10.1017/S0007485309006737
Résumé Pubmed/Texte Intégral Pubmed/Texte intégral CrossRef
Nagl, W. (1976). L’endoréduplication de l’ADN et la polyténie sont comprises comme des stratégies évolutives. Nature 261, 614-615. doi:10.1038/261614a0
Résumé Pubmed /Texte Intégral Pubmed|Texte intégral CrossRef
Nallu, S., Silverstein, K. A., Zhou, P., Young, N.D., et Vandenbosch, K.A. (2014). Patterns of divergence of a large family of nodule cysteine-rich peptides in accessions of Medicago truncatula. Usine J. 78, 697-705. doi: 10.1111/ tpj.12506
Résumé Pubmed / Texte intégral Pubmed | Texte intégral CrossRef
Oldroyd, G.E. (2013). Parlez, ami et entrez: systèmes de signalisation qui favorisent des associations symbiotiques bénéfiques chez les plantes. NAT. Rév. Microbiol. 11, 252–263. doi: 10.1038/nrmicro2990
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Oono, R., Schmitt, I., Sprent, J. I., and Denison, R. F. (2010). Multiple evolutionary origins of legume traits leading to extreme rhizobial differentiation. New Phytol. 187, 508–520. doi: 10.1111/j.1469-8137.2010.03261.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Penterman, J., Abo, R. P., De Nisco, N. J., Arnold, M. F., Longhi, R., Zanda, M.,et al. (2014). Les peptides de plantes hôtes provoquent une réponse transcriptionnelle pour contrôler le cycle cellulaire de Sinorhizobium meliloti pendant la symbiose. Proc. Natl. Acad. Sci. États-Unis 111, 3561-3566. doi: 10.1073/pnas.1400450111
Résumé Pubmed / Texte intégral Pubmed | Texte intégral CrossRef
Price, D. R., Duncan, R. P., Shigenobu, S., et Wilson, A. C. (2011). Expansion du génome et expression différentielle des transporteurs d’acides aminés à l’interface symbiotique puceron/buchnera. Mol. Biol. Evol. 28, 3113–3126. doi: 10.1093/molbev/msr140
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roudier, F., Fedorova, E., Lebris, M., Lecomte, P., Györgyey, J., Abad, P.,et al. (2003). The Medicago species A2-type cyclin is auxin regulated and involved in meristem formation but dispensable for endoreduplication-associated developmental programs. Plant Physiol. 131, 1091–1103. doi: 10.1104/pp.102.011122
CrossRef Full Text
Roux, B., Rodde, N., Jardinaud, M. F., Timmers, T., Sauviac, L., Cottret, L.,et al. (2014). Une analyse intégrée de l’expression des gènes végétaux et bactériens dans les nodules racinaires symbiotiques à l’aide d’une microdissection par capture laser couplée au séquençage de l’ARN. Usine J. 77, 817-837. doi: 10.1111/ tpj.12442
Résumé Pubmed / Texte intégral Pubmed | Texte intégral CrossRef
Shigenobu, S., et Stern, D. L. (2013). Les pucerons ont développé de nouvelles protéines sécrétées pour une symbiose avec l’endosymbionte bactérien. Proc. Biol. Sci. 280, 20121952. doi: 10.1098/ rspb.2012.1952
Résumé Pubmed / Texte Intégral Pubmed | Texte intégral CrossRef
Sinharoy, S., Torres-Jerez, I., Bandyopadhyay, K., Kereszt, A., Pislariu, C. I., Nakashima, J., et al. (2013). Le régulateur du facteur de transcription C2H2 de la différenciation des symbiosomes réprime la transcription du gène de la voie sécrétoire VAMP721a et favorise le développement des symbiosomes dans Medicago truncatula. Cellule végétale 25, 3584-3601. doi: 10.1105/ tpc.113.114017
Résumé Pubmed / Texte Intégral Pubmed |Texte intégral CrossRef
Terpolilli, J. J., Hood, G. A., and Poole, P. S. (2012). What determines the efficiency of N(2)-fixing Rhizobium-legume symbioses? Adv. Microb. Physiol. 60, 325–389. doi: 10.1016/B978-0-12-398264-3.00005-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiricz, H., Szûcs, A., Farkas, A., Pap, B., Lima, R. M., Maróti, G.,et al. (2013). Antimicrobial nodule-specific cysteine-rich peptides induce membrane depolarization associated changes in Sinorhizobium meliloti. Appl. Env. Microbiol. 79, 6737–6746. doi: 10.1128/AEM.01791-13
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Van de Velde, W., Zehirov, G., Szatmari, A., Debreczeny, M., Ishihara, H., Kevei, Z.,et al. (2010). Plant peptides govern terminal differentiation of bacteria in symbiosis. Science 327, 1122–1126. doi: 10.1126/science.1184057
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vinardell, J. M., Fedorova, E., Cebolla, A., Kevei, Z., Horvath, G., Kelemen, Z.,et al. (2003). L’endoréduplication médiée par l’activateur du complexe favorisant l’anaphase CCS52A est nécessaire à la différenciation des cellules symbiotiques dans les nodules de troncature de Medicago. Cellule végétale 15, 2093-2105. doi: 10.1105/ tpc.014373
Résumé Pubmed / Texte intégral Pubmed | Texte intégral CrossRef
Walker, S.A., et Downie, J.A. (2000). Entrée de Rhizobium leguminosarum bv. viciae dans les poils racinaires nécessite une spécificité minimale du facteur de Nod, mais la croissance ultérieure du fil d’infection nécessite un nodO ou un nœud. Mol. Plante-Microbe Interagissent.13, 54–62. doi: 10.1094/ MPMI.2000.13.7.754
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text