- Introduction
- Matériaux et méthodes
- Matériaux végétaux et Conditions de croissance
- Mesures PSI et PSII
- Analyse électrochromique de décalage
- Des traitements photo-inhibiteurs
- Analyse statistique
- Résultats
- Discussion
- Le rôle de la stimulation du CEF à faible luminosité
- Le changement du rapport d’oxydation de P700 à faible Luminosité n’est pas lié au pmf
- ETRII contrôle le rapport d’oxydation P700 à faible luminosité
- Conclusion
- Contributions des auteurs
- Financement
- Déclaration sur les conflits d’intérêts
Introduction
Bien que la lumière soit la force motrice de la photosynthèse, une lumière élevée peut entraîner une photoinhibition significative du photosystème II (PSII) pour les feuilles des plantes établissant l’ombre (Kitao et al., 2000; Barth et coll., 2001; Krause et coll., 2004; Huang et coll., 2015b, 2016b, c). Cependant, le PSII photoinhibé se rétablit rapidement à faible luminosité (He et Chow, 2003; Zhang et Scheller, 2004, Allakhverdiev et al., 2005), en raison du taux de renouvellement rapide de la protéine D1 (Aro et al., 1993; Zhang et Scheller, 2004; Allakhverdiev et al., 2005). Le taux de réparation du PSII a été réduit lors de l’inhibition de la synthèse de l’ATP, soit par PSI, soit par PSII (Allakhverdiev et al., 2005), indiquant que la réparation rapide des complexes PSII photodamés nécessite une grande quantité d’ATP en peu de temps. Une étude précédente a indiqué qu’après la photo-inhibition de PSII induite par le refroidissement, le flux d’électrons cycliques (CEF) était significativement stimulé lors de la récupération à faible luminosité (Huang et al., 2010). Il a été proposé que cette stimulation du CEF à faible luminosité améliore la synthèse de l’ATP pour la réparation rapide du PSII (Huang et al., 2010). Cependant, plus de preuves sont nécessaires pour clarifier le rôle spécifique de la stimulation du CEF à faible luminosité après la photoinhibition du PSII.
Pendant le CEF, les électrons du NADPH ou de la ferrédoxine sont cyclés autour du PSI dans le pool de plastoquinone. Ce transfert d’électrons est couplé à la translocation de protons et génère un gradient de protons à travers les membranes thylakoïdes (ΔpH) (Shikanai et Yamamoto, 2017). En plus de contribuer à la synthèse de l’ATP, une autre fonction de ΔpH est la régulation à la baisse du transport d’électrons photosynthétiques en acidifiant la lumière thylakoïde (Shikanai, 2014, 2016). Cette régulation implique deux mécanismes différents : l’un est lié à la dissipation d’énergie thermique et dissipe l’excès d’énergie lumineuse absorbée sous forme de chaleur des antennes PSII (Takahashi et al., 2009), et l’autre est la régulation à la baisse de l’activité du complexe Cyt b6/f et contrôle le taux de transfert d’électrons en PSI (Suorsa et al., 2012, 2016; Tikkanen et Aro, 2014). Chez les angiospermes, y compris Arabidopsis thaliana, deux voies de transport cyclique des électrons PSI fonctionnent (Shikanai, 2007). La première voie CEF est la voie dépendante de PGR5-/PGRL1 sensible à l’antimycine A (Munekage et al., 2002; Sugimoto et coll., 2013), et l’autre dépend du complexe de type chloroplaste NADH déshydrogénase (NDH) (Burrows et al., 1998; Shikanai et coll., 1998). La contribution de la voie dépendante de PGR5-/PGRL1 est plus significative chez les plantes en C3. Sous une lumière élevée, l’activation du CEF dépendant de PGR5-/PGRL1 induit l’acidification de la lumière thylakoïde et conduit ainsi à des niveaux élevés de rapport d’oxydation de la P700 (Suorsa et al., 2012, 2016; Kono et coll., 2014; Yamori et coll., 2016). En comparaison, le rapport d’oxydation du P700 à faible luminosité était peu affecté par le déficit en CEF dépendant du PGR5-/PGRL1 (Munekage et al., 2002, 2004; Kono et coll., 2014). Lors d’une photoinhibition modérée du PSII, la stimulation du CEF à faible luminosité s’est accompagnée d’une augmentation de la ration d’oxydation du P700 (Huang et al., 2010). Cependant, il n’est pas clair si cette augmentation du taux d’oxydation de P700 est causée par la stimulation du CEF.
En plus du CEF, le transfert d’électrons du PSII (ETRII) joue un rôle important dans l’incidence de l’état redox du PSI (Tikkanen et al., 2014; Huang et coll., 2016a, c; Suorsa et coll., 2016). Chez les plantes pgr5 d’A. thaliana, une photoinhibition sévère de PSII est susceptible de fonctionner comme le contrôle ultime du transfert d’électrons photosynthétiques permettant le maintien de P700 oxydé de manière optimale sous un excès de lumière (Tikkanen et al., 2014). Récemment, Suorsa et al. (2016) ont indiqué que les plantes pgr5 présentaient un taux d’oxydation élevé de la P700 sous une lumière élevée lorsque l’ETRII était réduit en combinant des mutations knockout dans les loci PsbO1, PsbP2, PsbQ1, PsbQ2 et PsbR. Dans les feuilles de tabac réfrigérées, une photoinhibition modérée du PSII a réduit le flux d’électrons en PSI, puis a augmenté le taux d’oxydation du P700 pendant d’autres traitements de refroidissement (Huang et al., 2016a). De plus, la photo-inhibition du PSII induite par le refroidissement a conduit à une dépression de l’ETRII, qui s’est accompagnée d’une augmentation du taux d’oxydation du P700 à faible luminosité (Huang et al., 2010). Nous émettons l’hypothèse que le rapport d’oxydation du P700 à faible luminosité est principalement contrôlé par le flux d’électrons provenant du PSII.
Dans notre rapport précédent, nous avons observé que la plante qui établit l’ombre Panax notoginseng présentait une photoinhibition sélective du PSII sous une forte contrainte de lumière. Après une exposition à court terme à un stress intense, l’ETRII à faible luminosité a considérablement diminué, mais le CEF a été significativement stimulé. Parallèlement, le taux d’oxydation du P700 a largement augmenté. Nos objectifs spécifiques étaient de (1) étudier si la stimulation CEF à faible luminosité facilite principalement la synthèse de l’ATP; et (2) déterminer si l’augmentation du rapport d’oxydation de la P700 lors d’une photoinhibition modérée de la PSII est plus liée à l’ETRII qu’à la stimulation du CEF ou à la modification de la pmf. Afin de répondre à ces questions, des feuilles intactes de Panax notoginseng ont été traitées à 2258 µmol de photons m-2 s-1 pendant 30 min. Avant et après un traitement à haute lumière, la distribution d’énergie en PSII, l’état redox du PSI et la force motrice du proton (pmf) à une faible lumière de 54 µmol de photons m-2 s-1 ont été déterminés.
Matériaux et méthodes
Matériaux végétaux et Conditions de croissance
Dans la présente étude, des plantes âgées de 2 ans d’une plante établissant l’ombre Panax notoginseng (Burkill) F. H. Chen ex C. Chow et W. G. Huang ont été utilisées pour des expériences. Ces plantes ont été cultivées à des conditions lumineuses de 10% de lumière solaire (avec une intensité lumineuse maximale en milieu de journée d’environ 200 µmol de photons m-2 s-1). Aucun stress hydrique et nutritionnel n’a été ressenti pour ces plantes. des feuilles entièrement expansées âgées de 9 semaines ont été utilisées pour les mesures photosynthétiques.
Mesures PSI et PSII
Les paramètres du photosystème I et du PSII ont été mesurés à 25 °C en enregistrant simultanément à l’aide d’un double système de mesure PAM-100 (Heinz Walz GmbH, Effeltrich, Allemagne). Les paramètres de fluorescence de la chlorophylle ont été calculés comme suit : Fv/Fm = (Fm-Fo)/Fm, Y(II) = (Fm’-Fs)/Fm’ (Genty et al., 1989), NPQ = (Fm-Fm’)/ Fm’. Fo et Fm sont respectivement la fluorescence minimale et maximale après acclimatation à l’obscurité. Fs est la fluorescence à l’état stationnaire adaptée à la lumière. Fo et Fm ont été déterminés après une acclimatation à l’obscurité pendant 30 min avant et après un traitement à haute luminosité. Les paramètres photosynthétiques PSI ont été mesurés par Double PAM-100 sur la base du signal P700 (différence d’intensités de lumière de mesure modulée par impulsions de 830 et 875 nm atteignant le photodétecteur) (Klughammer et Schreiber, 2008). Les signaux P700+ (P) peuvent varier entre un niveau minimal (P700 entièrement réduit) et un niveau maximal (P700 entièrement oxydé). Le niveau maximal (Pm) a été déterminé avec l’application d’une impulsion de saturation (photons m-2 s-1 de 600 ms et 10000 µmol) après pré-éclairage avec une lumière rouge lointaine, et les Pm ont été utilisées pour estimer l’activité PSI. Pm’ a été déterminé de manière similaire à Pm mais avec une lumière actinique au lieu d’une lumière rouge lointaine. Le rendement quantique du PSI a été calculé comme Y(I) = (Pm’-P)/Pm. Le rapport d’oxydation P700 dans une lumière actinique donnée a été calculé comme Y(ND) = P/Pm. Le rendement quantique de la dissipation d’énergie non photochimique PSI due à la limitation côté accepteur a été calculé comme Y(NA) = (Pm-Pm’)/Pm. Les valeurs à l’état d’équilibre pour Y(II), NPQ, Y(I) et Y(ND) ont été mesurées après une acclimatation à la lumière à faible luminosité pendant 20 min.
Le flux d’électrons photosynthétiques à travers le PSI et le PSII a été calculé comme suit : ETRII = Y (II) ×PPFD ×0,84 ×0,5 (Krall et Edwards, 1992), ETRI = Y (I) ×PPFD ×0,84 ×0,5 (Yamori et al., 2011), où 0,5 est supposé être la proportion de lumière absorbée atteignant PSI ou PSII, et 0,84 est supposé être l’absorbance (la fraction de la lumière incidente absorbée par les feuilles). L’étendue de l’activation du CEF a été estimée en tant que rapport ETRI/ETRII (Yamori et al., 2011, 2015). Il convient de noter que le partitionnement d’excitation 1: 1 entre PSI et PSII peut ne pas être réel, car les plantes d’ombre ont tendance à augmenter le rapport PSII / PSI (Lunde et al., 2003; Tikkanen et coll., 2006; Grieco et coll., 2012). De plus, dans cette étude, les paramètres PSI et PSII ont été mesurés à l’aide de la lumière actinique rouge (635 nm) fournie par Dual-PAM 100 (Walz, Allemagne). Étant donné que la lumière actinique rouge favorise l’excitation du PSII par rapport à celle du PSI, la distribution de l’énergie d’excitation du LHCII vers le PSII et le PSI peut être affectée par la lumière actinique rouge (Tikkanen et al., 2017).
Analyse électrochromique de décalage
Le signal ECS a été surveillé en tant que changement d’absorbance à 515 nm à l’aide d’un Dual-PAM-100 (Walz, Effeltrich, Allemagne) équipé d’un module émetteur-détecteur P515/535 (Walz). Le signal ECS a été obtenu après 20 min d’éclairage à 54 µmol de photons m-2 s-1, puis la désintégration ECS a été mesurée en éteignant la lumière actinique pendant 30 s. L’analyse de la cinétique de relaxation de l’intervalle sombre ECS (DIRKECS) a été réalisée par la méthode de Sacksteder et al. (2001) et Takizawa et coll. (2008). La cmp totale a été estimée à partir de l’amplitude totale de la décroissance rapide du signal ECS pendant un intervalle d’obscurité de 300 ms. La relaxation lente du signal ECS a permis de reconnaître la contribution du gradient de protons à travers les membranes thylakoïdes (ΔpH). La constante de temps de la relaxation ECS du premier ordre (TECS) est inversement proportionnelle à la conductivité protonique (gH+) de la membrane thylakoïde à travers l’ATP synthase (Sacksteder et Kramer, 2000; Cruz et al., 2005). En conséquence, gH+ a été estimé comme l’inverse de la constante de temps de désintégration.
Des traitements photo-inhibiteurs
Après une acclimatation à la noirceur pendant 30 min, la Vf/Fm et les particules ont été mesurées dans des feuilles intactes. Ensuite, ces feuilles intactes ont été adaptées à la lumière à des photons m-2 s-1 de 59 µmol pendant 20 min et les paramètres de fluorescence de la chlorophylle, du signal P700 et du signal ECS ont été enregistrés. Ensuite, la lumière actinique a été changée en photons 2258 µmol m-2 s-1. Après exposition à cette lumière élevée pendant 30 min, la lumière actinique a été changée en photons m-2 s-1 de 59 µmol immédiatement et les paramètres photosynthétiques ont été enregistrés après acclimatation à la lumière pendant 20 min. Enfin, Fv/Fm et Pm ont été mesurées après une acclimatation à l’obscurité pendant 30 min.
Analyse statistique
Les résultats ont été affichés sous forme de valeurs moyennes de cinq expériences indépendantes. Un test T indépendant a été utilisé au niveau de signification α = 0,05 pour déterminer s’il existait des différences significatives entre les différents traitements. Toutes les analyses statistiques ont été effectuées à l’aide de la norme SPSS 16.0.
Résultats
Au cours de l’induction photosynthétique à 59 µmol de photons m-2 s-1, ETRII a progressivement augmenté et a atteint un état d’équilibre vers 18 min (Figure 1A). Par comparaison, l’ETRI était constant pendant cette phase d’induction (Figure 1A). Après l’apparition de cette faible luminosité, ETRI était beaucoup plus élevé que ETRII. Cependant, après une induction photosynthétique de 20 minutes, l’ETRI était plus faible que l’ETRII. Ces résultats suggèrent l’activation du CEF pendant la phase initiale d’induction, conformément aux études précédentes (Joliot et Joliot, 2002, 2005; Makino et al., 2002). Après cette induction photosynthétique à faible luminosité, les feuilles ont été éclairées à une lumière élevée de 2258 µmol photons m-2 s-1 pendant 30 min. Fait intéressant, l’ETRII a progressivement diminué pendant le traitement à haute luminosité (figure 1B). Pendant ce temps, la valeur d’ETRI était supérieure à celle d’ETRII (Figure 1B), indiquant l’activation du CEF sous haute lumière. Après ce traitement à haute luminosité, le P700 (Pm) photo-oxydable maximal a été maintenu stable (Figure 2A). En comparaison, l’intensité maximale de fluorescence (Fm) a diminué de 40% et le rendement quantique maximal de PSII (Fv/ Fm) a diminué de 0,80 à 0,65 (Figures 2B, C). Ces résultats indiquent la photoinhibition sélective du PSII dans les feuilles de Panax notoginseng sous forte contrainte de lumière.
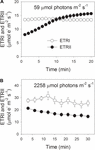
FIGURE 1. Flux d’électrons photosynthétiques à faible luminosité (A) et à haute luminosité (B). (A) Les feuilles acclimatées à l’obscurité ont été exposées à une faible lumière de 59 photons µmol m-2 s-1 pendant 20 min. (B) Après un éclairage à 59 photons µmol m-2 s-1 pendant 20 min pour activer le puits d’électrons lors de la photosynthèse, les feuilles ont été exposées à une lumière élevée de 2258 photons µmol m-2 s-1 pendant 30 min. Les valeurs sont des moyennes ± SE (n = 5).
Avant un traitement à haute lumière, les feuilles matures ont été éclairées à une faible luminosité de 59 photons µmol m-2 s-1 pendant 20 min pour activer la photosynthèse, puis les valeurs pour ETRI, ETRII, Y(ND) et NPQ ont été enregistrées. Après un traitement à haute luminosité pendant 30 min, les valeurs d’ETRI, ETRII, Y(ND) et NPQ ont été enregistrées après une nouvelle phase d’acclimatation de 20 min à faible luminosité. Avant le traitement à haute lumière, les valeurs pour ETRI ETRII à 59 µmol de photons m-2 s-1 étaient respectivement de 13,4 et 15,7 µmol d’électrons m-2 s-1 (Figures 3A, B). Après traitement à haute lumière, ETRI et ETRII à faible lumière étaient respectivement de 12,8 et 11,2 µmol d’électrons m-2 s-1 (Figures 3A, B). La valeur d’ETRII à 59 photons µmol m-2 s-1 a diminué d’environ 30% après traitement photo-inhibiteur, indiquant la dépression d’ETRII lors d’une photo-inhibition modérée de PSII. Avant le traitement à haute lumière, la valeur du rapport ETRI/ETRII à 59 photons µmol m-2 s-1 était de 0,85 (Figure 3C). Après traitement photo-inhibiteur, le rapport ETRI / ETRII a augmenté de manière significative à 1,14 (Figure 3C). Ces résultats suggèrent la stimulation du CEF à faible luminosité lors de la photoinhibition du PSII (Yamori et al., 2011, 2015).
Après le traitement à haute lumière, la valeur à l’état d’équilibre de Y(I) à 59 µmol de photons m-2 s-1 n’a pas changé (Figure 4A). Fait intéressant, Y(NA) a considérablement diminué de 0,36 à 0,23 (Figure 4B) et Y (ND) a considérablement augmenté de 0,1 à 0,25 (Figure 4C). Ces résultats ont indiqué le changement de l’état redox du PSI à faible luminosité après un traitement photo-inhibiteur. Pendant ce temps, la valeur de NPQ a légèrement changé (figure 4D). En conséquence, la photoinhibition modérée du PSII a eu des effets différents sur le taux d’oxydation du P700 et le NPQ à faible luminosité.
Afin de préciser si l’augmentation de Y(ND) est causée par une augmentation de pmf, les signaux de décalage électrochromiques à 54 photons µmol m-2 s-1 ont été déterminés après une acclimatation à la lumière pendant 20 minavant et après le traitement à haute lumière. Fait intéressant, le pmf total a diminué de manière significative de 18% après un traitement à haute lumière (Figure 5A), mais le niveau de ΔpH a changé de manière insignifiante (figure 5B). Étant donné que la formation de pmf peut être affectée par la conductivité protonique des thylakoïdes, la conductivité protonique (gH +) de la membrane des thylakoïdes à cette faible luminosité a également été examinée avant et après un traitement à haute lumière. Le résultat a montré que le gH + ne changeait pas avec le traitement à haute lumière (figure 5C), suggérant que le traitement à haute lumière n’affectait guère l’activité de la chloroplaste ATP synthase à faible lumière. Comme la diminution de 30% en ETRII s’est accompagnée d’une diminution de 18% en pmf, la stimulation du CEF à faible luminosité a partiellement compensé la formation de pmf et de ΔpH.

FIGURE 5. Valeurs de la force motrice totale des protons (pmf) (A), du gradient de protons (ΔpH) à travers les membranes thylakoïdes (B) et de la conductivité protonique (gH +) de la membrane thylakoïde (C) à faible luminosité. Tous les paramètres ont été mesurés après adaptation à 54 µmol de photons m-2 s-1 pendant 20 min. Les valeurs sont des moyennes ± SE (n = 5). L’astérisque indique un changement significatif (P< 0,05) après un traitement à haute luminosité.
Discussion
Le rôle de la stimulation du CEF à faible luminosité
Il a été indiqué que le CEF joue un rôle important dans le maintien de la photosynthèse et de la croissance des plantes (Yamori et Shikanai, 2016). Sous une lumière élevée, le CEF est maintenant considéré comme essentiel pour équilibrer le budget énergétique ATP / NADPH ainsi que pour protéger le PSI et le PSII des dommages (Munekage et al., 2002, 2004; Takahashi et coll., 2009; Suorsa et coll., 2012, 2016; Walker et coll., 2014; Huang et coll., 2015a, 2017b). À faible intensité lumineuse, le CEF joue un rôle important dans l’optimisation de l’assimilation photosynthétique du CO2 probablement via l’apport d’ATP supplémentaire (Yamori et al., 2011, 2015; Nishikawa et coll., 2012; Huang et coll., 2015a). Le rôle principal du CEF est modulé de manière flexible en réponse à l’intensité lumineuse. En particulier, le CEF contribue principalement à équilibrer le budget énergétique ATP / NADPH sous des intensités lumineuses sous-saturantes, mais protège principalement l’appareil photosynthétique contre la photo-inhibition lorsqu’il est exposé à des intensités lumineuses saturantes via l’acidification de la lumière thylakoïde (Huang et al., 2015a). Fait intéressant, Huang et al. (2010) ont constaté que le CEF était stimulé de manière significative à faible luminosité après une photo-inhibition du PSII induite par le refroidissement et ont émis l’hypothèse que cette stimulation du CEF améliorait principalement la synthèse de l’ATP pour la réparation rapide du PSII. Cependant, plus de preuves étaient nécessaires pour étayer cette hypothèse. Dans la présente étude, nous avons observé que la valeur d’ETRI / ETRII à faible luminosité augmentait de manière significative (Figure 3C), indiquant la stimulation du CEF autour du PSI (Huang et al., 2011, 2012, 2017a, b; Yamori et coll., 2011, 2015). Parallèlement, l’amplitude de pmf a diminué de manière significative et ΔpH a légèrement diminué. Ces résultats ont indiqué que la stimulation du CEF ne déclenchait pas la régulation descendante dépendante de ΔpH du transport d’électrons photosynthétiques. En d’autres termes, cette stimulation du CEF à faible luminosité a principalement facilité la synthèse de l’ATP.
Bien que la conductivité protonique de la chloroplaste ATP synthase n’ait pas été affectée par le traitement à haute lumière, la plus petite taille du pmf a entraîné une diminution du taux réel de synthèse de l’ATP. Les taux de réparation du PSII et d’assimilation photosynthétique du CO2 à faible luminosité sont principalement limités par le taux de synthèse de l’ATP (Allakhverdiev et al., 2005; Yamori et coll., 2011, 2015; Nishikawa et coll., 2012). Parce que l’ETRII a considérablement diminué lors de la photo-inhibition du PSII, le taux de synthèse de l’ATP via ETRII a été remarquablement réduit. Afin d’équilibrer le rapport ATP / NADPH requis par le métabolisme primaire et la réparation rapide du PSII, un mécanisme flexible est nécessaire pour fournir de l’ATP supplémentaire. Dans cette condition, ETRII a diminué de 30%, mais le CMP total n’a diminué que de 18%. Ces résultats indiquent que la stimulation du CEF a compensé la réduction de la formation de pmf dépendante de l’ETRII, améliorant la synthèse de l’ATP. La réparation rapide du PSII photodamagé dépend de la synthèse de l’ATP (Allakhverdiev et al., 2005). L’accélération du CEF autour du PSI a augmenté la concentration intracellulaire d’ATP, accélérant ainsi le taux de réparation du PSII chez Synechocystis (Allakhverdiev et al., 2005). Ensemble, nous proposons que la stimulation du CEF à faible luminosité joue un rôle important dans la réparation rapide de l’activité PSII via une synthèse d’ATP supplémentaire.
Le changement du rapport d’oxydation de P700 à faible Luminosité n’est pas lié au pmf
Un phénomène intéressant est que le rapport d’oxydation de P700 à faible luminosité a augmenté de manière significative lors d’une photoinhibition modérée de PSII (Huang et al., 2010), qui est également montré dans la présente étude. Dans des conditions où la lumière absorbée dépasse les exigences de la photosynthèse, la génération de ΔpH dépendante du CEF régule l’activité du complexe Cyt b6 / f et contrôle le flux d’électrons de PSII à PSI (Suorsa et al., 2012, 2016; Shikanai, 2014, 2016), optimisant l’état redox de P700 en PSI et minimisant la production de ROS en PSI pendant la photosynthèse. Chez les plantes pgr5 d’A. thaliana, le P700 est réduit par les électrons dans la lumière en raison de la perte de génération de pmf. Cependant, chez le mutant pgr5 accumulant la protéine flavodiiron, le niveau de pmf a également été rétabli au niveau de type sauvage, et donc P700 a été oxydé comme chez le type sauvage (Yamamoto et al., 2016). Dans les lignées mutantes de blé déficientes en chlorophylle b, un gradient de protons thylakoïdes insuffisant entraîne une sur-réduction du côté accepteur du PSI et donc une photo-inhibition du PSI à haute lumière ou à haute température (Brestic et al., 2015, 2016). Récemment, certaines études ont rapporté que l’activité accrue de la chloroplaste ATP synthase altérait la formation de pmf et provoquait une sur-réduction de la chaîne de transport d’électrons photosynthétiques, entraînant un photodamage du PSI sous une lumière élevée et une lumière fluctuante (Kanazawa et al., 2017; Takagi et coll., 2017). Ces rapports soutiennent le rôle critique du pmf dans le maintien d’une oxydation optimale du P700 en cas d’excès d’énergie lumineuse.
Nos résultats actuels indiquent qu’après le traitement à haute lumière pendant 30 min, le pmf total formé à cette faible lumière a considérablement diminué et la formation de ΔpH a légèrement changé (Figures 5A, B). Pendant ce temps, le taux d’oxydation du P700 a augmenté de manière significative, passant de 0,1 (avant traitement) à 0,25 (après traitement) (figure 4C). Ces résultats indiquent fortement que cette augmentation du taux d’oxydation de la P700 ne peut être expliquée par le changement de pmf, qui est largement différent de la corrélation entre Y(ND) et pmf sous haute lumière (Yamamoto et al., 2016; Takagi et coll., 2017). Par conséquent, l’effet régulateur du pmf sur le taux d’oxydation du P700 est minime à faible luminosité, mais devient particulièrement crucial sous une lumière élevée ou une lumière fluctuante. Sous une lumière élevée, une valeur élevée de Y (ND) est généralement accompagnée d’une valeur élevée de NPQ (Munekage et al., 2002, 2004; Kono et coll., 2014; Zivcak et coll., 2015), en raison de l’augmentation du pmf. L’altération de la formation de ΔpH entraîne une diminution des niveaux de Y (ND) et de NPQ sous une lumière élevée (Suorsa et al., 2012; Kono et coll., 2014; Yamamoto et coll., 2016; Kanazawa et coll., 2017). L’induction de NPQ à faible luminosité est principalement déterminée par le niveau d’acidification de la lumière. Après un traitement à haute luminosité, l’étendue de l’acidification de la lumière n’a pas changé (figure 5B) et le NPQ est resté stable (figure 4D). En comparaison, Y (ND) a considérablement augmenté. Ces résultats indiquent qu’à faible luminosité, Y(ND) et NPQ étaient contrôlés par différents mécanismes de régulation.
ETRII contrôle le rapport d’oxydation P700 à faible luminosité
Le PSI ne devient trop réduit que lorsque le flux d’électrons provenant du PSII dépasse la capacité des accepteurs d’électrons PSI à faire face aux électrons. Lorsque le flux d’électrons vers le PSI est limité, le PSI est extrêmement tolérant au stress de la lumière chez les plantes pgr5 d’A. thaliana (Suorsa et al., 2012, 2016; Tikkanen et coll., 2014). Pour la plante qui établit l’ombre Psychotria rubra, l’activité PSI était insusceptible à un stress intense dû à la lumière en présence de DCMU (Huang et al., 2016c). Dans les feuilles de tabac réfrigérées, une photoinhibition modérée du PSII a permis le maintien de la P700 oxydée de manière optimale, puis a protégé l’activité PSI contre d’autres photodamages (Huang et al., 2016a). Ces résultats ont indiqué le rôle important de l’ETRII dans le contrôle de l’état redox du PSI sous des contraintes élevées de lumière ou de lumière de refroidissement. Nos résultats actuels ont montré que la photo-inhibition modérée du PSII a conduit à une dépression significative de l’ETRII à faible luminosité. Pendant ce temps, l’activité PSI et l’activité de la chloroplaste ATP synthase ont légèrement changé, et le pmf total et le ΔpH n’ont pas augmenté. En conséquence, la réduction des ETRII n’a pas été causée par le contrôle photosynthétique dépendant de ΔpH via le complexe Cyt b6 / f, mais a probablement été induite par la diminution de l’activité PSII (Tikkanen et al., 2014). La diminution de l’apport d’électrons du PSII au PSI a conduit à l’augmentation du niveau d’oxydation du P700. Ainsi, le taux d’oxydation du P700 à faible luminosité a été largement contrôlé par ETRII.
Conclusion
Nous avons constaté que la photo-inhibition sélective du PSII induisait une stimulation du CEF et une augmentation du taux d’oxydation du P700 à faible luminosité. La stimulation du CEF n’a pas déclenché la régulation descendante dépendante de ΔpH du transport d’électrons photosynthétiques. En conséquence, cette stimulation du CEF à faible luminosité a principalement facilité la synthèse de l’ATP, ce qui est essentiel pour la réparation rapide du PSII photodamagé. L’augmentation du rapport d’oxydation P700 ne peut pas être expliquée par le changement du contrôle photosynthétique dépendant de ΔpH au complexe Cyt b6 / f, mais est principalement causée par la diminution de l’apport d’électrons de PSII à PSI.
Contributions des auteurs
WH, S-BZ et TL ont conçu et conçu la recherche. WH et Y-JY ont mené les expériences. WH, Y-JY, S-BZ et TL ont analysé les données. WH a écrit la première ébauche du manuscrit, qui a été intensivement éditée par tous les auteurs.
Financement
Cette étude a été soutenue par la Fondation Nationale des Sciences Naturelles de Chine (31670343), l’Association de Promotion de l’Innovation pour les Jeunes de l’Académie Chinoise des Sciences (2016347) et les Principaux Programmes Scientifiques et Techniques de la province du Yunnan (2016ZF001).
Déclaration sur les conflits d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Kono, M., Noguchi, K. et Terashima, I. (2014). Rôles du flux d’électrons cyclique autour du PSI (CEF-PSI) et des voies alternatives dépendantes de l’O2 dans la régulation du flux d’électrons photosynthétiques dans la lumière fluctuante à court terme chez Arabidopsis thaliana. Physiol des cellules végétales. 55, 990–1004. doi: 10.1093/pcp/pcu033
Résumé publié /Texte intégral croisé/Google Scholar
Shikanai, T. (2016). Réseau de régulation de la force motrice du proton: contribution du transport cyclique des électrons autour du photosystème I. Photosynth. Rés. 129, 253 à 260. doi: 10.1007/s11120-016-0227-0
Résumé publié par PubMed | Texte intégral croisé /Google Scholar
Yamori, W., Makino, A. et Shikanai, T. (2016). Un rôle physiologique du transport cyclique des électrons autour du photosystème I dans le maintien de la photosynthèse sous une lumière fluctuante dans le riz. Sci. Rép. 6:20147. doi:10.1038/srep20147
Résumé publié|Texte intégral croisé|Google Scholar
Yamori, W., et Shikanai, T. (2016). Fonctions physiologiques du transport cyclique d’électrons autour du photosystème I dans le maintien de la photosynthèse et de la croissance des plantes. Annu. Rév. Plante Biol. 67, 81–106. doi:10.1146/annurev-arplant-043015-112002
Résumé publié|Texte intégral croisé|Google Scholar
Yamori, W., Shikanai, T. et Makino, A. (2015). Le flux d’électrons cyclique du photosystème I via un complexe de type chloroplaste NADH déshydrogénase joue un rôle physiologique pour la photosynthèse à faible luminosité. Sci. Rép. 5:13908. doi: 10.1038/srep13908
Résumé PubMed|Texte intégral CrossRef|Google Scholar
Zhang, S. P., et Scheller, H. V. (2004). Photoinhibition du photosystème I à température de refroidissement et récupération ultérieure chez Arabidopsis thaliana. Physiol des cellules végétales. 45, 1595–1602. doi: 10.1093/pcp/pch180
Résumé publié / Texte intégral croisé /Google Scholar