INTRODUCTION
L’hématome aortique intramural (IMH) est l’une des nombreuses affections incluses dans le syndrome aortique aigu (SAA).1,2 En termes morphologiques, il se caractérise par une hémorragie dans la couche média de la paroi aortique en l’absence de déchirure intimale-médiale, ce qui signifie qu’il n’y a pas de communication avec la lumière aortique. Certains auteurs ont suggéré que l’IMH est le résultat d’une rupture spontanée du vasa vasorum aortique. La fréquence de l’HMI chez les patients présentant un SAA cliniquement suspecté varie de 5% à 20% des cas.2-4
Comme c’est le cas pour la dissection aortique classique, l’IMH se distingue en deux types selon la classification de Stanford: le type A, lorsqu’il y a atteinte de l’aorte ascendante, et le type B, lorsque l’aorte ascendante n’est pas affectée.
Il est actuellement admis que le traitement de l’IMH de type A est essentiellement chirurgical, alors que le type B peut être initialement traité par un traitement médical, en réservant la chirurgie ou la pose d’un stent pour les cas présentant des complications supplémentaires. La mortalité associée à l’IMH au cours des premiers mois n’est pas négligeable; les principaux facteurs prédictifs indépendants de la mort sont le diamètre de l’aorte > 50 mm et l’atteinte ascendante de l’aorte.5
Il existe encore quelques incertitudes quant à l’histoire naturelle de cette maladie et au traitement le plus approprié pour les patients atteints. Classiquement, il est conseillé d’éviter l’anticoagulation chez les patients atteints d’un SAA principalement pour deux raisons: limiter la progression de la dissection de l’hématome et éviter la tamponnade cardiaque chez les patients présentant un épanchement péricardique.
Le but de la présente étude est de décrire les caractéristiques cliniques et radiologiques, ainsi que l’évolution d’un sous-groupe de patients atteints d’IMH ayant reçu un traitement anticoagulant pendant l’hospitalisation.
MÉTHODES
Tous les patients admis dans notre hôpital avec un diagnostic de SAA de janvier 2000 à décembre 2005 ont été évalués prospectivement. Parmi ces patients, nous avons sélectionné tous ceux qui avaient une IMH et avaient reçu un traitement anticoagulant pendant l’hospitalisation. Des données démographiques ainsi que des données cliniques, radiologiques et de suivi ont été compilées.
Le diagnostic du SAA a été établi par tomodensitométrie (TDM) avec et sans amélioration du contraste. Les études d’imagerie de suivi subséquentes ont été effectuées avec tomodensitométrie et / ou résonance magnétique (MR).
Tous les patients étudiés ont reçu un traitement médical orienté vers un contrôle strict de la pression artérielle (TA ≤120/80 mm Hg), qui comprenait des bêta-bloquants dans tous les cas, sauf lorsqu’il y avait des contre-indications à ce traitement.
RÉSULTATS
Au cours de la période d’étude, 95 patients avec un diagnostic de SAA ont été admis dans notre centre. Douze (25.6%) de ces patients présentaient une HIM (4 de type A et 8 de type B). Trois patients atteints d’IMH ayant reçu un traitement anticoagulant pendant leur hospitalisation (un avec une IMH de type A et 2 avec une IMH de type B) font l’objet de ce rapport.
Les caractéristiques cliniques et les principales informations démographiques des patients atteints d’IMH ayant reçu une anticoagulation sont décrites ci-dessous et présentées dans le tableau.
Cas 1
Un homme de 79 ans souffrant d’hypertension mal contrôlée malgré un traitement pharmacologique et une fibrillation auriculaire chronique. Les antécédents cliniques du patient comprenaient un épisode d’embolie artérielle dans le membre supérieur droit 5 ans auparavant, qui avait été traité par anticoagulation orale. Il a été admis pour une douleur intense d’apparition soudaine dans la région interscapulaire, qui irradiait vers l’abdomen et s’accompagnait d’une transpiration abondante et de vertiges. La tomodensitométrie effectuée dans l’unité d’urgence a identifié une IMH de type B qui s’étendait de l’origine de l’artère sous-clavière gauche à la bifurcation aorto-iliaque et affectait les premiers centimètres de l’artère iliaque commune gauche (Figure 1). Au moment de l’admission, le patient a été traité par perfusion de labétalol et de nitroprussiate et l’anticoagulation a été interrompue. Après l’arrêt de ce traitement, le patient a présenté un nouvel épisode d’embolie artérielle dans le membre supérieur gauche nécessitant une embolectomie. Pour cette raison, une anticoagulation a été établie, d’abord avec de l’héparine sodique et plus tard avec de l’acénocoumarol.
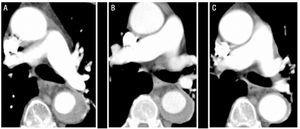
Figure 1.Évolution radiologique de l’hématome intramural aortique de type B (IMH) chez le patient 1. Les tranches de tomodensitométrie en série au niveau de la bifurcation de l’artère pulmonaire montrent une diminution progressive de l’épaisseur de la lésion et une résolution finale. A : Épaisseur d’IMH au moment du diagnostic. B : épaisseur au premier suivi CT (2 semaines d’évolution). C: Épaisseur IMH à 2 mois.
Cas 2
Un homme de 72 ans souffrant d’hypertension de longue évolution sous traitement pharmacologique, et ayant des antécédents de fibrillation auriculaire chronique, pour laquelle il recevait de la digoxine et de l’acénocoumarol. Il est venu à notre centre pour une douleur oppressante à la poitrine moyenne d’apparition soudaine qui irradiait vers le dos. La tomodensitométrie initiale a montré une IMH de type A avec implication de l’aorte ascendante, de l’arc aortique et de l’aorte descendante jusqu’à l’origine de l’artère mésentérique supérieure. L’anticoagulation a été interrompue. Pendant l’hospitalisation, le patient a présenté un épisode de perte de conscience avec hémiparésie gauche, dont il s’est rétabli sans séquelles. La tomodensitométrie cérébrale n’a montré aucun signe d’ischémie ou d’hémorragie intracrânienne; par conséquent, l’épisode a été interprété comme un accident ischémique transitoire d’origine embolique. En raison de cette complication, le traitement anticoagulant par héparine de sodium en perfusion suivi d’acénocoumarol a été repris pendant l’hospitalisation.
Cas 3
Un homme de 73 ans, fumeur, souffrant d’insuffisance rénale chronique et d’antécédents d’hypertension de longue évolution; il souffrait de fibrillation auriculaire chronique et recevait un traitement antiplaquettaire. Le patient est venu à notre hôpital pour une douleur interscapulaire sévère irradiant sur les deux flancs. La tomodensitométrie initiale a établi le diagnostic d’hématome intra-muros de type B confiné à l’aorte thoracique descendante. Dans le segment distal de l’hématome, une image en forme de larme (projection en forme d’ulcère) a été vue dans l’hématome (figure 2). Bien que le patient n’ait jamais eu d’épisode d’embolie, un traitement anticoagulant a été commencé à l’admission en raison de son profil de risque embolique élevé.
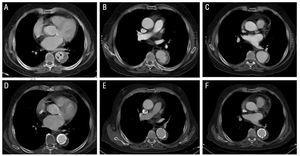
Figure 2. Évolution radiologique de l’hématome intramural aortique de type B (IMH) chez le patient 3. Panneau supérieur : images au diagnostic (A) et pendant le suivi (B et C). R: observez l’image en forme de larme (projection en forme d’ulcère) dans l’IMH (flèches). B : dissection localisée pendant le suivi (2 mois plus tard). C : dilatation progressive du diamètre aortique. Panneau inférieur: images à 5 mois après le diagnostic (D-F). La dilatation progressive de l’hématome dicte l’implantation de deux endoprothèses.
Suivi radiologique
Le diamètre aortique maximal et le diamètre IMH maximal au moment du diagnostic, ainsi que l’évolution de la lésion chez chaque patient sont indiqués dans le tableau.
Au cours du suivi radiologique, tous les patients ont montré une diminution progressive de l’épaisseur de l’IMH. Chez les patients 1 et 2, le diamètre maximal de l’IMH au moment du diagnostic était respectivement de 17,6 et 7 mm. Lors de l’étude de suivi CT de 2 semaines, les diamètres étaient respectivement de 13 et 4,6 mm.
Chez le patient 3, l’épaisseur de l’IMH était de 14 mm lors de la tomodensitométrie initiale et de 11,5 mm lors du scanner de suivi. De plus, le patient a présenté une image en forme de déchirure à l’extrémité distale de l’IMH, qui mesurait 4×??6 mm au moment du diagnostic. Certains auteurs ont interprété cela comme un signe indiquant un ulcère aortique (projection en forme d’ulcère). Après la sortie de l’hôpital, le patient a développé une dissection localisée avec dilatation progressive ultérieure du segment aortique affecté (pseudoanévrisme) qui a nécessité l’implantation de 2 endoprothèses (Excluder 34×??10 mm et 40 ??× 10 mm). L’évolution ultérieure a été favorable (Figure 2).
DISCUSSION
Au cours de la période étudiée, 3 patients atteints d’IMH ont reçu un traitement anticoagulant. Bien que l’IMH soit une lésion hémorragique, l’évolution clinique et morphologique a été favorable dans ce sous-groupe de patients, avec régression progressive de la taille de la lésion dans les évaluations radiologiques de suivi, malgré le fait qu’une anticoagulation ait été administrée. Le patient 3 a développé une complication au cours du suivi dans un segment de l’aorte dans lequel la lésion initiale peut avoir été un ulcère aortique pénétrant (PAU). Néanmoins, l’hématome a d’abord subi des modifications similaires à celles observées chez les deux autres patients, avec une diminution progressive du diamètre au cours de la phase aiguë. Le rôle que l’anticoagulation a pu jouer dans la pathogenèse et l’évolution vers un pseudoanévrisme est difficile à établir.
Il n’existe pas de données définitives dans la littérature scientifique concernant l’utilisation de l’anticoagulation chez les patients atteints de SAA, bien que l’arrêt de ce traitement soit une pratique courante. Il est probable que l’anticoagulation ne modifie pas l’évolution naturelle de l’IMH. Trois arguments soutiennent cette hypothèse: a) Étant donné que l’hémostase n’a pas de rôle majeur dans la pathogenèse de la lésion, il est peu probable qu’elle ait un impact sur sa résolution; b) L’IMH est une affection confinée à l’intérieur de la paroi aortique et n’est pas en contact avec la lumière du vaisseau, il est donc peu probable que l’anticoagulant pénètre dans la lésion; et c) les études épidémiologiques n’ont pas montré une incidence plus élevée d’IMH chez les patients présentant des perturbations congénitales ou acquises des composants de l’hémostase.
Nous concluons que dans les situations où une anticoagulation est nécessaire (patients à haut risque d’embolie) ce traitement peut être maintenu, sur la base des résultats de cette étude dans laquelle l’anticoagulation ne semblait pas avoir d’impact sur l’évolution clinique ou morphologique de l’IMH. Naturellement, d’autres études avec des séries de patients plus importantes sont nécessaires pour tirer des conclusions définitives.