a biológiai olajok molekuláris szerkezetében és tulajdonságaiban különböznek a kőolajoktól (“normál” dízelüzemanyag).

a közönséges kőolaj dízelüzemanyag egyszerű szénhidrogének keveréke, átlagos kémiai képlete C12H23 (alább látható), de az összetevők körülbelül a c10h20 (dodekán) nak nek c15h28(pentadekán). Ezzel szemben a biológiai olajok “trigliceridek” (“észtereknek” minősülnek), mint például az alább látható gliceril-trilinoleát:
| C12H23, dodekán | a triglicerid: gliceril-trilinoleát |
nagy méretük és ennek következtében nagy intermolekuláris vonzerők miatt a biológiai olajok viszkozitása általában túl magas a hagyományos dízelmotorokban való felhasználáshoz. A biológiai olajok szintén kevésbé könnyen égnek, koromosabb lánggal, mint a kőolaj-dízel. A biológiai olajokat hagyományos dízelmotorokban lehet használni, ha előmelegítik viszkozitásuk csökkentése érdekében, de ehhez kiegészítő elektromos fűtőberendezésre van szükség, amíg a motor felmelegszik. Ezekhez a rezonokhoz a bilogikus olajok biodízelként történő felhasználáshoz feldolgozást igényelnek.
a biológiai olaj egy észter, amely egy olyan típusú szerves vegyület, amelynek atomkötése alább látható.
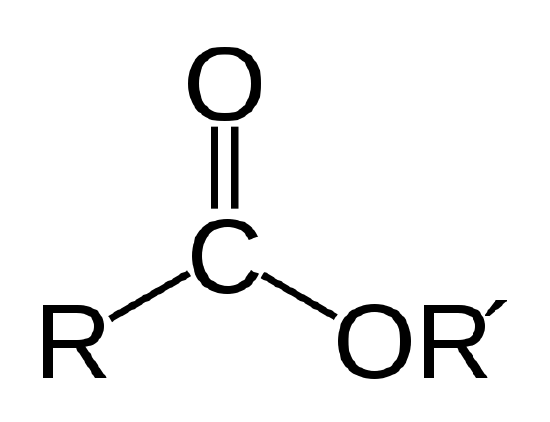 az észter kapcsolat. Az R és R ‘ szén-és hidrogénatomláncokat jelöl. R = -CH3 és R’ = -c18h35o2 az 1.példában szereplő metil-sztearát esetében |
glicerin |
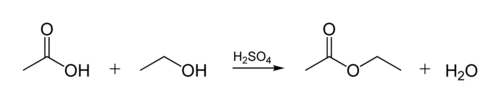
a biológiai olajok észterkötése akkor jön létre, amikor a glicerin molekula reagál szerves savakkal. A glicerinmolekula 3 szénatomból álló lánccal rendelkezik, mindegyiken an-OH (alkohol) csoport található. Az alábbi ábra azt mutatja, hogy egy szerves alkohol hogyan reagál egy szerves savval. A szerves vegyészek rövidítik a molekuláris struktúrákat-az ábrán látható” cikk-cakk ” vonalak szénláncokat képviselnek, mindegyik “cikk-cakk” vagy “cikk-cakk”atommal. Minden szénnek 4 kötése van, és ha kevesebb, mint 4 látható, akkor feltételezzük, hogy H atomokhoz mennek. Tehát az alkohol C2H5OH (etanol), a sav pedig ecetsav (vagy etánsav, CH3COOH) az ábrán:
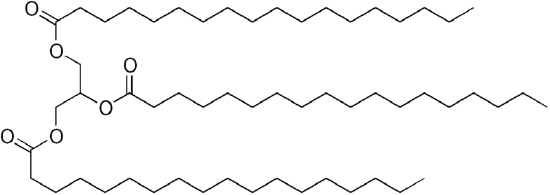
mivel a glicerin 3-OH csoportot tartalmaz, 3 hosszú láncú szerves “zsírsav” kapcsolódik a terjedelmes “triglicerid”előállításához.
de ugyanolyan egyszerűen, mint az észterek alkoholokból és savakból készülhetnek, alkoholokat vagy savakat is cserélhetnek. Erős báziskatalizátor, például NaOH jelenlétében a triglicerid reagálhat 3 kis alkoholmolekulával, például metanollal (CH3OH), amelyek helyettesítik a glicerin “gerincét”, így 3 különálló, kisebb molekulatömegű észter keletkezik
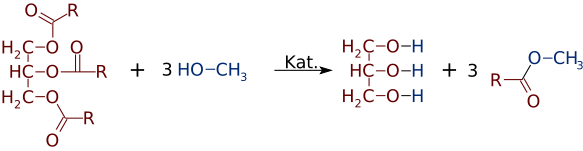
gyakran két vagy több termék keveréke képződik. Például, amikor egy növényi olaj reagál metanollal, a savak közül csak egy vagy kettő elmozdulhat a glicerinből, csak 1 vagy 2 Fame-t eredményezve.
C3H5(C18H35O2)3 + NaOH + 2 KH3OH CA3O(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 KH3OH CA3O(C18H35O2)(OH)2 + 1 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 3 CH3OH, C3H5(OH)3 + 3 C17h35cooch3
általában nagy mennyiségű metanolt és nátrium-hidroxidot adnak hozzá, így a reakció a maximális Fame-mennyiséget eredményezi.
de átészterezés esetén, annak ellenére, hogy a reagensek egyikét sem fogyasztják el teljesen, a termékek mennyisége nem növekszik tovább. Azt mondjuk, hogy egy ilyen reakció nem fejeződik be. Ha termékek keverékét állítják elő, vagy a reakció nem fejeződik be, a reakció hatékonyságát általában a kívánt termék százalékos hozamában értékelik. Az elméleti hozamot úgy számítjuk ki, hogy feltételezzük, hogy az összes korlátozó reagens termékké alakul. A kísérletileg meghatározott terméktömegeket ezután összehasonlítjuk az elméleti hozammal, és százalékban fejezzük ki:

1.példa amikor 100,0 g C3H5(C18H35O2)3 gázt és 15,0 g CH3OH-t összekeverünk NaOH katalizátorral 55 Ca-n, 90,96 g c17h35cooch3 metil-sztearát biodízelt kapunk. Számítsa ki a százalékos hozamot.
megoldás ki kell számolnunk az NH3 elméleti hozamát, és ehhez először fel kell derítenünk, hogy N2 vagy H2 A korlátozó reagens. A kiegyensúlyozott egyenlet
c3h5(C18H35O2)3 + NaOH + 3 CH3OH ~ C3H5(OH)3 + 3 C17H35COOCH3 sztearin + nátrium-hidroxid + 3 CH3OH ~ glicerin + 3 metil-sztearát
a reagensek sztöchiometrikus aránya
 most, a két reagens kezdeti mennyisége aés
most, a két reagens kezdeti mennyisége aés  A kezdeti összegek aránya tehát
A kezdeti összegek aránya tehát mivel ez az arány kisebb, mint
mivel ez az arány kisebb, mint  , a CH3OH feleslege van. A sztearin a korlátozó reagens. Ennek megfelelően 0,1122 mol sztearint és 0,3366 mol CH3OH-t kell használnunk (0 helyett.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, a CH3OH feleslege van. A sztearin a korlátozó reagens. Ennek megfelelően 0,1122 mol sztearint és 0,3366 mol CH3OH-t kell használnunk (0 helyett.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.