az első biológiai gyógyszer, a humanizált inzulin (5,8 kDa) 1982-ben vált elérhetővé a biotechnológia megjelenése után, és új korszakot jelentett a gyógyszeriparban. A biotechnológia modern fejlődése lehetővé teszi a biológiai anyagok nagyszabású szintézisét többé-kevésbé költséghatékony módon. Miután egyszer nagy peptidekkel és rekombináns fehérjékkel kezdték, a biológiai anyagok manapság számos más entitást tartalmaznak, például antitesteket, monoklonális antitesteket, újabban nanotesteket és kapcsolódó tárgyakat, oldható receptorokat, rekombináns DNS-t, antitest-gyógyszer konjugátumokat (ADC), fúziós fehérjéket, immunterápiát és szintetikus vakcinákat.
a biológiai gyógyszerek’ emelkedő csillaga ‘ egyre nagyobb figyelmet szentel a gyógyszeripari szakembereknek és az iparági elemzőknek, mivel ez az alternatív gyógyszerfelfedezési paradigma jelentős üzleti kihívást jelent a hagyományosabb kis molekulájú gyógyszerfelfedezési paradigma számára, amely több mint egy évszázada meghatározza a gyógyszeripart.
tehát felmerül a kérdés: vajon a kis molekulák elveszítik-e a “vonzerejét”, mint a kábítószer-felfedezés kutatási tárgyait a biológiai fejlődés modern világában? Egyes szakértők továbbra is optimisták azzal kapcsolatban, hogy a kis molekulák vezethetik-e a versenyt a jövőbeni gyógyszervezetékekben, mások úgy vélik, hogy “a pénz zsebeket vált”, és a kismolekulák kutatását a részvényesek és a befektetők egyre inkább elhanyagolják a biológia javára.
annak érdekében, hogy kitaláljuk, hol tart az ipar, először kezdjük egy kis statisztikával. 7 év alatt (2010-2017) U. S. A Food and Drug Administration (FDA) összesen 262 új molekuláris entitást (NMEs) hagyott jóvá, kivéve számos diagnosztikai képalkotó szert és 1 inzulinanalógot (ref). Úgy tűnik, hogy 76% – uk kis molekulák (199), csak egynegyedük biológiai. Érdekes módon, nincs nyilvánvaló növekedés a biológiai NMEs jóváhagyásokban a kis molekulákhoz képest, mivel a terápiák mindkét kategóriája meglehetősen hasonló módon alakul, amint az az alábbi ábrán látható. Mivel azonban a biológiai anyagok ára nagyon különbözik a kis molekulákétól (ezek sokkal drágábbak), a kép más, ha a teljes árbevétel és a bevétel növekedését nézzük: a 2011 és 2017 közötti időszakban a biológiai árbevétel 70% – kal nőtt, elérve a 232 milliárd dollárt. A teljes gyógyszerpiac biológiai részesedése 16% – ról 2006-ban 25% – ra nőtt 2016-ban, a lassulás nyilvánvaló jelei nélkül (ref).
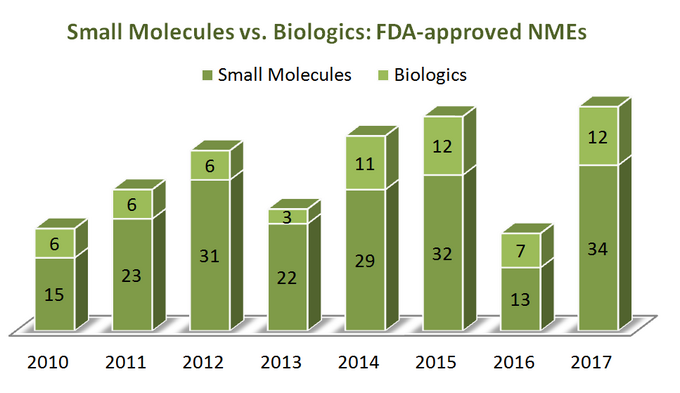
bár a biológiának számos megkülönböztető előnye van a kis molekulákkal szemben (például mély szelektivitásuk), a dolgok nem” fekete-fehér”, amikor a terápiák e két kategóriáját tulajdonságaik alapján hasonlítják össze, mivel mindkettőnek jelentős előnyei és hátrányai vannak a stratégiai döntéshozatal során. Tehát kissé sajnálatosnak tűnik látni, hogy számos jelentés félretette az SMs-t a biológiához képest a nézőpontjuk “frissességének” elérése érdekében.
az alábbi táblázat összefoglalja mindkét kategória erős és gyenge aspektusait (ref, ref), bemutatva a két “táborban” elérhető kihívásokat és lehetőségeket (megjegyzés színek: szürke – nincs nyilvánvaló előny egyik táborban sem; zöld-előnyös helyzet; sárga-hátrányos helyzet):
kis molekulák |
|
|---|---|
|
általános tulajdonságok |
|
|
alacsony molekulatömeg (0,1 – 1 kDa); általában kémiailag és termikusan stabil, széles polaritástartomány. |
nagyon nagy molekulatömegű > 1 kDa; általában poláris, hőre érzékeny, könnyen lebomlik (néhány hosszú élettartamú típus kivételével, mint például a monoklonális antitestek) |
|
szelektivitás, biztonság |
|
|
inkább kuszált, általában kötődnek a különböző off-cél helyek, rendering mellékhatások vagy toxicitás. végül a biológiai fejlesztőknek könnyebb volt a szabadalmak megszerzése, mert kevés vagy egyáltalán nem volt korszerű a területen, amikor felfedezték a jelenlegi kasszasikereket. |
nagyon specifikus a célpontokra, általában alacsonyabb toxicitású (egy fő kivétel az immunogenitás, amely súlyosan befolyásolhatja a biológiai anyagok hatékonyságát, biztonságosságát és diszpozícióját). |
|
Sejtpermeabilitás |
|
|
SMs kötődés olyan célokkal, mint a G-fehérjéhez kapcsolt receptorok (Gpcr-ek), ligandumhoz kötött ioncsatornák és receptor tirozin kinázok az extracelluláris vagy intracelluláris domének. Elérhetik az intracelluláris régiók célpontjait, a citoszolokat, a magokat, sőt a központi idegrendszeri célpontokat is, amelyeket a szoros vér-agy gát (BBB) választ el egymástól. |
a farmakológiai célpontok nagy része be van ágyazva, ezért a biológiai anyagok számára hozzáférhetetlen. Különösen, amikor a központi idegrendszerről (CNS) van szó, a vér-agy gát jelenléte jelentős akadályt jelent a 600 Da-nál nagyobb molekulák útján, amelyek korlátozzák az SMs 98% – át és gyakorlatilag az összes biológiai anyagot. |
|
szállítás |
|
|
nagyrészt az “ötös szabály” alá tartoznak az orális felszívódás szempontjából, így alkalmasak az orális szállításra. Az intestinalis epitheliumon keresztüli további permeabilitást elsősorban a passzív diffúzió és a paracelluláris transzport kombinációja közvetíti. |
a belső instabilitás és a nagy molekulatömegek szinte az összes biológiai anyagot orálisan inaktívvá teszik. Többnyire invazív szállítás, vagy alternatív, nem invazív technológiák folyamatban. |
|
Eloszlás |
|
|
Az SMs-ek a vérkeringésen keresztül kerülnek elosztásra, lehetővé téve a pick koncentrációk gyors elérését. |
nagyobb molekulák esetén (pl. > 10 kDa) a lassabb (100-500-szor) nyirokrendszer dominál az eloszlási folyamatban. A nagyobb biológiai anyagok mind a vér, mind a nyirokrendszeren keresztül terjednek, mozgó konvektív transzport, receptor által közvetített endocitózis, fagocitózis és pinocitózis. Ennek a helyzetnek az az eredménye, hogy a nagyobb biológiai anyagok felezési ideje hosszabb, eloszlási térfogata korlátozott, és több időre van szükségük a csúcskoncentrációk eléréséhez, mint az SMs. |
|
diszpozíció (metabolizmus) |
|
|
a legtöbb SMs-t nem célzott szervek ártalmatlanítják-citokróm vagy nem citokróm metabolizmusokon, vese szűrésen vagy székletürítésen keresztül. |
a biológiai anyagok szorosabb kölcsönhatásban vannak a célpontokkal, így diszpozíciójukat közvetlenül befolyásolja a kötésük (receptor által közvetített gyógyszer diszpozíció), beleértve a biológiai anyagok proteázok és peptidáz általi távolságát. |
|
Gyógyszerkölcsönhatások |
|
|
Az SMs-ek hajlamosak olyan gyógyszerkölcsönhatásokra, amelyek egyidejű gyógyszerek jelenléte miatt fordulhatnak elő, amelyek befolyásolják a transzportot, anyagcserét, transzportot vagy eliminációs utakat. |
a biológiai szerek kevésbé hajlamosak a hagyományos gyógyszerkölcsönhatásokra, mivel endogén szubsztrátként metabolizálódnak és eliminálódnak. Vannak azonban dokumentált citokin által közvetített változások a gyógyszer metabolizáló enzimjeiben, ezért gyógyszer-biológiai kölcsönhatásokat kell értékelni abban az esetben, ha a gyógyszer befolyásolhatja a metabolikus enzimek expresszióját. |
|
üzleti szempontok |
|
|
alacsony árak SM gyógyszerek. |
jellemzően nagyon magas árak biológiai kezelések. Ez az egyik oka annak, hogy a biológusok úgy tűnik, hogy az SMs-hez képest jobb általános gazdasági megtérülést nyújtanak. |
|
magas kopási arány (a KMR Csoport 2009-es tanulmánya azt mutatta, hogy a preklinikai tesztekbe belépő SMs-eknek csak 7,1% – A jutott el végül a piacra). |
viszonylag alacsony lemorzsolódási arány (ugyanaz a KMR csoportos vizsgálat kimutatta, hogy a preklinikai stádiumú biológiai anyagok 24,4% – a túlélte a piaci stádiumot). |
|
Severe competition from chemical generics after patents expiration. |
Biologics developers face less severe competition from biosimilars, after patents expiration. |
|
Simpler drug discovery/development process. |
More expensive and complex drug discovery and development process, compared to biologics. |
a fenti összehasonlítást figyelembe véve nyilvánvalóvá válik, hogy a biológia nem “mágikus golyó”, és az iparágat a belátható jövőben nem a biológia uralja, hanem versenyképes egyensúly marad fenn a kis molekulák, a biológiai és a hibrid terápiás formák között, mint például az ADC-k-a az egyes formák helyi dominanciája megfelelőbb terápiás területeken, felhasználási esetekben stb.
továbbá az alábbiakban felsoroljuk azokat a számos iparági vezetőt, amelyek a kis molekulák oldalán játszanak, és befolyásolhatják a teljes gyógyszerpiac hatalmi egyensúlyát a kémiai kiindulási pontok javára:
a mesterséges intelligencia (AI) növekedése a kábítószer-felfedezésben
a deep learning algoritmusok áttöréseit követően (2012) és újabban a generatív kontradiktórius hálózatok (Gan-k) létrehozása, amelyek számos kutatási feladatban képesek kitűnni, a különböző AI technológiák iránti érdeklődés az egekbe szökött a különböző kutatási feladatokban sok minden iparágban. Számos AI-alapú eszköz gyorsan kereskedelmi mainstreamré vált, mint például a chatbotok, a személyes asszisztensek, az autopilotok stb.– ami az AI megvalósíthatóságának valós bizonyítéka.
a kábítószer-felfedezés nem kivétel ez alól az “AI-vezérelt trend” alól, és az AI-t különböző módon népszerűsíteni próbáló startupok száma alig néhány év alatt jelentősen megnőtt, eddig több mint száz aktív vállalatot ért el (itt van egy lista néhány közülük).
érdekes, hogy az AI-vezérelt startupok többsége a kis molekulák gyógyszerfelfedezésére összpontosít, nem pedig a biológiára, ami valószínűleg nem meglepő. Történelmileg még a nem AI számítási módszereket (keminformatika) is elsősorban a kis molekulájú terápiákhoz használták, lényegesen egyszerűbb molekuláris szerkezetük és interakciós mintáik miatt.
az alábbi ábra 61 aktívan forgalmazott gyógyszerfelfedező startup becsült statisztikáját mutatja be, amelyek speciális AI-eszközöket fejlesztenek vagy alkalmaznak kutatási munkafolyamatukban. Mint látható, a vállalatok fele (51%, 31 induló vállalkozás) a kis molekulákra összpontosít, míg csak 23% (14 induló vállalkozás) vesz részt biológiai gyógyszerek (antitestek, oltások stb.) felfedezésében/fejlesztésében. A kis molekulákkal szembeni aránytalanságot jól szemlélteti a kockázatitőke-finanszírozás összege is, amelyet 61 felülvizsgált AI-vezérelt startup gyűjtött össze (csak nyilvánosan közzétett körök) – ahol 770 milliót fektettek be a kis molekulákkal foglalkozó vállalatokba, és csak valamivel több mint 200 milliót különítettek el a biológiai központú startupok számára-az alábbiak szerint.
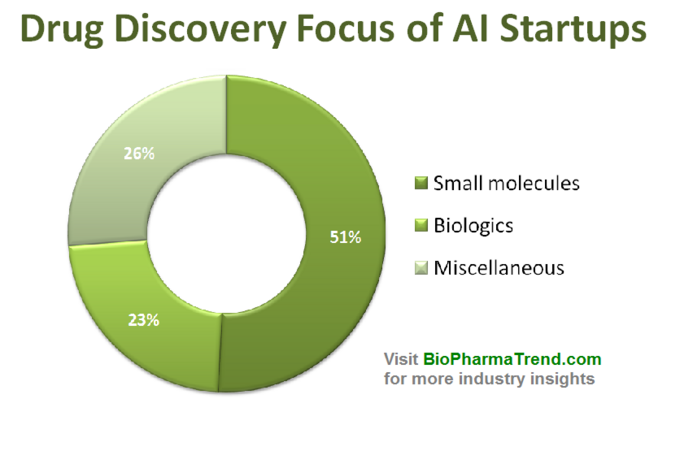
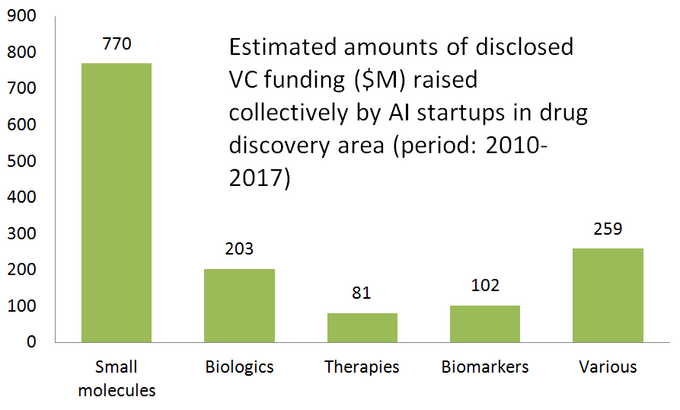
Ez a helyzet azt sugallja, hogy az AI algoritmusok legújabb fejlődése és a gépi tanulás alkalmazásának tendenciája a korai stádiumú gyógyszerkutatásban általában nagyobb növekedést eredményez a kis molekulájú gyógyszerfelfedezésben, mint a biológiai felfedezésben-legalábbis egyelőre. Ez további jövőbeni beruházásokhoz vezethet az AI-vezérelt technológiák által támogatott kis molekulára összpontosító projektekbe.
“nem dobható” célok elérése
az olyan fontos célokat, mint például a fehérje-fehérje kölcsönhatások (PPI-k), hagyományosan a biológiai anyagok (MAB-k) dominálnak, mint potenciális szereplők, míg a kis molekulákat ebben az esetben kis méretük miatt régóta alkalmatlannak tartották.
a farmakogenomika fejlődésével ez a helyzet meglehetősen gyorsan megváltozhat a maravirok (514 Da) és a tirofiban (441 Da) jóváhagyását követően. Számítástechnikai szempontból kiderült, hogy az SMs-ek valójában viszonylag nagy affinitással rendelkezhetnek a fehérjék specifikus interfészeivel, és ami a legfontosabb, képesek modulálni a komplex rendszerbetegségekhez kapcsolódó ‘eredendően rendezetlen fehérjerégiókat’. Itt van egy érdekes fedezze fel ezt a témát összefoglalva néhány fontos betekintést PPI gépek kapott az elmúlt évtizedekben.
a kis molekulájú gyógyszer felfedezésének másik gyorsan növekvő területe a ribonukleinsav (RNS) megcélzása. Ezt a témát a “Top 7 trends in Pharmaceutical Research In 2018” című cikkben sorolták fel, és a C&EN című cikkben részletesen áttekintették a Sejtkémiai Biológia témáját és egy szép iparági lefedettséget.
egy másik új ötlet a kis molekulák erejének felszabadítására a C& EN 2018-ban megjelent cikkekben tárgyalt. A stratégia itt az, hogy olyan bifunkcionális kis molekulákat fejlesszenek ki, amelyek képesek egy célzott fehérjét teljesen a proteaszómába, a sejt szemételtávolító gépébe irányítani, ahelyett, hogy csak gátolnák a fehérje hatását, mint a ‘hagyományos’ megközelítésben.
A szűrési technológiák korlátainak leküzdése
a kis molekulák sok kutatási potenciálja még nem valósult meg a szűrési megközelítések különböző technológiai korlátai miatt, amelyeket a gyógyszerfelfedezési programok kiindulási pontjainak azonosítására használnak.
az egyik ilyen példa a fenotípusos szűrési megközelítés, amely manapság reneszánszát éli számos technológiai fejlődés miatt, beleértve a fiziológiailag releváns sejtmodellek, leolvasások és kifinomult detektálási technológiák fejlesztésének növekvő képességét, amelyek segítenek feltárni hatásmechanizmusok (MoA) hatékonyabban, minimalizálva a bizonytalanságot. Másrészt a nagyszabású profilozási technikák és számítási módszerek megvalósítása új szintű rendszerelemzést és a kis molekulájú fenotípusok megértését kínálja.
egy másik ígéretes szűrési paradigma a DNS-kódolt könyvtárak (DELs) használata. Egyedülálló elrendezésének köszönhetően a DEL technology megfelelő módszert kínál új molekulák százmillióinak, sőt milliárdjainak tesztelésére a célalapú gyógyszerfelfedezési programokban. Bár ez a technológia nem mentes a kihívásoktól (pl. a DNS-kompatibilis kémia korlátai, bizonytalanság a szűrővizsgálatokkal stb.), a terület gyorsan növekszik, sőt forradalminak tekintik a kis molekulájú gyógyszerek felfedezésében.
A szintetizálhatóság gátjának leküzdése
a korai stádiumú kis molekulájú gyógyszer felfedezésének egyik botladozó köve a szintetikusan hozzáférhető kémiai tér korlátozása-bár sok ígéretes kémiai ötlet előállítható számítási úton vagy más módon, mindig fennáll annak a veszélye, hogy az ilyen ötletek validálásához szükséges vegyületek teljes készletének szintetizálása költséges vagy akár megvalósíthatatlan lenne.
Ezen a területen újabb előrelépések történtek, ismét AI-alapú szoftver használatával, amely emberi szintű szintézis tervezési teljesítményt kínál. Például a BenevolentAI nemrégiben publikált egy cikket a Nature – ben, amelyben leírta, hogyan használták a mély neurális hálózatokat a modern fa Keresési algoritmusokkal kombinálva, hogy megtervezzék az új molekulák szintézisét figyelemre méltó sikerességgel és sebességgel.
Derek Lowe számos érdekes, gazdag kommentárral ellátott borítót tett közzé, amelyek egy kicsit több betekintést nyújtanak a szerves és gyógyászati kémia lenyűgöző területébe.
egy empirikusabb stratégiát dolgozott ki egy kémiai gyártó, az Enamin, amely valódi kémiai térként ismert, és jelenleg több mint 3-at tartalmaz.8 milliárd szintetikusan hozzáférhető és kereshető molekula a hit kutatásához és más Gyógyszerkémiai feladatokhoz. A koncepció abból áll, hogy házon belüli validált kémiai útvonalakat (több mint 100 reakciót) alkalmaznak a saját készletben rendelkezésre álló kémiai építőelemek nagy készletére (több mint 100 ezer vegyület)-azzal a céllal, hogy kombinatorikusan kombinálják őket, hogy nagyobb “ólomszerű” vagy “gyógyszerszerű” molekulák kaszkádját hozzák létre. Miután egy bizonyos fokú reprodukálhatóság és hozam érhető el egy elég nagy számú kísérlet (legalább 80%), egy további számítási felsorolás kerül sor, hogy létrejöjjön egy szélesebb kémiai tér alapján a kísérletileg validált esetek.
New r& d a kis molekulák piacai és szerepei
mindent összevetve, figyelmen kívül hagyhatjuk vagy félreérthetjük a kis molekulák csővezetékeinek méretét és növekedési potenciálját, amint azt az Interphex panelbeszélgetése során említettük. Jelenleg körülbelül 8000 kis molekula aktív az R&D-ben, ami 25% – os növekedést jelent az elmúlt néhány évben. A fent felsorolt növekedési mozgatórugók további gyorsuló növekedést eredményezhetnek ebben az ágazatban.
fontos megjegyezni azt is, hogy a kis molekulájú gyógyszerek fontos szerepet játszhatnak egyes következő generációs gyógyszerekben, így kis molekulájú csővezetékekre támaszkodhatnak. Például őssejt-terápia esetén a kis molekulák terápiás reakciókat válthatnak ki.
amint azt a Cphi Észak-Amerikában a MilliporeSigma Jeffrey Shumway kiemelte, a kis molekulájú termékek egyre összetettebbé válnak, megváltoztatva a (bio)gyógyszeriparban betöltött szerepüket.
végül a kis molekulák jövőbeli területe az antitest-gyógyszer konjugátumok és a kapcsolódó tárgyak, amelyek ígéretes terápiás osztályként jelentek meg két gyógyszerfelfedezési paradigma és a többszörös technológiai trendek természetes konvergenciája miatt.
jogi nyilatkozat: Az információ csak az általános tudatosságot szolgálja, és nem jogi/pénzügyi/tőzsdei / orvosi tanácsadás. Ön saját akaratából olvassa el, és ezen információk bármilyen felhasználása a saját felelősségére történik. Az Ön felelőssége, hogy értékelje az ebben a bejegyzésben szereplő információk hasznosságát és biztonságát, és általában az internetet, valamint azt, hogy ezek hogyan vonatkoznak az Ön saját helyzetére, majd szükség esetén konzultáljon az illetékes szakértőkkel szakmai tanácsadásért.
témák: ipari trendek