- Gazdaspecifikus kölcsönhatás a Rhizobium és a növényi partnerek között
- Determinate and Indeterminate Nodulus Development
- A szimbiotikus sejtek növekedése magában foglalja a gazdaszervezet amplifikációját Endoreduplikációs ciklusokkal
- A nitrogénmegkötő bakteroidok különböző sorsai
- A Gazdapeptidek szabályozzák a Bakteroid differenciálódást
- NCR247: egy példa a Multi-Target Host effektor
- következtetés
- összeférhetetlenségi nyilatkozat
- elismerések
Gazdaspecifikus kölcsönhatás a Rhizobium és a növényi partnerek között
azokat a baktériumokat, amelyek nitrogénmegkötő szimbiózist képeznek a különböző csoportokba tartozó hüvelyes növényekkel, amelyek a különböző csoportokba tartoznak., 2003; MacLean et al., 2007). Sok anti-proteobaktérium hosszú távú kölcsönhatásban áll a magasabb eukariótákkal. Ezek az interakciók a felszíni kolonizációtól a fakultatív szimbiotikus kapcsolatokon át az intracelluláris kórokozó vagy az endoszimbiont életmód kötelezővé tételéig terjednek. A gócképződéshez, a gazdasejt fertőzéshez és a nitrogénkötéshez szükséges szimbiotikus géneket laterális géntranszfer útján szerezték meg, amely a rhizobia genetikai sokféleségének elsődleges forrása. Ezért a rhizobia szorosabban kapcsolódhat a kórokozókhoz (például Agrobacterium vagy Brucella), mint egymáshoz. A Rhizobia általában nagy genomokkal rendelkezik (legfeljebb 10.5 Mbp), amelyek gyorsan növekvő rhizobiában több replikonon diszpergálódnak (MacLean et al., 2007). Például a Sinorhizobium meliloti, a Medicago Fajok endoszimbionta, három részből álló genommal rendelkezik; egy 3,65 Mbp kromoszóma és két megaplasmid, a pSymA és a pSymB (1,35 és 1,68 Mbp) mindkettő nélkülözhetetlen és a szimbiotikus gének többségét hordozza. Azonban sok S. meliloti törzs tartalmaz további kiegészítő közepes méretű plazmidokat, így az S. meliloti Genom akár 9000 gént is tartalmazhat (Barnett et al., 2001; Capela et al., 2001). A rhizobiával ellentétben a rovarok obligát endoszimbiontjai általában erősen redukált (160-450 Kbp) genommal rendelkeznek, amely biztosítja szaporodásukat és kódol néhány specifikus bioszintetikus utat, beleértve azokat is, amelyek kielégítik a gazda szükségletét (Moran et al., 2008; Price et al., 2011). Ezek a hihetetlenül redukált genomok mindazonáltal amplifikálódnak, kompenzálva a csökkent genomot poliploid DNS-tartalommal.
a rhizobia növényi Partnerei a Leguminosae/Fabaceae családba tartoznak. A nitrogénmegkötő szimbiózis több nemzetségben fejlődött ki, de nem minden hüvelyes alkot szimbiózist. Eddig 12 000 csomós hüvelyes faj ismert, és mindegyiknek megvan a saját Rhizobium partnere(I). A szimbiózist a gazdanövény nitrogén éhezése váltja ki, amelynek a Rhizobium partnerét a rizoszférában lévő baktériumok milliárdjai közül kell kiválasztania. Ezt a gyökérből származó flavonoid szignálmolekulák szekréciójával érik el, amelyek kemo-attraktánsként működnek, de ami a legfontosabb, mint a Rhizobium nodulációs gének induktorai (Oldroyd, 2013). Ezek a gének szükségesek a bakteriális szignálmolekulák előállításához; a bólintási tényezők (NFs), amelyek elindítják a csomópont-fejlesztési programot a gazdanövényben (Walker and Downie, 2000). Az NFs olyan lipochitooligoszacharid molekulák, amelyek gazdaspecifikus szubsztitúciókat hordoznak a terminális cukormaradványokon és a jellegzetes lipidláncokon, amelyeket a LysM-típusú gazdareceptorok felismernek, és mind a csomók kialakulásához, mind a bakteriális fertőzéshez szükségesek. Érdekes módon az arbuszkuláris mikorrhiza (AM) gombákkal rendelkező szárazföldi növények ősi szimbiózisa hasonló lipochitooligoszacharid szignálmolekulákkal működik, a Myc faktorok, amelyeket hasonló, de eltérő LysM típusú receptorok érzékelnek, mint az NFs (Abdel-Lateif et al., 2012; Oldroyd, 2013). A Myc faktorok és az NFs egy közös jelátviteli útvonalat aktiválnak, de a növényekben konzervált közös szimbiotikus gének bevonása után az utak eltérnek; az egyik nodulációhoz, a másik AM szimbiózishoz vezet.
a növényi fertőzés és a csomók kialakulása bonyolult folyamatok; A Nod faktorok különböző szerepet játszanak a csomók organogenezisében és a gyökérszőrfertőzésben. Sőt, a Nod tényezők mellett különféle bakteriális felszíni poliszacharidok döntő fontosságúak a hatékony fertőzéshez (Fraysse et al., 2003). A legtöbb hüvelyesben a rhizobia a gyökérszőrön keresztül jut be a gazdaszervezetbe, ahol a plazmamembrán invaginációjával egy fertőzési szál (IT) képződik, amely a szaporodó baktériumokat tartalmazza, és a gyökérkéreg felé nő. A kevésbé gyakori és ősi fertőzési mód bizonyos hüvelyesek gyökérfelületének repedésein keresztül történik.
Determinate and Indeterminate Nodulus Development
a Nodulus development megköveteli a kortikális sejtek mitotikus reaktivációját, ami a Nodulus primordium képződéséhez vezet, amely nitrogénmegkötő gyökércsomókká differenciálódik, amelyek mikroaerob állapotot biztosítanak a központi zónában az oxigénérzékeny nitrogénáz enzim működéséhez a bakteroidokban. A gazdasejt-proliferáció átmeneti és tartós jellegétől függően a csomók lehetnek determináltak vagy meghatározatlanok (Terpolilli et al., 2012; Kondorosi et al., 2013). A determinált csomóknak nincs merisztémájuk, és szimbiotikus sejtek homogén populációját tartalmazzák. Meghatározott csomók alakulnak ki például a Phaseolus vulgaris és a Lotus japonicus gyökerein.
éppen ellenkezőleg, az aktív sejtosztódás megmarad a határozatlan csomókban. Az apikális régióban (I. zóna) egy csomó merisztéma van jelen, amely az új sejtek állandó generálásával folyamatos növekedést és hosszúkás csomó alakot vált ki. A merisztémából kilépő sejtek már nem osztódnak, és differenciálódási szakaszba lépnek. A fertőzési szál felszabadítja a baktériumokat a merülő sejtekbe, amelyek fokozatosan differenciálódnak a fertőzési zóna 12-15 sejtrétege mentén (II.zóna), ami nitrogénmegkötő szimbiotikus sejtek kialakulásához vezet a III. csomózónában (1. ábra; Franssen et al., 1992). A Medicago sativa, a M. truncatula, a Vicia sativa és a Pisum sativum példák a határozatlan csomókat alkotó növényekre.
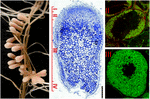
1. ábra. Szerkezete nitrogén-rögzítő gyökér csomók képződött S. meliloti-M. truncatula szimbiózis. A különböző csomózónák a hosszanti csomópontszakaszon vannak feltüntetve: (I) merisztéma, (II) fertőzési zóna, (III) nitrogénkötési zóna, (IV) öregedési zóna. Zóna szimbiotikus sejtjei tartalmazzák a differenciáló endoszimbiontokat, míg a III zónában a gazdaszervezet citoplazmája teljesen tele van hosszú nitrogénmegkötő bakteroidokkal. A Syto9-vel festett endoszimbiontok zöld fluoreszcenciával rendelkeznek.
A szimbiotikus sejtek növekedése magában foglalja a gazdaszervezet amplifikációját Endoreduplikációs ciklusokkal
Extrém növényi sejtnagyobbodás figyelhető meg mind a determinált, mind a meghatározatlan csomókban. A nitrogénmegkötő szimbiotikus sejt citoplazmájában körülbelül 50 000 bakteroid található. Az ilyen nagy számú endoszimbionta befogadására a gazdasejtek növekednek. M. truncatula csomókban a nitrogénmegkötő sejtek térfogata 80-szor nagyobb, mint a diploid merisztematikus sejteké. A fertőzött sejtek növekedése fokozatosan történik a II zónában, és a genom ismételt endoreduplikációjának (ER) következménye mitózis nélkül. A II. zónában a sejtciklus gépezete még aktív, de a mitotikus ciklinek hiánya gátolja a mitózist, és a mitotikus ciklusokat endoreduplikációs ciklusokká alakítja (Cebolla et al., 1999). Ezt a ccs52a sejtciklus-kapcsoló fehérjével érik el, amely a mitotikus ciklinek megsemmisítésével a genom duplikációjának ismételt fordulóit indukálja, ami fokozatosan növekvő poliploid sejtek kialakulásához vezet (Roudier et al., 2003; Kondorosi és Kondorosi, 2004). Medicago fajokban a ploidy szintek elérhetik a 64C-t, ami 64-szer magasabb DNS-tartalmat jelent a haploid sejtekhez képest (C megfelel a haploid DNS-tartalomnak; Vinardell et al., 2003). A Ccs52a lefelé történő szabályozása az M. truncatulában nem volt hatással a primordium képződésre, de káros volt a csomók differenciálódására, jelezve, hogy az ER ciklusok és a nagy, erősen poliploid sejtek képződése elengedhetetlen a csomók működéséhez (Vinardell et al., 2003). Érdekes módon az AM gombákat tartalmazó kortikális sejtek szintén poliploidok, valamint a fonálférgeket tápláló óriás gyökérsejtek (Favery et al., 2002; Műfaj et al., 2008). Hasonlóképpen, a rovarok szimbiotikus sejtjei, az intracelluláris endoszimbiontokat hordozó bakteriociták is nagyok és poliploidok (Nakabachi et al., 2010). Zárvatermő növényekben a poliploidia gyakori, és a különböző szervekben, szövetekben és sejttípusokban a poliploidia specifikus öröklött mintázata arra utal, hogy a gazdasejtek speciális fiziológiájának fő forrása lehet (Nagl, 1976; Edgar et al., 2014). A sejtnövekedés mellett a többszörös génmásolás, a kromoszóma kondenzáció hiánya hozzájárulhat a magasabb transzkripciós és metabolikus aktivitáshoz. A poliploidia különböző sejtfunkciókkal való társulása azonban arra utal, hogy a poliploidia hatással van a nukleoszómák architektúrájára és a specifikus genomiális régiók aktiválását vagy elnyomását szabályozó epigenómára is. Ennek megfelelően úgy tűnik, hogy a szimbiotikus sejtek poliploid genomtartalma előfeltétele a csomók differenciálódásának és a legtöbb szimbiotikus gazdagén expressziójának (maunoury et al., 2010).
A nitrogénmegkötő bakteroidok különböző sorsai
az IT-ből felszabaduló baktériumok organellaszerű struktúrákként vannak jelen a gazdaszervezet citoplazmájában, úgynevezett szimbioszómák. A baktériumok nem érintkeznek közvetlenül a citoplazmával, mivel peribakteroid membrán veszi körül őket, más néven szimbioszóma membrán (SM). A bakteroid, az SM és a köztük lévő tér alkotja a szimbioszómát (Catalano et al., 2004). Az SM kialakulása során tükrözi plazmamembrán eredetét, összetételének későbbi módosításai új, speciális szerepeket nyitnak meg a gazda-endoszimbiont felületen (Limpens et al., 2009; Ivanov et al., 2012; Brear et al., 2013; Sinharoy et al., 2013). A baktériumok szaporodnak a növekvő gazda csomósejtekben egy bizonyos sejtsűrűségig, alkalmazkodnak az endoszimbiotikus életmódhoz és a mikroaerob körülményekhez, és nitrogénmegkötő bakteroidokká válnak. A bakteroidok formája és fiziológiája azonban feltűnően eltérő lehet a különböző hüvelyesekben. Bizonyos hüvelyes gazdaszervezetekben a nitrogént rögzítő bakteroidok morfológiája megegyezik a tenyésztett sejtekével; ez a típusú bakteroidok visszatérhetnek a szabadon élő formába. Más társulásokban a bakteroidok visszafordíthatatlanul átalakulnak poliploid, megnagyobbodott, nem termeszthető endoszimbiontokká. Ezek a terminálisan differenciált bakteroidok lehetnek megnyúltak, sőt elágazóak, és 5-10-szer hosszabbak, mint a szabadon élő sejtek, vagy gömb alakúak lehetnek 8-tól legalább 20-szorosig amplifikált Genom a gazdaszervezettől függően (Mergaert et al., 2006; Nakabachi et al., 2010). A bakteroidok terminális differenciálódása gazdaszervezet által szabályozott, a Leguminosae család több ágában fejlődött ki, jelezve a gazdaszervezet előnyeit és valószínűleg magasabb szimbiotikus teljesítményt (Oono et al., 2010). A terminális bakteroid differenciálódás a legjobban az S. meliloti – M. truncatula szimbiózisban tisztázott. M-Ben. truncatula csomók, a terminális bakteroid differenciálódás leglátványosabb eseményei a II. zónában fordulnak elő. a bakteroidok szaporodása a II.zóna közepén áll meg, ahol a sejtek megnyúlása és a többszörös replikonok egyenletes amplifikációja endoreduplikációs ciklusokkal kezdődik. 2-3 sejtréteg mentén a II. és III. zóna határán (ún. interzóna) a bakteroidok hirtelen növekedése látható, elérve gyakorlatilag végső méretüket, azonban a nitrogénkötés csak a III. zónában történik.
A Gazdapeptidek szabályozzák a Bakteroid differenciálódást
a hüvelyesek csomós transzkriptómáinak összehasonlítása reverzibilis és irreverzibilis bakteroid differenciálódással több száz kis gén létezését tárta fel, amelyek csak azoknak a gazdanövényeknek a genomjában voltak jelen, ahol a bakteroid differenciálódás terminális volt. Ban ben M. truncatula a csomósejtek legalább 600 csomóspecifikus szimbiotikus peptidet (sympep) termelnek. A symPEP gének csak az S. meliloti fertőzött poliploid szimbiotikus sejtekben aktiválódnak (Kevei et al., 2002; Mergaert et al., 2003), azonban bizonyos halmazok a korábbiaknál, mások a csomók fejlődésének későbbi szakaszaiban. Nagy része, több mint 500 gén kódolja a csomóspecifikus ciszteinben gazdag (NCR) peptideket (Mergaert et al., 2003; Alunni et al., 2007; Nallu et al., 2014). Az NCR peptidek a bakteroidokat célozzák meg, és amikor az endoszimbiontokba történő szállításukat blokkolták, a bakteroid differenciálódást megszüntették, bizonyítva, hogy a peptidek felelősek a S. meliloti bakteroidok terminális differenciálódásáért (Van de Velde et al., 2010). A nagy szekvenciájú változatosság és az NCR gének jellegzetes expressziós mintái a funkciók, a hatásmódok és a bakteriális célpontok sokféleségét sugallják a bakteroid érés különböző szakaszaiban (2.ábra). Azonban miért termel a gazdasejt az NCRs arzenálját? Mi lehet az előnye egy ilyen változatos peptid repertoárnak? Szükséges-e a gazdaszervezet kölcsönhatása különböző baktériumokkal? A M. truncatula szimbiotikus Partnerei a S. meliloti és a S. medicae, azonban a talajban mindkét fajnak számtalan törzsváltozata van. M. a truncatulát számos különböző ökotípus és csatlakozás is képviseli, amelyek különböznek az NCR gének számában, szekvenciáiban és expressziós profiljában, valamint a különböző S. meliloti és S. medicae törzsekkel való szimbiotikus kölcsönhatásukban (Nallu et al., 2014; Roux et al., 2014). Míg egy csomó egyetlen baktériumtípust tartalmaz, ugyanazon gyökérzet különböző csomói különálló baktériumpopulációkkal rendelkezhetnek. Lehetséges, hogy a különféle endoszimbiontokat felismerő növény a peptidek törzsspecifikus repertoárjával manipulálja őket. Ezek a különbségek további kontrollszintet adhatnak a gazdaszervezet-szimbióta specificitáshoz és ezáltal a noduláció hatékonyságához.

2. ábra. A szimpep gének differenciális expressziója M. truncatula csomókban. Fekete jel: in situ hibridizáció, kék jel: a symPEP promoter-GUS fúziók GUS aktivitása transzgenikus csomókban.
bár a szimpepek egyedi peptidosztályokat képviselnek, szerkezetük hasonlít antimikrobiális peptidek (amp). A mikrobiális sejtölő aktivitás széles spektrumával rendelkező erősítők leggyakrabban kationos provokálják a sejthalált pórusképződéssel, membránzavarral és a mikrobiális sejtek ebből következő lízisével. Az a tény, hogy a sejtosztódási képesség véglegesen elveszik az endoszimbiont differenciálódás során, azt jelzi, hogy legalább bizonyos szimpepszek antimikrobiális aktivitással rendelkeznek. A baktériumok szintetikus kationos NCR-ekkel történő kezelése valóban kiváltotta a különböző Gram-negatív és Gram-pozitív baktériumok gyors és hatékony dózisfüggő eltávolítását, beleértve a fontos emberi és növényi kórokozókat (Van de Velde et al., 2010; Tiricz et al., 2013). Ez az ex-planta gyilkos hatás korrelált a mikrobiális membránok permeabilizációjával, azonban a szimpepszisek természetes környezetükben – a csomósejtekben-nem permeabilizálják a bakteriális membránokat, és nem pusztítják el az endoszimbiontokat. Valószínűleg a csomókban a peptidkoncentráció lényegesen alacsonyabb, mint az in vitro vizsgálatokban alkalmazott. Továbbá kationos peptideket állítanak elő anionos és semleges peptidekkel együtt ugyanabban a sejtben, és néhány tíz vagy száz különböző töltésű és hidrofób hatású peptid lehetséges kombinációja semlegesítheti a kationos peptidek közvetlen baktericid hatását.
Az erősítők vagy AMP-szerű peptidek bevonása nem egyedülálló a Rhizobium-hüvelyesek szimbiózisában. A zsizsik Sitophilusban a szimbiotikus sejtek a koleoptericin-a (ColA) antimikrobiális peptidet termelik, amely a sejtosztódás gátlásával óriási fonalas endoszimbiontok kialakulását idézi elő, és megvédi a szomszédos rovarszöveteket a bakteriális inváziótól (Login et al., 2011). Ebben a rendszerben egyetlen peptid elegendő a obligát vertikálisan átvitt endoszimbiont differenciálódásához, ellentétben a több száz szimpepszissel működő csomókkal, amelyek számtalan törzsvariánsnak adhatnak otthont endoszimbiontként. A levéltetvek-Buchnera szimbiózisban a gazdasejtek bakteriocita-specifikus peptideket is termelnek, beleértve a ciszteinben gazdag peptideket (BCR), amelyek hasonlítanak a Medicago NCR peptidekre, azonban ezeknek a szimbiotikus peptideknek a funkcióiról még nem számoltak be (Shigenobu and Stern, 2013).
NCR247: egy példa a Multi-Target Host effektor
transzkriptom elemzése M. a truncatula csomók fejlődésük különböző szakaszaiban, a csomórégiók lézeres mikrodisszekciója, in situ hibridizáció, kiválasztott peptidek immunolokalizációja, valamint a transzgenikus csomókban a symPEP promoter-reporter génfúziók lehetővé teszik az egyes peptidek hatásának feltérképezését a szimbiotikus sejtekben a korai fertőzéstől a késői nitrogénkötési állapotig. Az NCR247 a II. zóna régebbi sejtrétegeiben és az interzónában expresszálódik, ahol a bakteriális sejtosztódás megáll és az endoszimbiontok figyelemre méltó megnyúlása következik be (Farkas et al., 2014). Ez a kis kationos peptid hatékonyan elpusztította a különböző mikrobákat in vitro, és az In silico analízis megmutatta extrém fehérjekötő képességét. A FITC-vel jelölt NCR247 belépett a bakteriális citoszolba, ahol számos baktériumfehérjével való kölcsönhatása lehetséges volt. A kötő partnereket S. meliloti baktériumok vagy bakteroidok StrepII/FLAG-tagged peptidekkel történő kezelésével azonosítottuk, majd affinitás-kromatográfiával és LC-MS/MS-sel kölcsönhatásba lépő partnerek azonosításával és nyugati analízissel (Farkas et al., 2014).
az egyik interaktor az FtsZ sejtosztódási fehérje volt, amely döntő szerepet játszott a sejtosztódásban. Számos antibiotikum peptidről ismert, hogy baktericid vagy bakteriosztatikus hatást fejt ki az FtsZ-szel való kölcsönhatás révén, gátolva annak polimerizációját, ezáltal gátolva a megfelelő Z-gyűrű és septumképződést (Handler et al., 2008). Az NCR247-et FtsZ-szel együtt tisztítottuk a bakteriális citoplazmából, és kimutatták, hogy megzavarja a septumképződést. Az ncr035 in vitro baktericid hatást is mutat, és ugyanabban a szimbiotikus sejtben termelődik, mint az ncr247, amely az osztódási septumban halmozódik fel, ami ezen peptidek egyidejű vagy egymást követő hatását jelzi, valamint több gazdasejt-stratégia kialakulását az endoszimbionta proliferáció gátlására. Egy másik tanulmány kimutatta, hogy a fontos sejtosztódási gének expressziója, beleértve a Z-gyűrű működéséhez szükséges géneket is, erősen gyengültek az NCR247 által kezelt sejtekben (Penterman et al., 2014). A szubletális ncr247 koncentrációjú baktériumok előkezelése megszüntette a fitc-NCR035 lokalizációját a septumban, és provokálta a sejtek megnyúlását (Farkas et al., 2014).
a riboszomális fehérjék voltak a leggyakoribb ncr247 interakciós partnerek. Megfigyelték, hogy az NCR247 dózisfüggő módon erősen gátolja a bakteriális fehérjeszintézist mind in vivo, mind in vitro (Farkas et al., 2014). Ezek az eredmények azt sugallták, hogy az NCR247 peptid hatásának egyik módja mind a baktériumsejtekben, mind a bakteroidokban kötődik a riboszómákhoz. Érdekes módon a kölcsönhatásban lévő fehérjék megváltozott mintázatát és csökkent komplexitását figyelték meg a bakteroidokban. Ennek megfelelően a riboszomális fehérjék általános expressziós szintje átlagosan 20-szor alacsonyabb volt a bakteroidokban, mint a szabadon élő sejtekben, az egyes riboszomális fehérjék transzkriptumainak relatív bőségével. A bakteroidokban a riboszóma diverzifikációja jelentős szerepet játszhat azáltal, hogy hozzájárul a specifikus fehérjék fejlett transzlációjához, ezáltal támogatva a rendkívül bőséges nitrogénkötési funkció speciális, energiaigényes fiziológiáját.
a GroEL chaperon az NCR247 közvetlen interakciós partnere is volt (Farkas et al., 2014). Az 5 GroEL fehérje közül a GroEL1 vagy a GroEL2 elegendő a túléléshez, míg a csomóban magas szinten expresszált GroEL1 elengedhetetlen a szimbiózishoz (Bittner et al., 2007). Szükséges a nodulációs gének teljes aktiválásához és a nitrogenáz komplex összeszereléséhez. A GroEL rendkívül funkcionális sokoldalúsággal rendelkezik, mivel több száz fehérjével kölcsönhatásba lép. Az NCR247-GroEL1 kölcsönhatás közvetlenül a Groelre, de közvetetten a GroEL szubsztrátokra és a kapcsolódó biológiai folyamatokra is hatással lehet. A GroEL1 hiánya súlyosan befolyásolta a bakteriális fertőzést, valamint a bakteroidok fenntartását és differenciálódását, ami azt mutatja, hogy a nitrogénkötő csomók fejlődésének minden szakaszában általános szükség van a GroEL1-re.
a GroEL és a gazdaszervezet peptidjeinek a mikroba-gazdaszervezet kölcsönhatásokban való részvétele nem egyedülálló a Rhizobium-hüvelyesek szimbiózisában. A zsizsik szimbiotikus sejtekben a coleoptericin-a (ColA) kölcsönhatásba lép a Groellel is (Login et al., 2011). GroEL fontos szerepet játszik az endoszimbiontok fenntartásában is (Moran, 1996; Kupper et al., 2014). Mivel a legtöbb szimbiotikus rendszer még feltáratlan, és a nagy áteresztőképességű genom-és proteomikai eszközök csak a közelmúltban állnak rendelkezésre, csak azt tudjuk megjósolni, hogy a gazda peptidek által közvetített endoszimbionta differenciálódás, a gazdasejtek Genom amplifikációja és a terminálisan differenciált endoszimbionták a szimbiózis általános stratégiái.
következtetés
a szimbiotikus és patogén baktériumok hasonló módszereket alkalmaznak a gazdasejtjeikkel való kölcsönhatásra és a gazdasejteken belüli túlélésre, még akkor is, ha ezeknek a kölcsönhatásoknak az eredményei feltűnően eltérőek. A növények és az állatok veleszületett immunválaszokat generálhatnak a mikroorganizmusokra a MAMS (mikroorganizmusokhoz kapcsolódó molekuláris minták) észlelésekor. Ez az észlelés a jelátviteli kaszkádok aktiválódását, valamint antimikrobiális effektorok előállítását eredményezi. AMP-szerű gazda peptidek, például az M. a truncatula NCR peptidek vagy a weevil ColA antimikrobiális peptid kulcsfontosságú és sokoldalú szerepet játszanak az endoszimbionták szaporodásának és differenciálódásának szabályozásában, ezáltal korlátozva a baktériumok jelenlétét a szimbiotikus sejtekben. Így a gazdaszervezetek ezeket az effektor peptideket felhasználják a kiválasztott mikrobiális betolakodók megszelídítésére, sőt szolgálatba vételére.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
elismerések
a laboratóriumainkban végzett munkát az Európai Kutatási Tanács”SYM-BIOTICS” Advanced Grant (269067-es pályázati szám) és a T (4.2.2) támogatja.A-11/1 / KONV-2012-0035 az Európai Unió támogatásával és az Európai Szociális Alap társfinanszírozásával.
Abdel-Lateif, K., Bogusz, D., and Hocher, V. (2012). A flavonoidok szerepe a növényi gyökerek endoszimbiózisának kialakulásában arbuszkuláris mycorrhiza gombákkal, rhizobia és Frankia baktériumokkal. Növényi Jel. Behav. 7, 636–641. doi: 10.4161 / psb.20039
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alunni, B., Kevei, Z., Redondo-Nieto, M., Kondorosi, A., Mergaert, P., and Kondorosi, E. (2007). Genomic organization and evolutionary insights on GRP and NCR genes, two large nodule-specific gene families in Medicago truncatula. Mol. Plant Microbe Interact. 20, 1138–1148. doi: 10.1094/MPMI-20-9-1138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barnett, M. J., Fisher, R. F., Jones, T., Komp, C., Abola, A. P., Barloy-Hubler, F., et al. (2001). Nukleotidszekvencia és a teljes Sinorhizobium meliloti psyma megaplasmid várható funkciói. Proc. NAT. Acad. Sci. U. S. A. 98, 9883-9888. doi: 10.1073/pnas.161294798
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Bittner, A. N., Foltz, A., and Oke, V. (2007). A Sinorhizobium meliloti életképességéhez és sikeres szimbiózisához az öt groEL gén közül csak egy szükséges. J. Bakteriol. 189, 1884–1889. doi: 10.1128 / JB.01542-06
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brear, E. M., Day, D. A., and Smith, P. M. (2013). Iron: an essential micronutrient for the legume-Rhizobium symbiosis. Front. Plant Sci. 4:359. doi: 10.3389/fpls.2013.00359
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Catalano, C. M., Lane, W. S., and Sherrier, D. J. (2004). Biochemical characterization of symbiosome membrane proteins from Medicago truncatula root nodules. Electrophoresis 25, 519–531. doi: 10.1002/elps.200305711
Pubmed absztrakt | Pubmed teljes szöveg / CrossRef teljes szöveg
Capela, D., Barloy-Hubler, F., Gouzy, J., Bothe, G., Ampe, F., Batut, J.,et al. (2001). A sinorhizobium meliloti 1021 hüvelyes szimbionta kromoszóma szekvenciájának elemzése. Proc. NAT. Acad. Sci. U. S. A. 98, 9877-9882. doi: 10.1073/pnas.161294398
Pubmed absztrakt | Pubmed teljes szöveg / CrossRef teljes szöveg
Cebolla, A., Vinardell, J. M., Kiss, E., ol Xhamh, B., Roudier, F., Kondorosi, A.,et al. (1999). A mitotikus inhibitor ccs52 szükséges endoreduplikáció és ploidy-függő sejtnagyobbítás a növényekben. EMBO J. 18, 4476-4484. doi: 10.1093 / emboj/18.16.4476
CrossRef Full Text
Chen, W. M., Moulin, L., Bontemps, C., Vandamme, P., B Enterprises, G., and Boivin-Masson, C. (2003). A hüvelyesek szimbiotikus nitrogénkötése a proteobaktériumok által széles körben elterjedt a természetben. J. Bakteriol. 185, 7266–7272. doi: 10.1128 / JB.185.24.7266-7272.2003
CrossRef teljes szöveg
Edgar, B. A., Zielke, N., and Gutierrez, C. (2014). Endocycles: visszatérő evolúciós innováció a poszt – mitotikus sejtnövekedéshez. Nat. Mol Tiszteletes. Cella. Biol. 15, 197–210. doi: 10.1038/nrm3756
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Farkas, A., Mar ca., G., D., D., H., gy., R., Medzihradszky, K. F., et al. (2014). A Medicago truncatula szimbiotikus peptid NCR247 több mechanizmuson keresztül járul hozzá a bakteroid differenciálódáshoz. Proc. NAT. Acad. Sci. U. S. A. 111, 5183-5188. doi: 10.1073/pnas.1404169111
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Favery, B., Complainville, A., Vinardell, J. M., Lecomte, P., Vaubert, D., Mergaert, P.,et al. (2002). The endosymbiosis-induced genes ENOD40 and CCS52a are involved in endoparasitic-nematode interactions in Medicago truncatula. Mol. Plant-Microbe Interact. 15, 1008–1013. doi: 10.1094/MPMI.2002.15.10.1008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franssen, H. J., Vijn, I., Yang, W. C., and Bisseling, T. (1992). Developmental aspects of the Rhizobium-legume symbiosis. Plant Mol. Biol. 19, 89–107. doi: 10.1007
CrossRef Full Text
Fraysse, N., Couderc, F., and Poinsot, V. (2003). Surface polysaccharide involvement in establishing the Rhizobium–legume symbiosis. Eur. J. Biochem. 270, 1365–1380. doi: 10.1046/j.1432-1033.2003.03492.x
CrossRef Full Text
Genre, A., Chabaud, M., Faccio, A., Barker, D. G., and Bonfante, P. (2008). A prepenetrációs készülék összeállítása megelőzi és megjósolja az arbuscularis mikorrhiza gombák kolonizációs mintáit mind a Medicago truncatula, mind a Daucus carota gyökérkéregében. Növényi Sejt 20, 1407-1420. doi: 10.1105 / tpc.108.059014
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Handler, A. A., Lim, J. E., and Losick, R. (2008). A Cytokinesis peptid inhibitora a Bacillus subtilis sporuláció során. Mol. Mikrobiol. 68, 588–599. doi: 10.1111 / j.1365-2958.2008.06173.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ivanov, S., Fedorova, E. E., Limpens, E., De Mita, S., Genre, A., Bonfante, P.,et al. (2012). Rhizobium–legume symbiosis shares an exocytotic pathway required for arbuscule formation. Proc. Natl. Acad. Sci. U.S.A. 109, 8316–8321. doi: 10.1073/pnas.1200407109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kevei, Z., Vinardell, J. M., Kiss, G. B., Kondorosi, A., and Kondorosi, E. (2002). A gócspecifikus géncsalád által kódolt glicinben gazdag fehérjék a szimbiotikus gócfejlődés különböző szakaszaiban vesznek részt Medicago spp. Mol. A Növényi Mikroba Kölcsönhatásba Lép. 15, 922–931. doi: 10.1094 / MPMI.2002.15.9.922
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Kondorosi, E., and Kondorosi, A. (2004). Az anafázist elősegítő komplex endoreduplikációja és aktiválása a szimbiotikus sejtfejlődés során. FEBS Lett. 567, 152–157. doi: 10.1016 / j. febslet.2004.04.075
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Kondorosi, E., Mergaert, P., and kerest, A. (2013). Az endoszimbiotikus élet paradigmája: a Rhizobium baktériumok sejtdifferenciálódása, amelyet a gazdanövény tényezői váltanak ki. Annu. Microbiol Tiszteletes. 67, 611–628. doi: 10.1146 / annurev-micro-092412-155630
CrossRef teljes szöveg
Kupper, M., Gupta, SK, Feldhaar, H., and Gross, R. (2014). A chaperonin GroEL sokoldalú szerepe a mikroorganizmus-rovar kölcsönhatásokban. FEMS Microbiol. Lett. 353, 1–10. doi: 10.1111/1574-6968. 12390
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Limpens, E., Ivanov, S., Van Esse, W., Voets, G., Fedorova, E., and Bisseling, T. (2009). A Medicago N2-rögzítő szimbioszómák megszerzik a Rab7 endocitikus identitásjelzőt, de késleltetik a vakuoláris identitás megszerzését. Növényi Sejt 21, 2811-2828. doi: 10.1105 / tpc.108.064410
Pubmed absztrakt | Pubmed teljes szöveg | CrossRef teljes szöveg
Bejelentkezés, F. H., Balmand, S., Vallier, A., Vincent-Mon! Gat, C., Vigneron, A., Weiss-Gayet, M., et al. (2011). Az antimikrobiális peptidek ellenőrzés alatt tartják a rovarok endoszimbiontjait. Tudomány 334, 362-365. doi: 10.1126 / tudomány.1209728
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
MacLean, A. M., Finan, T. M., and Sadowsky, M. J. (2007). A hüvelyesek szimbiotikus nitrogénmegkötő baktériumainak genomjai. Növényi Fiziol. 144, 615–622. doi: 10.1104 / PP.107. 101634
Pubmed absztrakt | Pubmed teljes szöveg | CrossRef teljes szöveg
Maunoury, N., Redondo-Nieto, M., Bourcy, M., Van De Velde, W., Alunni, B., Laporte, P., et al. (2010). A szimbiotikus sejtek és az endoszimbionták differenciálódása két transzkriptom-kapcsolóhoz kapcsolódik a Medicago truncatula nodulációban. PLoS egy 5:e9519. doi: 10.1371 / folyóirat.pone.0009519
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Mergaert, P., Nikovics, K., Kelemen, Z., Maunoury, N., Vaubert, D., Kondorosi, A.,et al. (2003). A Medicago truncatula új családja, amely több mint 300 csomóspecifikus génből áll, amelyek kis, szekretált polipeptideket kódolnak konzervált cisztein motívumokkal. Növényi Fiziol. 132, 161–173. doi: 10.1104/pp.102.018192
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mergaert, P., Uchiumi, T., Alunni, B., Evanno, G., Cheron, A., Catrice, O.,et al. (2006). Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis. Proc. Natl. Acad. Sci. U.S.A. 103, 5230–5235. doi: 10.1073/pnas.0600912103
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Moran, N. A. (1996). Gyorsított evolúció és Muller racsnis endoszimbiotikus baktériumokban. Proc. NAT. Acad. Sci. U. S. A. 93, 2873-2878. doi: 10.1073/pnas.93.7.2873
CrossRef teljes szöveg
Moran, N. A., McCutcheon, J. P., and Nakabachi, A. (2008). Genomika és az öröklődő bakteriális szimbiontok evolúciója. Annu. Genet Tiszteletes. 42, 165–690. doi: 10.1146 / annurev.genet.41.110306.130119
CrossRef teljes szöveg
Nakabachi, A., Koshikawa, S., Miura, T., and Miyagishima, S. (2010). A pachypsylla venusta (Hemiptera) genommérete: Psyllidae) és a bakteriocita ploidiája, a szimbiotikus gazdasejt, amely intracelluláris kölcsönös baktériumokat tartalmaz a legkisebb sejtgenommal. Baromság. Entomol. Res. 100, 27-33. doi: 10.1017 / S0007485309006737
Pubmed absztrakt | Pubmed teljes szöveg/CrossRef teljes szöveg
Nagl, W. (1976). DNS endoreduplikáció és polyteny érteni evolúciós stratégiák. Természet 261, 614-615. doi: 10.1038 / 261614a0
Pubmed absztrakt | Pubmed teljes szöveg / CrossRef teljes szöveg
Nallu, S., Silverstein, K. A., Zhou, P., Young, N. D. és Vandenbosch, K. A. (2014). A göbös ciszteinben gazdag peptidek nagy családjának divergenciájának mintái a Medicago truncatula csatlakozásaiban. Növény J. 78, 697-705. doi: 10.1111 / tpj.12506
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Oldroyd, G. E. (2013). Beszélj, barát, és lépj be: jelzőrendszerek, amelyek elősegítik a jótékony szimbiotikus asszociációkat a növényekben. Nat. Microbiol Tiszteletes. 11, 252–263. doi: 10.1038/nrmicro2990
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Oono, R., Schmitt, I., Sprent, J. I., and Denison, R. F. (2010). Multiple evolutionary origins of legume traits leading to extreme rhizobial differentiation. New Phytol. 187, 508–520. doi: 10.1111/j.1469-8137.2010.03261.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Penterman, J., Abo, R. P., De Nisco, N. J., Arnold, M. F., Longhi, R., Zanda, M.,et al. (2014). A gazdanövény peptidjei transzkripciós választ váltanak ki a sinorhizobium meliloti sejtciklus szimbiózis során. Proc. NAT. Acad. Sci. U. S. A. 111, 3561-3566. doi: 10.1073/pnas.1400450111
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Price, D. R., Duncan, R. P., Shigenobu, S., and Wilson, A. C. (2011). Az aminosav transzporterek Genom expanziója és differenciális expressziója a levéltetű / buchnera szimbiotikus interfészen. Mol. Biol. Evol. 28, 3113–3126. doi: 10.1093/molbev/msr140
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roudier, F., Fedorova, E., Lebris, M., Lecomte, P., Györgyey, J., Abad, P.,et al. (2003). The Medicago species A2-type cyclin is auxin regulated and involved in meristem formation but dispensable for endoreduplication-associated developmental programs. Plant Physiol. 131, 1091–1103. doi: 10.1104/pp.102.011122
CrossRef Full Text
Roux, B., Rodde, N., Jardinaud, M. F., Timmers, T., Sauviac, L., Cottret, L.,et al. (2014). A növényi és bakteriális génexpresszió integrált analízise szimbiotikus gyökércsomókban, lézeres befogású mikrodisszekcióval, RNS-szekvenálással. Növény J. 77, 817-837. doi: 10.1111 / tpj.12442
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Shigenobu, S., and Stern, D. L. (2013). A levéltetvek új szekretált fehérjéket fejlesztettek ki a baktériumokkal való szimbiózis érdekében endoszimbiont. Proc. Biol. Sci. 280, 20121952. doi: 10.1098 / rspb.2012.1952
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Sinharoy, S., Torres-Jerez, I., Bandyopadhyay, K., keres, A., Pislariu, C. I., Nakashima, J.,et al. (2013). A szimbioszóma differenciálódásának C2H2 transzkripciós faktor szabályozója elnyomja a vamp721a szekréciós útvonal gén transzkripcióját, és elősegíti a szimbioszóma fejlődését a Medicago truncatulában. Növényi Sejt 25, 3584-3601. doi: 10.1105 / tpc.113.114017
Pubmed absztrakt | Pubmed teljes szöveg | CrossRef teljes szöveg
Terpolilli, J. J., Hood, G. A., and Poole, P. S. (2012). What determines the efficiency of N(2)-fixing Rhizobium-legume symbioses? Adv. Microb. Physiol. 60, 325–389. doi: 10.1016/B978-0-12-398264-3.00005-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiricz, H., Szûcs, A., Farkas, A., Pap, B., Lima, R. M., Maróti, G.,et al. (2013). Antimicrobial nodule-specific cysteine-rich peptides induce membrane depolarization associated changes in Sinorhizobium meliloti. Appl. Env. Microbiol. 79, 6737–6746. doi: 10.1128/AEM.01791-13
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Van de Velde, W., Zehirov, G., Szatmari, A., Debreczeny, M., Ishihara, H., Kevei, Z.,et al. (2010). Plant peptides govern terminal differentiation of bacteria in symbiosis. Science 327, 1122–1126. doi: 10.1126/science.1184057
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vinardell, J. M., Fedorova, E., Cebolla, A., Kevei, Z., Horvath, G., Kelemen, Z.,et al. (2003). A ccs52a anafázist elősegítő komplex aktivátor által közvetített endoreduplikáció szükséges a szimbiotikus sejtek differenciálódásához a Medicago truncatula csomókban. Növényi Sejt 15, 2093-2105. doi: 10.1105 / tpc.014373
Pubmed absztrakt / Pubmed teljes szöveg / CrossRef teljes szöveg
Walker, S. A., and Downie, J. A. (2000). A Rhizobium leguminosarum BV belépése. a gyökérszőrzetbe történő viciae minimális Bólintási faktor specifitást igényel, de a későbbi fertőzési szál növekedéséhez nodO vagy csomópont szükséges. Mol. A Növény-Mikroba Kölcsönhatásba Lép.13, 54–62. doi: 10.1094 / MPMI.2000.13.7.754
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text