adagolási forma: injekció
orvosilag felülvizsgálta Drugs.com. Utoljára 22.December 2020-án frissült.
- mellékhatások
- adagolás
- szakmai
- kölcsönhatások
- terhesség
- több
csak Rx.
steril intravénás oldat
- Inamrinon leírás
- Inamrinon – Klinikai farmakológia
- farmakokinetika
- farmakodinamika
- Inamrinon javallatok és alkalmazás
- ellenjavallatok
- figyelmeztetések
- óvintézkedések
- Általános
- laboratóriumi vizsgálatok
- Gyógyszerkölcsönhatások
- kémiai kölcsönhatások
- karcinogenezis, mutagenezis, fertilitás romlása
- vemhesség
- szoptató anyák
- gyermekgyógyászati alkalmazás
- mellékhatások
- A mellékhatások kezelése
- túladagolás
- Inamrinon Adagolás és alkalmazás
- kémiai kölcsönhatások
- hogyan kerül forgalomba az Inamrinon?
- VIAL LABEL
- More about inamrinone
- Related treatment guides
Inamrinon leírás
az INAMRINON injekció az USP a szív inotrop szerek új osztályát képviseli, amely különbözik a digitálisz glikozidoktól vagy katekolaminoktól. Az inamrinon-Laktát kémiailag 5-Amino-6(1h)-egy 2-hidroxi-propanát, és a következő szerkezettel rendelkezik:
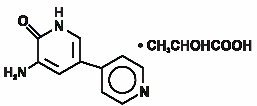
az Inamrinon egy halványsárga kristályos vegyület, amelynek molekulatömege 187,20 és molekulatömege C10H9N3O. minden mól tejsav molekulatömege 90,08 és empirikus képlete c3h6o3. Az Inamrinon oldhatósága a pH 4,1, 6,0 és 8,0 értéken sorrendben 25, 0,9 és 0,7 mg/mL.
az Inamrinon injekció tiszta, sárga, steril oldat, amely 20 mL-es injekciós üvegekben kapható intravénás beadásra. 5 mg Inamrinonnak megfelelő inamrinon-laktátot és 0,25 mg nátrium-metabiszulfitot tartalmaz milliliterenként tartósítószerként injekcióhoz való vízben. A betegtájékoztatóban kifejezett összes dózist az alap, az Inamrinon alapján fejezzük ki. A pH-t 3,2-4,0 közé állítjuk tejsavval vagy nátrium-hidroxiddal. A tejsav teljes koncentrációja 5 mg és 7,5 mg között változhat.
Inamrinon – Klinikai farmakológia
az Inamrinon értágító hatású, szerkezetében és hatásmechanizmusában különbözik a digitálisz glikozidoktól vagy a katekolaminoktól.
inotrop és értágító hatásának mechanizmusa nem teljesen tisztázott.
inotrop hatása tekintetében a kísérleti bizonyítékok azt mutatják, hogy nem béta-adrenerg agonista. Gátolja a miokardiális ciklikus adenozin-monofoszfát (c-AMP) foszfodiészteráz aktivitását, és növeli a C-AMP sejtszintjét. A digitalistól eltérően nem gátolja a nátrium-kálium-adenozin-trifoszfatáz aktivitást.
értágító hatását tekintve az inamrinon az érrendszer simaizomzatára gyakorolt közvetlen relaxáló hatása révén csökkenti az utóterhelést és az előterhelést.
farmakokinetika
normál önkénteseknek adott 0, 68 mg/ttkg-1, 2 mg/ttkg intravénás bolus (1-2 perc) injekciót követően az Inamrinon megoszlási térfogata 1, 2 liter / ttkg volt, és a plazmában körülbelül 4, 6 perc eloszlási fázisú felezési időt követően az átlagos látszólagos elsőrendű terminális eliminációs felezési idő körülbelül 3, 6 óra volt. Inamrinon infúzióval kezelt pangásos szívelégtelenségben szenvedő betegeknél az átlagos látszólagos elsőrendű terminális eliminációs felezési idő körülbelül 5, 8 óra volt.
az egyik vizsgálatban az Inamrinon 10-22% – ban kötődik a humán plazmafehérjékhez ultraszűréssel in vitro, egy másik vizsgálatban pedig 35-49% – ban kötődik ultraszűréssel vagy egyensúlyi dialízissel.
emberben az inamrinon és számos metabolit (N-glikolil, N-acetát, O-glükuronid és N-glükuronid) elsődleges kiválasztódási útja a vizelettel történik. Egészséges önkénteseknél a 14C-vel jelölt Inamrinon orális adagjának körülbelül 63%-a ürült a vizelettel egy 96 órás periódus alatt. Az első 8 órában a vizelet radioaktivitásának 51%-a Inamrinon volt, 5%-A N-acetát, 8% – A N-glikolát, és kevesebb, mint 5% – a glükuronidonként. A beadott dózis körülbelül 18% – a ürült a széklettel 72 órán belül.
egy 24 órás, nem radioaktív intravénás vizsgálatban a dózis 10-40%-a ürült a vizelettel változatlan Inamrinon formájában, míg az N-acetil metabolit a dózis kevesebb mint 2% – át tette ki.
pangásos szívelégtelenségben szenvedő betegeknél a telítő bolus dózis után a steady-state plazmaszint körülbelül 2, 4 mcg/mL volt képes fenntartani 5 mcg/kg/perc és 10 mcg/kg/perc közötti infúzióval. Egyes pangásos szívelégtelenségben szenvedő betegeknél, akik ezzel összefüggésben károsodott vese-és máj perfúzióval járnak, lehetséges, hogy az inamrinon plazmaszintje emelkedhet az infúziós időszak alatt; ezért ezeknél a betegeknél szükség lehet a hemodinamikai válasz és/vagy a gyógyszerszint monitorozására. A betegre adott válasz fő mércéi a következők: kardiális index, pulmonalis kapilláris ék nyomás, centrális vénás nyomás, és ezek kapcsolata a plazmakoncentrációval. Ezenkívül a vérnyomás, a vizeletmennyiség és a testtömeg mérése hasznosnak bizonyulhat, csakúgy, mint az olyan klinikai tünetek, mint az orthopnea, a dyspnoe és a fáradtság.
farmakodinamika
depressziós myocardialis funkciójú betegeknél az Inamrinon inotrop és értágító hatása miatt a szívteljesítmény gyors növekedését idézi elő.
az inamrinon egyszeri intravénás bolus adagját követően 0.75 mg/ttkg-3 mg/ttkg pangásos szívelégtelenségben szenvedő betegeknél a szívteljesítmény dózisfüggő maximális növekedése következik be (körülbelül 28% 0, 75 mg/ttkg-ról körülbelül 61% – ra 3 mg/ttkg-ra). A Csúcshatás minden adag esetén 10 percen belül jelentkezik. A hatás időtartama a dózistól függ, mely körülbelül 1/2 órán át 0,75 mg/ttkg és körülbelül 2 órán át 3 mg/ttkg adag mellett tart.
ugyanazon dózistartományban a pulmonalis kapilláris ék nyomása és a teljes perifériás ellenállás dózisfüggő csökkenést mutat (a pulmonalis kapilláris ék nyomása átlagosan 29% – kal, a szisztémás vaszkuláris rezisztencia pedig 29% – kal csökkent). 3 mg/ttkg-ig terjedő dózisoknál a diasztolés nyomás dózisfüggő csökkenését (legfeljebb 13% – os) figyelték meg. Az átlagos artériás nyomás csökken (9,7%) 3 mg/kg dózisban. A pulzusszám általában változatlan.
a hemodinamikai paraméterek változása folyamatos intravénás infúzió alatt, majd azt követően néhány órán keresztül fennmarad.
az Inamrinon hatékony a teljesen digitalizált betegeknél anélkül, hogy a szívglikozid toxicitásának jeleit okozná. Inotrop hatásai additívak a digitalis hatásaival. Pitvari flutter/fibrilláció esetén lehetséges, hogy az Inamrinon növelheti a kamrai válaszarányt az A/V vezetés enyhe fokozódása miatt. Ezekben az esetekben ajánlott a digitalis előzetes kezelése.
ischaemiás szívbetegségben szenvedő betegeknél a bal kamrai funkció javulását és a pangásos szívelégtelenség enyhülését figyelték meg. A javulás a myocardialis ischaemia tüneteinek vagy elektrokardiográfiai jeleinek kiváltása nélkül történt.
állandó pulzusszám és vérnyomás mellett a szívteljesítmény növekedése a szívizom oxigénfogyasztásának mérhető növekedése vagy az arteriovenosus oxigénkülönbség változása nélkül következik be.
az inotrop aktivitás az inamrinon ismételt intravénás adagjait követően is fennmarad. Az inamrinon alkalmazása hemodinamikai és tüneti előnyökkel jár azoknál a betegeknél, akiket a diuretikumokkal és szívglikozidokkal végzett hagyományos kezelés nem szabályoz kielégítően.
Inamrinon javallatok és alkalmazás
az Inamrinon injekció a pangásos szívelégtelenség rövid távú kezelésére szolgál. A kevés tapasztalat és a súlyos mellékhatások lehetősége miatt (lásd mellékhatások) az Inamrinon csak olyan betegeknél alkalmazható, akik szorosan monitorozhatók, és akik nem reagáltak megfelelően a digitáliszra, a diuretikumokra és/vagy az értágítókra. Kontrollos vizsgálatokban az intravénás Inamrinonnal szerzett tapasztalatok nem haladják meg a 48 órás ismételt bolus és/vagy folyamatos infúzió adását.
függetlenül attól, hogy orálisan, folyamatosan intravénásan vagy szakaszosan intravénásan adják-e be, sem az Inamrinon, sem bármely más ciklikus AMP-függő inotróp kontrollált vizsgálatokban nem bizonyult biztonságosnak vagy hatékonynak a pangásos szívelégtelenség hosszú távú kezelésében. A különböző ilyen szerekkel (beleértve az Inamrinont is) végzett krónikus orális terápia kontrollált vizsgálataiban a tünetek nem enyhültek következetesen, és a ciklikus AMP-függő inotropok következetesen összefüggtek a kórházi kezelés és a halálozás fokozott kockázatával. Úgy tűnt, hogy a NYHA IV.osztályú tünetekkel rendelkező betegek különösen veszélyeztetettek.
ellenjavallatok
az Inamrinon ellenjavallt olyan betegeknél, akik túlérzékenyek rá.
ellenjavallt azoknál a betegeknél is, akikről ismert, hogy túlérzékenyek a biszulfitokra.
figyelmeztetések
nátrium-metabiszulfitot tartalmaz, egy szulfitot, amely allergiás típusú reakciókat okozhat, beleértve az anafilaxiás tüneteket, valamint életveszélyes vagy kevésbé súlyos asztmás epizódokat bizonyos fogékony embereknél. A szulfitérzékenység általános prevalenciája az általános populációban nem ismert és valószínűleg alacsony. A szulfitérzékenység gyakrabban fordul elő asztmában, mint nem asztmás embereknél.
óvintézkedések
Általános
az inamrinon nem alkalmazható súlyos aorta-vagy pulmonikus szelepbetegségben szenvedő betegeknél az obstrukció műtéti enyhítése helyett. Mint más inotrop szerek, súlyosbíthatja a kiáramlási traktus obstrukcióját hipertrófiás subaortic stenosisban.
intravénás inamrinon-kezelés alatt ellenőrizni kell a vérnyomást és a pulzusszámot, és az infúzió sebességét le kell lassítani vagy le kell állítani azoknál a betegeknél, akiknél a vérnyomás nagymértékben csökken.
azoknál a betegeknél, akik erőteljes diuretikus kezelésben részesültek, elégtelen lehet A szívtöltő nyomás ahhoz, hogy megfelelően reagáljanak az Inamrinonra, ebben az esetben a folyadék-és elektrolitbevitel óvatos liberalizációja indokolt lehet.
supraventricularis és ventricularis arrhythmiákat figyeltek meg a nagyon magas kockázatú kezelt populációban. Míg az Inamrinon önmagában nem bizonyult aritmogénnek, a pangásos szívelégtelenségben jelen lévő aritmia lehetősége bármely gyógyszer vagy gyógyszerkombináció növelheti.
thrombocytopeniát és hepatotoxicitást figyeltek meg (lásd mellékhatások).
alkalmazás akut myocardialis infarctusban
nem végeztek klinikai vizsgálatokat a posztmiokardiális infarktus akut fázisában szenvedő betegeknél. Ezért ezekben az esetekben az Inamrinon nem ajánlott.
laboratóriumi vizsgálatok
folyadék-és elektrolitszintek
az Inamrinon-kezelés alatt a folyadék-és elektrolitváltozásokat, valamint a vesefunkciót gondosan monitorozni kell. A kapott diurézissel járó szívteljesítmény javulása szükségessé teheti a diuretikum adagjának csökkentését. A túlzott diurézis miatti káliumvesztés hajlamosíthatja a digitalizált betegeket aritmiákra. Ezért a hipokalémiát kálium-kiegészítéssel kell korrigálni az Inamrinon alkalmazása előtt vagy alatt.
Gyógyszerkölcsönhatások
viszonylag korlátozott tapasztalat szerint nem figyeltek meg kellemetlen klinikai tüneteket olyan betegeknél, akiknél az Inamrinont a következő gyógyszerekkel egyidejűleg alkalmazták: digitálisz glikozidok; lidokain, kinidin; metoprolol, propranolol; hidralazin, prazozin; izoszorbid-dinitrát, nitroglicerin; klórtalidon, etakrinsav, furoszemid, hidroklorotiazid, spironolakton; kaptopril; heparin, warfarin; káliumpótlók; inzulin; diazepám.
egy esetben beszámoltak túlzott hipotenzióról, amikor inamrinont dizopiramiddal egyidejűleg alkalmaztak.
amíg további tapasztalatok nem állnak rendelkezésre, a dizopiramiddal történő egyidejű alkalmazást óvatosan kell végezni.
kémiai kölcsönhatások
a kémiai kölcsönhatás lassan, 24 órás időszak alatt következik be, amikor az inamrinon intravénás oldatát közvetlenül dextróz (glükóz) tartalmú oldatokkal keverik. Ezért az Inamrinont nem szabad dextrózt (glükózt) tartalmazó oldatokkal hígítani az injekció beadása előtt.
azonnal kémiai kölcsönhatás lép fel, amelyet csapadék képződése bizonyít, amikor a furoszemidot inamrinon infúzió intravénás vonalába injektálják. Ezért a furoszemid nem adható inamrinont tartalmazó intravénás szerelékekben.
karcinogenezis, mutagenezis, fertilitás romlása
patkányoknak és egereknek a maximálisan tolerálható 80 mg/ttkg/nap dózisig szájon át adott inamrinon nem utalt rákkeltő hatásra.
az egér micronucleus tesztje (a maximális humán dózis 7,5-10-szeresénél) és a kínai hörcsög ovarium kromoszóma aberrációs vizsgálata pozitív volt, ami mind a klasztogén potenciált, mind a polikromatikus eritrociták számának szuppresszióját jelezte. Azonban az Ames Salmonella assay, az egér lymphoma vizsgálat és a tenyésztett humán limfocita metafázis analízis mind negatív volt. A klasztogén hatások ellentétben állnak a patkányokon végzett hím és nőstény fertilitási vizsgálatok, valamint a patkányokon végzett háromgenerációs vizsgálatok negatív eredményeivel, mindkettő orális adagolás mellett.
patkányoknál a vemhességi időszak enyhe megnyúlását figyelték meg ezekben a vizsgálatokban 50 mg/ttkg/nap és 100 mg/ttkg/nap dózisszintek mellett. Dystocia a 100 mg/ttkg/nap adagot kapó anyaállatokban fordult elő, ami a halvaszületések számának növekedését, az alom méretének csökkenését és a kölykök gyenge túlélését eredményezte.
vemhesség
teratogén hatások-vemhességi Kategória c
Új-zélandi fehér nyulakban kimutatták, hogy az Inamrinon 16 mg/ttkg és 50 mg/ttkg orális adagok mellett magzati csontrendszeri és bruttó külső fejlődési rendellenességeket okoz, amelyek a nyúlra mérgezőek voltak. Francia Hy/Cr nyulakon végzett, legfeljebb 32 mg/kg/nap orális adagokat alkalmazó vizsgálatok nem erősítették meg ezt a megállapítást. Nem észleltek fejlődési rendellenességeket azoknál a patkányoknál, akik intravénásan inamrinont kaptak a maximális alkalmazott adagban, 15 mg/kg/nap (körülbelül a pangásos szívelégtelenségben szenvedő betegek számára ajánlott napi intravénás adag). Terhes nőkön történő alkalmazásra nincs megfelelő és jól kontrollált vizsgálat. Az inamrinont terhesség alatt csak akkor szabad alkalmazni, ha a potenciális előny igazolja a magzatra gyakorolt potenciális kockázatot.
szoptató anyák
óvatosan kell eljárni, ha az Inamrinont szoptató nőknek adják, mivel nem ismert, hogy kiválasztódik-e az anyatejbe.
gyermekgyógyászati alkalmazás
biztonságosságát és hatékonyságát gyermekgyógyászati betegeknél nem igazolták.
mellékhatások
Thrombocytopenia: Az inamrinon intravénás injekciója a vérlemezkeszám 100 000/mm3 alá vagy a normál határértékek alá csökkenését eredményezte a betegek 2,4% – ánál.
ez gyakoribb azoknál a betegeknél, akik hosszabb ideig tartó kezelést kapnak. A mai napig szorosan monitorozott klinikai vizsgálatokban olyan betegeknél, akiknek a vérlemezkeszáma nem volt depressziós, nem figyeltek meg vérzéses jelenségeket.
a thrombocyta-csökkenés dózisfüggő, és a thrombocyta-túlélési idő csökkenése miatt jelentkezik. Számos olyan betegnél, akiknél thrombocytopenia alakult ki az Inamrinon szedése alatt, csontvelővizsgálatok voltak, amelyek normálisak voltak. Nincs bizonyíték a thrombocyta csökkenésére az immunválaszra vagy a thrombocyta aktiváló faktorra.
gastrointestinalis hatások: a klinikai alkalmazás során az Inamrinonnal kapcsolatban jelentett gastrointestinalis mellékhatások közé tartozott a hányinger (1,7%), a hányás (0,9%), a hasi fájdalom (0,4%) és az anorexia (0,4%).
cardiovascularis hatások: az Inamrinonnal kapcsolatban jelentett cardiovascularis mellékhatások közé tartozik az arrhythmia (3%) és a hypotonia (1,3%).
májtoxicitás: Kutyákban 9 mg/ttkg/nap és 32 mg/ttkg/nap közötti intravénás dózisok esetén az Inamrinon dózisfüggő hepatotoxicitást mutatott, amely enzimszint-emelkedésben vagy májsejt-nekrózisban, vagy mindkettőben nyilvánult meg. Hepatotoxicitást figyeltek meg emberben hosszú távú orális adagolást követően, és korlátozott tapasztalat (0, 2%) az inamrinon intravénás alkalmazását követően. Ritkán enzim-és bilirubinszint emelkedésről és sárgaságról is beszámoltak.
túlérzékenység: több látszólagos túlérzékenységi reakcióról számoltak be orális Inamrinonnal kezelt betegeknél körülbelül két hétig. A jelek és tünetek változóak voltak, de szerepeltek benne pericarditis, pleuritis és ascites (1 eset), mellkasi röntgenfelvételen interstitialis árnyékolással járó myositis és emelkedett ülepedési arány (1 eset), valamint nodularis pulmonalis sűrűséggel járó vasculitis, hypoxaemia és sárgaság (1 eset). Az első beteg meghalt, nem feltétlenül a lehetséges reakció miatt, míg az utolsó kettő a kezelés abbahagyásával megszűnt. Az esetek egyikét sem kérdőjelezték meg újra, így az Inamrinonnak való tulajdonítás nem biztos, de az esetleges túlérzékenységi reakciókat figyelembe kell venni minden olyan betegnél, akit hosszabb ideig tartanak fenn Inamrinonnal.
általános: az intravénás Inamrinon klinikai vizsgálatokban megfigyelt további mellékhatások közé tartozik a láz (0, 9%), mellkasi fájdalom (0, 2%) és égő érzés az injekció beadásának helyén (0, 2%).
A mellékhatások kezelése
a vérlemezkeszám csökkenése: A tünetmentes vérlemezkeszám-csökkenés (<150 000/mm3) a gyógyszer adagjának csökkenését követő egy héten belül megfordítható. Továbbá, a gyógyszeradag változása nélkül, a szám a gyógyszer előtti szintnél alacsonyabb szinten stabilizálódhat klinikai következmények nélkül. A gyógyszer beadása előtti vérlemezkeszám és a kezelés alatti gyakori vérlemezkeszám ajánlott, hogy segítse az adagmódosítással kapcsolatos döntéseket.
Ha a vérlemezkeszám kevesebb, mint 150 000/mm3, a következő intézkedések mérlegelhetők:
* A teljes napi adagot változatlanul kell tartani, mivel egyes esetekben a számlálás vagy stabilizálódott, vagy visszatért a kezelés előtti szintre. * Csökkentse a teljes napi adagot. * Hagyja abba az Inamrinont, ha az orvos klinikai megítélése szerint a kockázat meghaladja a lehetséges előnyöket.
gastrointestinalis mellékhatások: míg a gastrointestinalis mellékhatásokat ritkán észlelték intravénás terápia esetén, ha súlyos vagy legyengítő tünetek jelentkeznek, az orvos csökkentheti az adagot vagy abbahagyhatja a gyógyszert a szokásos haszon-kockázat megfontolások alapján.
májtoxicitás: Az intravénás alkalmazás eddigi klinikai tapasztalatai során ritkán figyeltek meg hepatotoxicitást. Ha a májenzimek akut, markáns elváltozásai idioszinkratikus túlérzékenységi reakcióra utaló klinikai tünetekkel együtt jelentkeznek, az Inamrinon-kezelést azonnal abba kell hagyni.
ha klinikai tünetek nélkül kevesebb, mint jelentős enzimváltozás következik be, ezeket a nem specifikus változásokat egyedi alapon kell értékelni. A klinikus folytathatja az Inamrinont, csökkentheti az adagot, vagy abbahagyhatja a gyógyszert a szokásos haszon/kockázat megfontolások alapján.
túladagolás
az inamrinon súlyos véletlen túladagolása (840 mg három órán át kezdeti bólus és infúzió formájában) halálos kimenetelű volt, bár az OKI összefüggés bizonytalan. A készítmény elkészítése és alkalmazása során körültekintően kell eljárni.
az Inamrinon dózisai értágító hatása miatt hipotenziót okozhatnak. Ha ez bekövetkezik, az Inamrinon alkalmazását csökkenteni kell, vagy abba kell hagyni. Specifikus antidotum nem ismert, de a keringés támogatására általános intézkedéseket kell tenni.
patkányokban az INAMRINON LD50 laktátsóként 102 mg/kg vagy 130 mg/kg volt intravénásan két különböző vizsgálatban és 132 mg/kg orálisan (intragasztrikusan); vizes gumi tragakant szuszpenzióként az orális LD50 239 mg/kg volt.
Inamrinon Adagolás és alkalmazás
az Inamrinon injekció telítő adagjait a mellékelt (hígítatlan) formában kell beadni. Az Inamrinon infúziókat normál vagy fél normál sóoldatban lehet beadni 1 mg/mL-3 mg/mL koncentrációig. A hígított oldatokat 24 órán belül fel kell használni.
az Inamrinon injekció beadható futó dextróz (glükóz) infúziókba egy Y-csatlakozón keresztül vagy közvetlenül a csőbe, ahol kívánatos.
kémiai kölcsönhatások
a kémiai kölcsönhatás lassan, 24 órás időszak alatt következik be, amikor az inamrinon intravénás oldatát közvetlenül dextróz (glükóz) tartalmú oldatokkal keverik. Ezért az Inamrinont nem szabad dextrózt (glükózt) tartalmazó oldatokkal hígítani az injekció beadása előtt.
azonnal kémiai kölcsönhatás lép fel, amelyet csapadék képződése bizonyít, amikor a furoszemidot inamrinon infúzió intravénás vonalába injektálják. Ezért a furoszemid nem adható inamrinont tartalmazó intravénás szerelékekben.
az Inamrinon injekció beadására a következő eljárás javasolt:
1. A kezelést 0, 75 mg/ttkg telítő adaggal kell kezdeni, lassan, 2-3 perc alatt.
|
LOADING DOSE DETERMINATION 0.75 mg/kg (undiluted) |
||||||||||
|
Patient Weight in kg |
||||||||||
|
mL of undiluted Inamrinone Injection |
||||||||||
2. Continue therapy with a maintenance infusion between 5 mcg/kg/min and 10 mcg/kg/min.
3. Based on clinical response, an additional loading dose of 0.75 mg/kg may be given 30 minutes after the initiation of therapy.
4. Az infúzió sebessége általában 5 mcg/kg/perc és 10 mcg/kg/perc között mozog, így az ajánlott teljes napi adag (beleértve a telítő adagokat is) nem haladja meg a 10 mg/kg-ot. Korlátozott számú, nagyobb dózisokkal vizsgált beteg támogatja a napi 18 mg/kg-ig terjedő adagolási rendet a kezelés rövidebb időtartama alatt.
a következő infúziós sebesség diagram használható a számítások helyes elvégzésének biztosítására.
a diagram használatához az alkalmazott inamrinon infúziós oldat koncentrációjának 2,5 mg/mL-nek (2500 mcg/mL) kell lennie. Ezt a koncentrációt úgy állítjuk elő, hogy az Inamrinon oldatot azonos térfogatú hígítóval (normál vagy fél normál sóoldattal) keverjük össze.
| * hígítás: az infúzióhoz ajánlott 2,5 mg/mL koncentráció elkészítéséhez az Inamrinont azonos térfogatú hígítószerrel kell összekeverni. Például keverjen össze három 20 mL-es inamrinon injekciós üveget (3 x 20 mL = 60 mL) 60 mL hígítóval, hogy összesen 120 mL legyen a végső 2, 5 mg/mL Inamrinon oldat. | ||||||||||
|
Inamrinone IV INFUSION RATE (mL/hr) CHART Using 2.5 mg/mL Infusion Concentration* |
||||||||||
|
Patient Weight in kg |
||||||||||
|
Dosage: 5.0 mcg/kg/min |
||||||||||
|
7.5 mcg/kg/min |
||||||||||
|
10.0 mcg/kg/min |
||||||||||
Example: A 70 kg patient would require a loading dose of 10.5 mL of undiluted Inamrinone. If the physician selects a dose of 7.5 mcg/kg/perc az infúzió esetében az áramlási sebesség 13 mL/óra lenne az Inamrinon 2,5 mg/mL koncentrációjánál.
5. Az alkalmazás sebességét és a kezelés időtartamát a beteg válaszreakciójának megfelelően kell beállítani. Az orvos a klinikai reakciókészség vagy a nemkívánatos hatások alapján csökkentheti vagy titrálhatja az infúziót.
a fenti adagolási sémák várhatóan a legtöbb beteg inamrinon plazmakoncentrációját körülbelül 3 mcg/mL-re teszik. A szívindex növekedése lineáris kapcsolatot mutat a plazmakoncentrációval 0 tartományban.5 mcg / mL – től 7 mcg / mL-ig. Nagyobb plazmakoncentrációk esetén nem végeztek megfigyeléseket.
a beteg javulása tükröződhet a szívteljesítmény növekedésében, a pulmonalis kapilláris ék nyomásának csökkenésében, valamint olyan klinikai válaszokban, mint a dyspnoe enyhülése és a szívelégtelenség egyéb tüneteinek javulása, mint pl. az orthopnea és a fáradtság.
a centrális vénás nyomás (CVP) monitorozása értékes lehet a hipotenzió értékelésében és a folyadékegyensúly kezelésében. Az inamrinonnal történő kielégítő válasz eléréséhez elengedhetetlen a folyadék/elektrolit előzetes korrekciója vagy beállítása.
a parenterális gyógyszereket szemrevételezéssel ellenőrizni kell, és nem szabad felhasználni, ha részecskéket vagy elszíneződést észlelnek.
hogyan kerül forgalomba az Inamrinon?
az INAMRINONE injekció az USP egyadagos, 20 mL-es steril, tiszta sárga oldatot tartalmazó injekciós üvegben kerül forgalomba, egyenként dobozolva. NDC 55390-042-10.
minden 1 mL 5 mg Inamrinonnak megfelelő Inamrinon-laktátot tartalmaz.
fénytől védve tartandó. A csomagolás fényálló a tárolás során. A felhasználásig a dobozban tárolandó.
szabályozott szobahőmérsékleten 15-30 C (59-86 F) közötti hőmérsékleten tárolandó.
Manufactured by: Manufactured for:
Ben Venue Laboratories, Inc. Bedford Laboratories™
Bedford, OH 44146 Bedford, OH 44146
August 2002 AMR-P01
VIAL LABEL

Vial Label 100 mg/20 mL
| Inamrinone Inamrinone injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Bedford Laboratories (884528407)
Registrant – Ben Venue Laboratories (004327953)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Ben Venue Laboratories Inc. | 004327953 | MANUFACTURE(55390-042) | |
More about inamrinone
- Side Effects
- During Pregnancy
- Dosage Information
- Drug Interactions
- Drug class: inotropic agents
Related treatment guides
- Heart Failure
Medical Disclaimer