
Sau (Larry) Lee, Ph.D., a tesztelési és Kutatási Hivatal igazgatóhelyettese és az Emerging Technology Team elnöke, gyógyszerészeti minőségügyi Hivatal, CDER
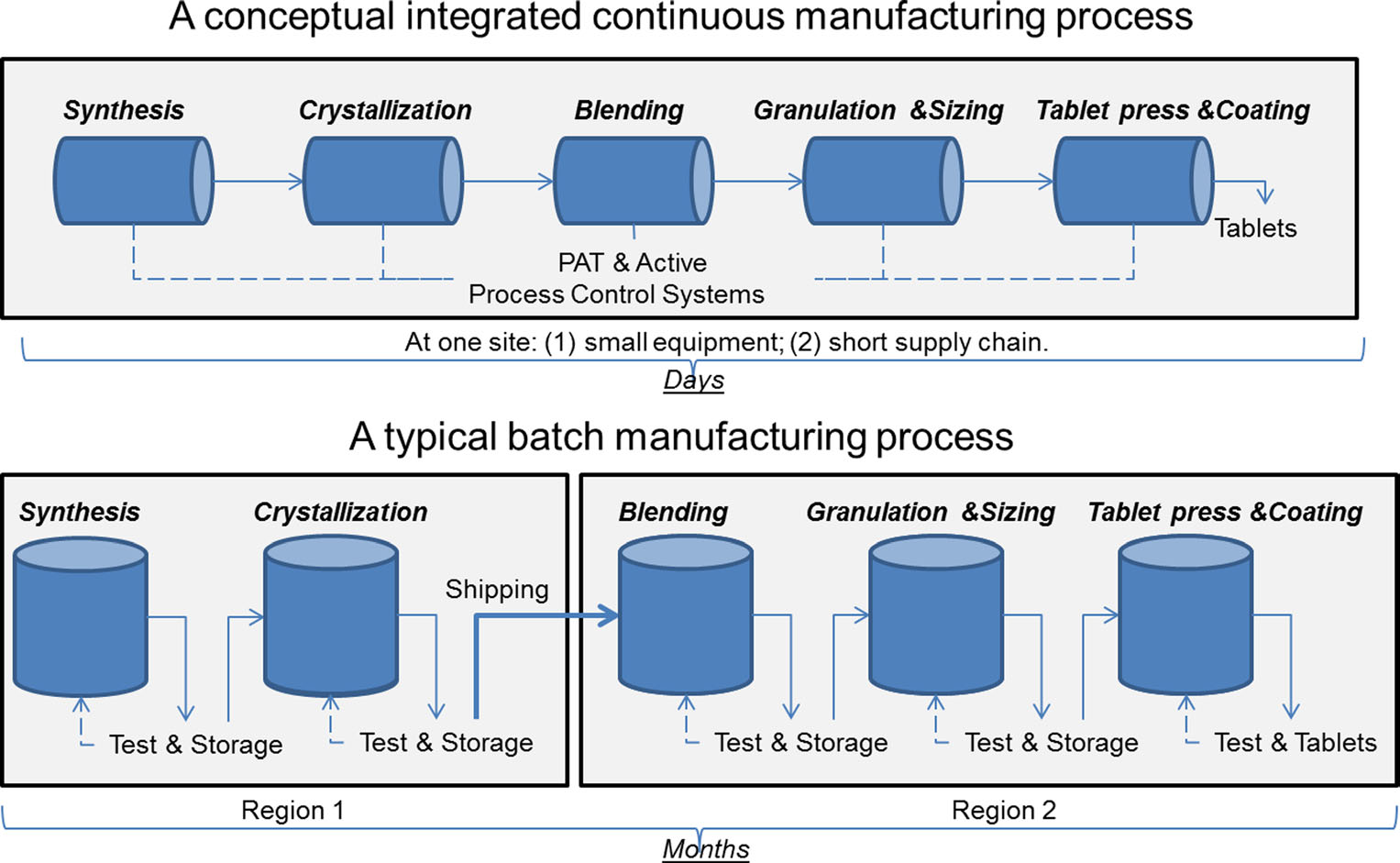 a folyamatos gyártás és a kötegelt gyártás összehasonlítása. Kép jóvoltából Sau Lee. J. Pharm Innov (2015) 10:191-199.
a folyamatos gyártás és a kötegelt gyártás összehasonlítása. Kép jóvoltából Sau Lee. J. Pharm Innov (2015) 10:191-199.Több mint 50 éve a gyógyszereket “kötegelt gyártás” néven ismert módszerrel állítják elő, amely egy többlépcsős, hosszadalmas folyamat, amely nem megfelelő, nagyméretű berendezések használatát foglalja magában. A gyártási technológia legújabb fejleményei azonban arra késztették a gyógyszeripart, hogy fontolja meg a kötegelt gyártástól való elmozdulást egy gyorsabb, hatékonyabb folyamat felé, amelyet folyamatos gyártásnak neveznek. Az FDA proaktív lépéseket tesz annak érdekében, hogy megkönnyítse a gyógyszeripar számára a feltörekvő technológiák bevezetését, beleértve a folyamatos gyártást, a termékminőség javítása és a gyógyszerhiány és visszahívások számos mögöttes okának kezelése érdekében.
kötegelt vs.folyamatos gyártás
a kötegelt gyártás több különálló lépést foglal magában. A folyamat minden egyes lépése után a gyártás általában leáll, így a mintákat offline módon lehet tesztelni a minőség szempontjából. Néha ezekben a lépések közötti “tartási időkben” az anyagot konténerekben tárolhatják, vagy a gyártási folyamat befejezéséhez a világ más létesítményeibe szállíthatják. Ez heteket vagy hónapokat adhat a feldolgozási időhöz. Egyes hatóanyagok, amelyek érzékenyek a környezetre, ez is vezethet a lebomlás kockázatát. Ezen túlmenően, ha egy bizonyos gyógyszer iránti kereslet megugrik, a megnövekedett termelés nagyobb felszerelést igényelhet. A berendezések növelése több fizikai helyet, nagyobb lábnyomot, valamint több időt és pénzt igényel.
ezzel szemben a folyamatos gyártással előállított gyógyszerek megállás nélkül mozognak ugyanabban a létesítményben, kiküszöbölve a lépések közötti tartási időt. Az anyagot a teljesen integrált alkatrészek összeszerelő során keresztül táplálják. Ez a módszer időt takarít meg, csökkenti az emberi hibák valószínűségét, és fürgébben reagál a piaci változásokra. A nagyobb kereslet miatt a folyamatos gyártás hosszabb ideig tarthat, ami csökkentheti a gyógyszerhiány valószínűségét.
mindkét gyártási típusra ugyanazok a minőség-ellenőrzési szabványok vonatkoznak, de a folyamatos gyártási létesítményekben a monitorozás automatizált, és általában gyakoribb, mint a kötegelt gyártásban. Mint minden technológia, a folyamatos gyártóberendezések is kopást tapasztalhatnak, de az automatizált felügyelet jóval a hiba bekövetkezése előtt észlelheti a problémákat. Az ilyen ellenőrzés segíthet megjósolni egy berendezés várható élettartamát is, ami jobb proaktív karbantartáshoz vezet.
végül a folyamatos gyártás rugalmasabb nyomon követést és nyomon követést tesz lehetővé, ami előnyt jelent a termék meghibásodása esetén. Például a kötegelt gyártás során a gyógyszer meghatározott mennyiségét (vagy tételét) az előállító berendezés mérete határozza meg. A folyamatos gyártás során egy mennyiséget (vagy tételt) időbélyegzővel, az előállított gyógyszer mennyiségével vagy a nyers alapanyag mennyiségével lehet meghatározni. Ezek a nyomonkövetési módszerek lehetővé teszik a gyártó számára, hogy a folyamat meghibásodása esetén kisebb mennyiségű hibás anyagot izoláljon, ami kevesebb hulladékhoz és kevesebb hiányhoz vezet.
kihívást jelentő, de érdemes átmenet
számos iparág—például a vegyipar és a petrolkémiai ipar—már gyártási fejlődésen ment keresztül, és hatékony folyamatos technológiákat alkalmaz a termékek biztonságos előállításához. A gyógyszeripar számára azonban a folyamatos gyártásra való áttérés több okból is még korai szakaszában van. Először is, az ilyen átmenet indítási költségei magasak lehetnek. A régi kötegelt berendezések visszavonása, az új technológia megvásárlása és a személyzet képzése annak használatára, valamint az ipari infrastruktúra átalakítása drága, ami komoly elkötelezettséget igényel a gyógyszergyártótól. Ennek ellenére a gazdasági elemzések jelentős hosszú távú megtakarításokat mutattak ki. Ezenkívül egyes technológiáknak még ki kell érniük, mielőtt kereskedelmi szempontból életképesek lennének. Bizonyos típusú gyógyszerek, például biológiai termékek esetében előfordulhat, hogy a folyamatos gyártással történő előállításuk technológiája még nem létezik. Kutatások folynak ezen és más kihívások kezelésére. Ezenkívül a gyógyszergyártók továbbra is érzékelik a szabályozási bizonytalanságot, amely késleltetheti a termék jóváhagyását egy új gyártási technológia használatakor.
mivel az iparág mérlegeli, hogyan lehet a váltást, az FDA forrásokat és információkat biztosít az átmenet megkönnyítéséhez. Például az ügynökség együttműködik a Biomedical Advanced Research and Development Authority programmal, amely az Egyesült Államok Egészségügyi és Humán szolgáltatási Minisztériumának programja, hogy segítse a kutatás finanszírozását és támogatását ezen a területen. Felülvizsgáló munkatársainkat is képezzük, és belső kutatásokat végzünk a folyamatos gyártáshoz kapcsolódó kockázati területeken, hogy jobban fel tudjuk mérni a kapcsolódó technológiákat.
multidiszciplináris csapatot vezetek az Emerging Technology Program keretében a Cder gyógyszerészeti minőségügyi irodájában. A programot azért hozták létre, hogy segítse az ipart az innovatív technológiák megvalósításában a termékminőség javítása és az ipar korszerűsítése érdekében, annak érdekében, hogy kezeljék a kábítószerhiány vagy a visszahívások mögöttes okait. A feltörekvő technológiai Program nemcsak a folyamatos gyártási technológiákkal foglalkozik, hanem más előrelépésekkel is, mint például a 3D nyomtatás, az új adagolási formák és az új konténerrendszerek. E program keretében az új technológia fejlesztésének korai szakaszában foglalkozunk az iparral, és megvitatjuk a várható szabályozási vagy tudományos kérdéseket, amelyek egy jövőbeli alkalmazás részét képezhetik.
sok vállalat jelentkezett a feltörekvő technológiai programra a folyamatos gyártás iránti érdeklődésük tekintetében. Az FDA dokumentum címe: Advancement of Emerging Technology Applications to Modernize the Pharmaceutical Manufacturing Base Guidance for Industry tájékoztatást és tanácsot ad arról, hogyan kell együttműködni az ügynökséggel a fejlesztési folyamat elején.
További információ az FDA erőfeszítéseiről a gyógyszergyártás korszerűsítésére az FDA Hangblogjában.