szinte az összes Fe-s fehérjében a fe központok tetraéderek, a terminális ligandumok pedig ciszteinil-maradékok tiolato-kénközpontjai. A szulfidcsoportok két vagy három koordináltak. Három különböző típusú fe-s klaszterek ezekkel a jellemzőkkel a leggyakoribb.
2Fe–2s clustersEdit

a legegyszerűbb polimetallikus rendszert, a klasztert, két vasion alkotja, amelyeket a klaszter két szulfidion, amelyeket négy ciszteinil ligandum (fe2s2 ferredoxinokban) vagy két cisztein és két hisztidin (rieske fehérjékben) koordinál. Az oxidált fehérjék két Fe3 + iont tartalmaznak, míg a redukált fehérjék egy Fe3 + és egy Fe2+ iont tartalmaznak. Ezek a fajok két oxidációs állapotban léteznek, (FeIII)2 és FeIIIFeII. A CDGSH vas-kén domén a 2Fe-2s klaszterekhez is kapcsolódik.
4Fe–4S clustersEdit
a közös motívum négy vasion és négy szulfidion található a csúcsok egy Kubán típusú klaszter. Az Fe központokat általában tovább koordinálják ciszteinil ligandumok. Az elektrontranszfer fehérjék (ferredoxinok) tovább oszthatók alacsony potenciálú (bakteriális típusú) és nagy potenciálú (HiPIP) ferredoxinokra. Az alacsony és nagy potenciállal rendelkező ferredoxinok a következő redox sémával állnak kapcsolatban:

a HiPIP-ben a klaszter (Fe4S42+) és (Fe4S43+) között közlekedik. Ennek a redox párnak a potenciálja 0,4-0,1 V. a bakteriális ferredoxinokban az oxidációs állapotok párja (Fe4S4+) és (Fe4S42+). Ennek a redox párnak a potenciálja -0,3–0,7 V. A 4Fe-4S klaszterek két családja megosztja a Fe4S42+ oxidációs állapot. A redox Párok különbségét a hidrogénkötés mértékének tulajdonítják, amely erősen módosítja a ciszteinil-tiolát ligandumok bázikusságát. Egy további redox pár, amely még mindig redukálóbb, mint a bakteriális ferredoxinok, szerepet játszik a nitrogenázban.
egyes 4FE-4S klaszterek szubsztrátokat kötnek, ezért enzimkofaktoroknak minősülnek. Az akonitázban az Fe-s klaszter megköti az akonitátot abban az egy Fe központban, amelyből hiányzik a tiolát ligandum. A klaszter nem megy át redoxon, hanem Lewis-savas katalizátorként szolgál a citrát izocitráttá történő átalakításához. A radikális SAM enzimekben a klaszter megköti és csökkenti az S-adenozil-metionint, hogy létrehozzon egy gyököt, amely számos bioszintézisben részt vesz.
3FE-4S clustersEdit
a fehérjékről ismert, hogy centrumokat is tartalmaznak, amelyek egy vassal kevesebbet tartalmaznak, mint a gyakoribb magok. Három szulfidion hidal át két-két vasionot, míg a negyedik szulfid három vasionot. Formális oxidációs állapotuk + (all-Fe3+ forma) és 2− (all-Fe2+ forma) között változhat. Számos vas-kén fehérjében a klaszter reverzibilisen átalakítható egy vasion oxidációjával és elvesztésével klaszterré. Pl., az akonitáz inaktív formája rendelkezik és Fe2 + és redukálószer hozzáadásával aktiválódik.
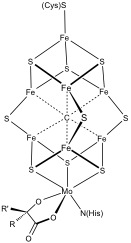
Egyéb Fe-s klaszterekszerkesztés
a bonyolultabb polimetallikus rendszerek gyakoriak. Ilyenek például mind a 8FE, mind a 7FE klaszterek a nitrogenázban. A szén-monoxid-dehidrogenáz és a–hidrogénáz szintén szokatlan fe-s klasztereket tartalmaz. Egy speciális 6 cisztein-koordinált klasztert találtak az oxigéntűrő membránhoz kötött hidrogénázokban.