Forme posologique: injection
Revue médicale par Drugs.com . Dernière mise à jour le 22 déc. 2020.
- Effets secondaires
- Posologie
- Professionnel
- Interactions
- Grossesse
- Plus
Rx UNIQUEMENT.
Solution intraveineuse stérile
- Inamrinone Description
- Inamrinone – Pharmacologie clinique
- Pharmacocinétique
- Pharmacodynamique
- Indications et utilisation de l’Inamrinone
- Contre-indications
- Mises en garde
- Précautions
- Généralités
- Tests de laboratoire
- Interactions médicamenteuses
- Interactions chimiques
- Carcinogenèse, Mutagénèse, Altération de la fertilité
- Grossesse
- Mères allaitantes
- Utilisation pédiatrique
- Effets indésirables
- Prise en charge des Effets indésirables
- Surdosage
- Posologie et administration de l’Inamrinone
- Interactions chimiques
- Comment l’Inamrinone est-elle fournie
- VIAL LABEL
- More about inamrinone
- Related treatment guides
Inamrinone Description
Injection d’Inamrinone USP représente une nouvelle classe d’agents inotropes cardiaques distincts des glycosides digitaliques ou des catécholamines. Le lactate d’inamrinone est désigné chimiquement sous le nom de 5-Amino-6 (1H)-one 2-hydroxypropanate et a la structure suivante:
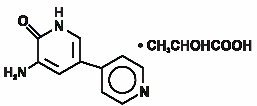
L’inamrinone est un composé cristallin jaune pâle avec un poids moléculaire de 187,20 et une formule moléculaire de C10H9N3O. Chaque mole d’acide lactique a un poids moléculaire de 90,08 et un poids formule de C3H6O3. Les solubilités de l’Inamrinone à pH 4,1, 6,0 et 8,0 sont respectivement de 25, 0,9 et 0,7 mg/ mL.
L’inamrinone injectable est une solution stérile jaune clair disponible en flacons de 20 mL pour administration intraveineuse. Chaque mL contient du lactate d’Inamrinone équivalent à 5 mg d’Inamrinone et 0,25 mg de métabisulfite de sodium ajouté comme conservateur dans de l’eau pour injection. Toutes les doses exprimées dans la notice sont exprimées en termes de base, l’Inamrinone. Le pH est ajusté entre 3,2 et 4,0 avec de l’acide lactique ou de la soude. La concentration totale d’acide lactique peut varier entre 5 mg et 7,5 mg.
Inamrinone – Pharmacologie clinique
L’inamrinone est un agent inotrope positif à activité vasodilatatrice, dont la structure et le mode d’action diffèrent des glycosides digitaliques ou des catécholamines.
Le mécanisme de ses effets inotropes et vasodilatateurs n’a pas été complètement élucidé.
En ce qui concerne son effet inotrope, les preuves expérimentales indiquent qu’il ne s’agit pas d’un agoniste bêta-adrénergique. Il inhibe l’activité de l’adénosine monophosphate cyclique myocardique (c-AMP) phosphodiestérase et augmente les niveaux cellulaires de c-AMP. Contrairement à la digitale, elle n’inhibe pas l’activité de l’adénosine triphosphatase sodium-potassium.
En ce qui concerne son activité vasodilatatrice, l’Inamrinone réduit la postcharge et la précharge par son effet relaxant direct sur le muscle lisse vasculaire.
Pharmacocinétique
Après une injection en bolus intraveineux (1 à 2 minutes) de 0,68 mg/kg à 1,2 mg/kg chez des volontaires normaux, l’Inamrinone avait un volume de distribution de 1,2 litre/kg et, après une demi-vie en phase distributive d’environ 4,6 minutes dans le plasma, avait une demi-vie apparente moyenne d’élimination terminale du premier ordre d’environ 3,6 heures. Chez les patients souffrant d’insuffisance cardiaque congestive recevant des perfusions d’Inamrinone, la demi-vie apparente moyenne d’élimination terminale de premier ordre était d’environ 5,8 heures.
Dans une étude, il a été démontré que l’inamrinone était liée de 10 % à 22% aux protéines plasmatiques humaines par ultrafiltration in vitro, et dans une autre étude, de 35 % à 49 % par ultrafiltration ou dialyse à l’équilibre.
La principale voie d’excrétion chez l’homme se fait par l’urine sous forme d’Inamrinone et de plusieurs métabolites (N-glycolyl, N-acétate, O-glucuronide et N-glucuronide). Chez les volontaires normaux, environ 63 % d’une dose orale d’Inamrinone marquée au 14C-I a été excrétée dans les urines sur une période de 96 heures. Au cours des 8 premières heures, 51% de la radioactivité dans l’urine était de l’Inamrinone avec 5% sous forme de N-acétate, 8% sous forme de N-glycolate et moins de 5% pour chaque glucuronide. Environ 18% de la dose administrée a été excrétée dans les fèces en 72 heures.
Dans une étude intraveineuse non radioactive de 24 heures, 10% à 40% de la dose a été excrétée dans l’urine sous forme d’Inamrinone inchangée, le métabolite N-acétyle représentant moins de 2% de la dose.
Chez les patients souffrant d’insuffisance cardiaque congestive, après une dose de bolus de charge, des taux plasmatiques à l’état d’équilibre d’environ 2,4 mcg / mL ont pu être maintenus par une perfusion de 5 mcg / kg/min à 10 mcg / kg/min. Chez certains patients souffrant d’insuffisance cardiaque congestive, avec perfusion rénale et hépatique compromise associée, il est possible que les taux plasmatiques d’Inamrinone augmentent pendant la période de perfusion; par conséquent, chez ces patients, il peut être nécessaire de surveiller la réponse hémodynamique et / ou le taux de médicament. Les principales mesures de la réponse du patient comprennent l’indice cardiaque, la pression du coin capillaire pulmonaire, la pression veineuse centrale et leur relation avec les concentrations plasmatiques. De plus, des mesures de la pression artérielle, de la production d’urine et du poids corporel peuvent s’avérer utiles, tout comme des symptômes cliniques tels que l’orthopnée, la dyspnée et la fatigue.
Pharmacodynamique
Chez les patients présentant une fonction myocardique déprimée, l’Inamrinone produit une augmentation rapide du débit cardiaque en raison de ses actions inotropes et vasodilatatrices.
Après une dose unique en bolus intraveineux d’Inamrinone de 0.75 mg / kg à 3 mg / kg chez les patients présentant une insuffisance cardiaque congestive, une augmentation maximale du débit cardiaque liée à la dose se produit (d’environ 28% à 0,75 mg / kg à environ 61% à 3 mg / kg). L’effet maximal se produit dans les 10 minutes à toutes les doses. La durée de l’effet dépend de la dose, pendant environ 1/2 heure à 0,75 mg / kg et environ 2 heures à 3 mg / kg.
Sur la même plage de doses, la pression du coin capillaire pulmonaire et la résistance périphérique totale présentent des diminutions liées à la dose (diminutions maximales moyennes de 29 % de la pression du coin capillaire pulmonaire et de 29 % de la résistance vasculaire systémique). À des doses allant jusqu’à 3 mg/ kg, des diminutions liées à la dose de la pression diastolique (jusqu’à 13%) ont été observées. La pression artérielle moyenne diminue (9,7%) à une dose de 3 mg / kg. La fréquence cardiaque est généralement inchangée.
Les modifications des paramètres hémodynamiques sont maintenues pendant la perfusion intraveineuse continue et pendant plusieurs heures par la suite.
L’inamrinone est efficace chez les patients entièrement numérisés sans provoquer de signes de toxicité des glycosides cardiaques. Ses effets inotropes s’ajoutent à ceux de la digitale. En cas de flutter / fibrillation auriculaire, il est possible que l’Inamrinone augmente le taux de réponse ventriculaire en raison de sa légère amélioration de la conduction A / V. Dans ces cas, un traitement préalable à la digitale est recommandé.
Une amélioration de la fonction ventriculaire gauche et un soulagement de l’insuffisance cardiaque congestive chez les patients atteints de cardiopathie ischémique ont été observés. L’amélioration s’est produite sans induire de symptômes ou de signes électrocardiographiques d’ischémie myocardique.
À fréquence cardiaque et pression artérielle constantes, des augmentations du débit cardiaque se produisent sans augmentation mesurable de la consommation d’oxygène myocardique ni modification de la différence d’oxygène artérioveineux.
L’activité inotrope est maintenue après des doses intraveineuses répétées d’Inamrinone. L’administration d’inamrinone produit des avantages hémodynamiques et symptomatiques chez les patients non contrôlés de manière satisfaisante par un traitement conventionnel avec des diurétiques et des glycosides cardiaques.
Indications et utilisation de l’Inamrinone
L’injection d’Inamrinone est destinée à la prise en charge à court terme de l’insuffisance cardiaque congestive. En raison de l’expérience limitée et du potentiel d’effets indésirables graves (voir EFFETS INDÉSIRABLES), l’Inamrinone ne doit être utilisée que chez les patients pouvant être étroitement surveillés et n’ayant pas répondu de manière adéquate aux digitaliques, aux diurétiques et / ou aux vasodilatateurs. L’expérience avec l’Inamrinone intraveineuse dans les essais contrôlés ne s’étend pas au-delà de 48 heures de bolus répétés et / ou de perfusions continues.
Qu’il soit administré par voie orale, en continu par voie intraveineuse ou par intermittence par voie intraveineuse, ni l’inamrinone ni aucun autre inotrope cyclique-AMP-dépendant n’a été démontré dans des essais contrôlés comme étant sûr ou efficace dans le traitement à long terme de l’insuffisance cardiaque congestive. Dans les essais contrôlés de traitement oral chronique avec divers agents de ce type (y compris l’Inamrinone), les symptômes n’ont pas été systématiquement atténués et les inotropes cycliques dépendants de l’AMP étaient systématiquement associés à des risques accrus d’hospitalisation et de décès. Les patients présentant des symptômes de classe IV de la NYHA semblaient être particulièrement à risque.
Contre-indications
L’inamrinone est contre-indiquée chez les patients qui y sont hypersensibles.
Il est également contre-indiqué chez les patients connus pour être hypersensibles aux bisulfites.
Mises en garde
Contient du métabisulfite de sodium, un sulfite qui peut provoquer des réactions de type allergique, y compris des symptômes anaphylactiques et des épisodes asthmatiques potentiellement mortels ou moins graves chez certaines personnes sensibles. La prévalence globale de la sensibilité au sulfite dans la population générale est inconnue et probablement faible. La sensibilité au sulfite est plus fréquente chez les personnes asthmatiques que chez les personnes non asthmatiques.
Précautions
Généralités
L’inamrinone ne doit pas être utilisée chez les patients présentant une maladie valvulaire aortique ou pulmonique sévère au lieu d’un soulagement chirurgical de l’obstruction. Comme d’autres agents inotropes, il peut aggraver l’obstruction des voies de sortie dans la sténose sous-aortique hypertrophique.
Pendant le traitement intraveineux par l’Inamrinone, la pression artérielle et la fréquence cardiaque doivent être surveillées et la vitesse de perfusion ralentie ou arrêtée chez les patients présentant une diminution excessive de la pression artérielle.
Les patients ayant reçu un traitement diurétique vigoureux peuvent présenter une pression de remplissage cardiaque insuffisante pour répondre de manière adéquate à l’Inamrinone, auquel cas une libéralisation prudente de l’apport hydrique et électrolytique peut être indiquée.
Des arythmies supraventriculaires et ventriculaires ont été observées dans la population à très haut risque traitée. Alors que l’inamrinone en soi ne s’est pas avérée arythmogène, le potentiel d’arythmie, présent dans l’insuffisance cardiaque congestive elle-même, peut être augmenté par tout médicament ou combinaison de médicaments.
Une thrombocytopénie et une hépatotoxicité ont été observées (voir EFFETS INDÉSIRABLES).
UTILISATION DANS L’INFARCTUS AIGU DU MYOCARDE
Aucun essai clinique n’a été réalisé chez des patients en phase aiguë d’infarctus post-myocardique. Par conséquent, l’inamrinone n’est pas recommandée dans ces cas.
Tests de laboratoire
Fluides et électrolytes
Les modifications des fluides et des électrolytes et la fonction rénale doivent être surveillées attentivement pendant le traitement par l’Inamrinone. L’amélioration du débit cardiaque avec diurèse qui en résulte peut nécessiter une réduction de la dose de diurétique. La perte de potassium due à une diurèse excessive peut prédisposer les patients numérisés aux arythmies. Par conséquent, l’hypokaliémie doit être corrigée par une supplémentation en potassium avant ou pendant l’utilisation d’Inamrinone.
Interactions médicamenteuses
Dans une expérience relativement limitée, aucune manifestation clinique indésirable n’a été observée chez des patients chez lesquels l’Inamrinone a été utilisée en même temps que les médicaments suivants: glycosides digitaliques; lidocaïne, quinidine; métoprolol, propranolol; hydralazine, prazosine; dinitrate d’isosorbide, nitroglycérine; chlorthalidone, acide éthacrynique, furosémide, hydrochlorothiazide, spironolactone; captopril; héparine, warfarine; suppléments de potassium; insuline; diazépam.
Un cas d’hypotension excessive a été rapporté lorsque l’inamrinone était utilisée en même temps que le disopyramide.
Jusqu’à ce qu’une expérience supplémentaire soit disponible, l’administration concomitante de disopyramide doit être entreprise avec prudence.
Interactions chimiques
Une interaction chimique se produit lentement sur une période de 24 heures lorsque la solution intraveineuse d’Inamrinone est mélangée directement à des solutions contenant du dextrose (glucose). PAR CONSÉQUENT, L’Inamrinone NE DOIT PAS ÊTRE DILUÉE AVEC DES SOLUTIONS CONTENANT DU DEXTROSE (GLUCOSE) AVANT L’INJECTION.
Une interaction chimique se produit immédiatement, ce qui est mis en évidence par la formation d’un précipité lors de l’injection de furosémide dans une ligne intraveineuse d’une perfusion d’Inamrinone. Par conséquent, le furosémide ne doit pas être administré dans des lignes intraveineuses contenant de l’inamrinone.
Carcinogenèse, Mutagénèse, Altération de la fertilité
Il n’a pas été suggéré de potentiel cancérigène avec l’Inamrinone lorsqu’il est administré par voie orale pendant une période allant jusqu’à deux ans à des rats et des souris à des doses allant jusqu’à la dose maximale tolérée de 80 mg/ kg/ jour.
Le test du micronoyau chez la souris (à 7,5 à 10 fois la dose maximale chez l’humain) et le test d’aberration chromosomique de l’ovaire du hamster chinois ont été positifs indiquant à la fois un potentiel clastogène et une suppression du nombre d’érythrocytes polychromatiques. Cependant, le test d’Ames Salmonella, l’étude sur le lymphome de souris et l’analyse de la métaphase des lymphocytes humains en culture étaient tous négatifs. Les effets clastogènes contrastent avec les résultats négatifs obtenus dans les études sur la fertilité masculine et féminine chez le rat et une étude sur trois générations chez le rat, les deux avec administration orale.
Un léger allongement de la période de gestation chez le rat a été observé dans ces études à des doses de 50 mg/kg/jour et de 100 mg/kg/jour. Des dystocies se sont produites chez les mères recevant 100 mg / kg / jour, entraînant une augmentation du nombre de mortinaissances, une diminution de la taille de la portée et une faible survie des petits.
Grossesse
Effets tératogènes – Catégorie de grossesse C
Chez les lapins blancs de Nouvelle-Zélande, il a été démontré que l’inamrinone produisait des malformations squelettiques fœtales et externes grossières à des doses orales de 16 mg/kg et de 50 mg/kg toxiques pour le lapin. Des études chez des lapins français Hy/Cr utilisant des doses orales allant jusqu’à 32 mg/ kg/ jour n’ont pas confirmé cette découverte. Aucune malformation n’a été observée chez les rats recevant de l’Inamrinone par voie intraveineuse à la dose maximale utilisée, 15 mg / kg / jour (environ la dose intraveineuse quotidienne recommandée pour les patients présentant une insuffisance cardiaque congestive). Il n’existe pas d’études adéquates et bien contrôlées chez la femme enceinte. L’inamrinone ne doit être utilisée pendant la grossesse que si le bénéfice potentiel justifie le risque potentiel pour le fœtus.
Mères allaitantes
La prudence est de mise lorsque l’inamrinone est administrée aux femmes allaitantes, car on ne sait pas si elle est excrétée dans le lait maternel.
Utilisation pédiatrique
L’innocuité et l’efficacité chez les patients pédiatriques n’ont pas été établies.
Effets indésirables
Thrombocytopénie: L’injection intraveineuse d’Inamrinone a entraîné une réduction du nombre de plaquettes en dessous de 100 000 / mm3 ou des limites normales chez 2,4% des patients.
Il est plus fréquent chez les patients recevant un traitement prolongé. À ce jour, dans des essais cliniques étroitement surveillés, chez des patients dont la numération plaquettaire n’était pas autorisée à rester déprimée, aucun phénomène de saignement n’a été observé.
La réduction plaquettaire dépend de la dose et semble due à une diminution du temps de survie plaquettaire. Plusieurs patients qui ont développé une thrombocytopénie lors de l’Inamrinone ont subi des examens de la moelle osseuse qui étaient normaux. Il n’existe aucune preuve établissant un lien entre la réduction plaquettaire et la réponse immunitaire ou un facteur d’activation plaquettaire.
Effets gastro-intestinaux: Les effets indésirables gastro-intestinaux rapportés avec l’Inamrinone pendant l’utilisation clinique comprenaient des nausées (1,7 %), des vomissements (0,9 %), des douleurs abdominales (0,4 %) et une anorexie (0,4 %).
Effets cardiovasculaires: Les effets indésirables cardiovasculaires rapportés avec l’Inamrinone comprennent une arythmie (3%) et une hypotension (1,3%).
Toxicité hépatique: Chez les chiens, à des doses intraveineuses comprises entre 9 mg/kg/jour et 32 mg/kg/jour, l’inamrinone a montré une hépatotoxicité liée à la dose se manifestant soit par une élévation de l’enzyme, soit par une nécrose des cellules hépatiques, ou les deux. Une hépatotoxicité a été observée chez l’homme après administration orale à long terme et a été observée, dans une expérience limitée (0,2%), après administration intraveineuse d’Inamrinone. De rares cas d’élévation des enzymes et de la bilirubine et d’ictère ont également été rapportés.
Hypersensibilité : Plusieurs réactions d’hypersensibilité apparentes ont été rapportées chez des patients traités par Inamrinone orale pendant environ deux semaines. Les signes et symptômes étaient variables, mais comprenaient une péricardite, une pleurite et une ascite (1 cas), une myosite avec ombrage interstitiel à la radiographie thoracique et une vitesse de sédimentation élevée (1 cas) et une vascularite avec densités pulmonaires nodulaires, une hypoxémie et un ictère (1 cas). Le premier patient est décédé, pas nécessairement de la réaction possible, tandis que les deux derniers se sont résolus avec l’arrêt du traitement. Aucun des cas n’a été recalculé, de sorte que l’attribution à l’Inamrinone n’est pas certaine, mais d’éventuelles réactions d’hypersensibilité doivent être envisagées chez tout patient maintenu pendant une période prolongée sous Inamrinone.
Généralités: Les effets indésirables supplémentaires observés dans les études cliniques sur l’Inamrinone par voie intraveineuse comprennent de la fièvre (0,9%), des douleurs thoraciques (0,2 %) et des brûlures au site d’injection (0,2 %).
Prise en charge des Effets indésirables
Réduction de la Numération plaquettaire: La réduction asymptomatique de la numération plaquettaire (jusqu’à < 150 000 / mm3) peut être inversée dans la semaine suivant une diminution de la posologie du médicament. De plus, sans changement de la posologie du médicament, le nombre peut se stabiliser à des niveaux inférieurs à ceux d’avant le médicament sans séquelles cliniques. La numération plaquettaire pré-médicamenteuse et la numération plaquettaire fréquente pendant le traitement sont recommandées pour aider à prendre des décisions concernant les modifications posologiques.
En cas de numération plaquettaire inférieure à 150 000/mm3, les actions suivantes peuvent être envisagées:
• Maintenir la dose quotidienne totale inchangée, car dans certains cas, les comptes se sont stabilisés ou sont revenus aux niveaux de prétraitement. * Diminuer la dose quotidienne totale. * Arrêter l’inamrinone si, selon le jugement clinique du médecin, le risque dépasse le bénéfice potentiel.
Effets secondaires gastro-intestinaux: Bien que des effets secondaires gastro-intestinaux aient rarement été observés avec un traitement par voie intraveineuse, en cas de survenue d’effets graves ou débilitants, le médecin peut souhaiter réduire la posologie ou arrêter le médicament en fonction des considérations habituelles de rapport bénéfice/risque.
Toxicité hépatique: Dans l’expérience clinique à ce jour avec l’administration intraveineuse, l’hépatotoxicité a été rarement observée. Si des altérations aiguës et marquées des enzymes hépatiques se produisent avec des symptômes cliniques suggérant une réaction d’hypersensibilité idiosyncratique, le traitement à l’inamrinone doit être rapidement interrompu.
Si des altérations enzymatiques moins marquées surviennent sans symptômes cliniques, ces modifications non spécifiques doivent être évaluées sur une base individuelle. Le clinicien peut souhaiter poursuivre l’inamrinone, réduire la posologie ou arrêter le médicament en fonction des considérations habituelles de rapport bénéfice / risque.
Surdosage
Un décès a été rapporté avec un surdosage accidentel massif (840 mg en trois heures par bolus initial et perfusion) d’Inamrinone, bien que la relation de cause à effet soit incertaine. La diligence doit être exercée lors de la préparation et de l’administration du produit.
Les doses d’Inamrinone peuvent provoquer une hypotension en raison de son effet vasodilatateur. Si cela se produit, l’administration d’inamrinone doit être réduite ou interrompue. Aucun antidote spécifique n’est connu, mais des mesures générales de soutien circulatoire doivent être prises.
Chez le rat, la DL50 de l’Inamrinone, en tant que sel de lactate, était de 102 mg /kg ou 130 mg / kg par voie intraveineuse dans deux études différentes et de 132 mg / kg par voie orale (intragastrique); en suspension dans la gomme adragante aqueuse, la DL50 par voie orale était de 239 mg / kg.
Posologie et administration de l’Inamrinone
Les doses de charge de l’injection d’Inamrinone doivent être administrées telles que fournies (non diluées). Les perfusions d’Inamrinone peuvent être administrées dans une solution saline normale ou semi-normale à une concentration de 1 mg / mL à 3 mg / mL. Les solutions diluées doivent être utilisées dans les 24 heures.
L’injection d’inamrinone peut être administrée dans des perfusions de dextrose (glucose) en cours d’exécution via un connecteur en Y ou directement dans la tubulure lorsque cela est préférable.
Interactions chimiques
Une interaction chimique se produit lentement sur une période de 24 heures lorsque la solution intraveineuse d’Inamrinone est mélangée directement à des solutions contenant du dextrose (glucose). PAR CONSÉQUENT, L’Inamrinone NE DOIT PAS ÊTRE DILUÉE AVEC DES SOLUTIONS CONTENANT DU DEXTROSE (GLUCOSE) AVANT L’INJECTION.
Une interaction chimique se produit immédiatement, ce qui est mis en évidence par la formation d’un précipité lors de l’injection de furosémide dans une ligne intraveineuse d’une perfusion d’Inamrinone. Par conséquent, le furosémide ne doit pas être administré dans des lignes intraveineuses contenant de l’inamrinone.
La procédure suivante est recommandée pour l’administration d’Inamrinone injectable:
1. Initier le traitement avec une dose de charge de 0,75 mg / kg administrée lentement pendant 2 à 3 minutes.
|
LOADING DOSE DETERMINATION 0.75 mg/kg (undiluted) |
||||||||||
|
Patient Weight in kg |
||||||||||
|
mL of undiluted Inamrinone Injection |
||||||||||
2. Continue therapy with a maintenance infusion between 5 mcg/kg/min and 10 mcg/kg/min.
3. Based on clinical response, an additional loading dose of 0.75 mg/kg may be given 30 minutes after the initiation of therapy.
4. La vitesse de perfusion varie généralement de 5 mcg / kg / min à 10 mcg / kg / min, de sorte que la dose quotidienne totale recommandée (y compris les doses de charge) ne dépasse pas 10 mg / kg. Un nombre limité de patients étudiés à des doses plus élevées soutiennent un schéma posologique allant jusqu’à 18 mg / kg / jour pour des durées de traitement raccourcies.
Le tableau de débit de perfusion suivant peut être utilisé pour s’assurer que les calculs sont effectués correctement.
Pour utiliser le tableau, la concentration de solution pour perfusion d’inamrinone utilisée doit être de 2,5 mg / mL (2 500 mcg / mL). Cette concentration est préparée en mélangeant la solution d’Inamrinone avec un volume égal de diluant (solution saline normale ou demi-normale).
| * Dilution: Pour préparer la concentration de 2,5 mg / mL recommandée pour la perfusion, mélanger l’Inamrinone avec un volume égal de diluant. Par exemple, mélanger trois flacons de 20 mL d’Inamrinone (3 x 20 mL = 60 mL) avec 60 mL de diluant pour un volume total de 120 mL de la solution finale d’Inamrinone à 2,5 mg / mL. | ||||||||||
|
Inamrinone IV INFUSION RATE (mL/hr) CHART Using 2.5 mg/mL Infusion Concentration* |
||||||||||
|
Patient Weight in kg |
||||||||||
|
Dosage: 5.0 mcg/kg/min |
||||||||||
|
7.5 mcg/kg/min |
||||||||||
|
10.0 mcg/kg/min |
||||||||||
Example: A 70 kg patient would require a loading dose of 10.5 mL of undiluted Inamrinone. If the physician selects a dose of 7.5 mcg / kg / min pour la perfusion, le débit serait de 13 mL / h à la concentration de 2,5 mg / mL d’Inamrinone.
5. Le taux d’administration et la durée du traitement doivent être ajustés en fonction de la réponse du patient. Le médecin peut vouloir réduire ou titrer la perfusion vers le bas en fonction de la réactivité clinique ou des effets indésirables.
On peut s’attendre à ce que les schémas posologiques ci-dessus placent la concentration plasmatique d’Inamrinone de la plupart des patients à environ 3 mcg / mL. Les augmentations de l’indice cardiaque montrent une relation linéaire avec la concentration plasmatique d’une plage de 0.5 mcg/ mL à 7 mcg/mL. Aucune observation n’a été faite à des concentrations plasmatiques plus élevées.
L’amélioration du patient peut se traduire par une augmentation du débit cardiaque, une réduction de la pression du coin capillaire pulmonaire et des réponses cliniques telles qu’une diminution de la dyspnée et une amélioration d’autres symptômes d’insuffisance cardiaque, tels que l’orthopnée et la fatigue.
La surveillance de la pression veineuse centrale (CVP) peut être utile dans l’évaluation de l’hypotension et de la gestion de l’équilibre hydrique. Une correction ou un ajustement préalable du fluide / électrolytes est essentiel pour obtenir une réponse satisfaisante avec l’Inamrinone.
Les médicaments parentéraux doivent être inspectés visuellement et ne doivent pas être utilisés en cas de particules ou de décoloration.
Comment l’Inamrinone est-elle fournie
L’Inamrinone Injectable USP est fournie dans des flacons unidoses de 20 mL de solution stérile jaune clair emballée individuellement. NDC 55390-042-10.
Chaque 1 mL contient du lactate d’inamrinone équivalent à 5 mg d’Inamrinone.
Protéger de la lumière. L’emballage est résistant à la lumière pour une protection pendant le stockage. Conserver dans la boîte jusqu’au moment de l’utilisation.
Conserver à température ambiante contrôlée de 15 à 30 °C (59 à 86 °F).
Manufactured by: Manufactured for:
Ben Venue Laboratories, Inc. Bedford Laboratories™
Bedford, OH 44146 Bedford, OH 44146
August 2002 AMR-P01
VIAL LABEL

Vial Label 100 mg/20 mL
| Inamrinone Inamrinone injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Bedford Laboratories (884528407)
Registrant – Ben Venue Laboratories (004327953)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Ben Venue Laboratories Inc. | 004327953 | MANUFACTURE(55390-042) | |
More about inamrinone
- Side Effects
- During Pregnancy
- Dosage Information
- Drug Interactions
- Drug class: inotropic agents
Related treatment guides
- Heart Failure
Medical Disclaimer