Esistono metodi sperimentali per il rilevamento di elettroni spaiati. Uno dei tratti distintivi degli elettroni spaiati nei materiali è l’interazione con un campo magnetico. Tale interazione può essere utilizzata per fornire informazioni sui composti contenenti elettroni spaiati.
La risonanza paramagnetica elettronica
La risonanza paramagnetica elettronica (EPR) o risonanza di spin elettronico (ESR) è un metodo spettroscopico. Dipende dalla separazione energetica di due stati di spin che esiste solo in presenza di un campo magnetico.
EPR è strettamente correlato ad un altro tipo comune di spettroscopia di risonanza di spin, NMR.
Spin è una proprietà quantistica che non ha alcuna analogia reale che avrebbe senso per noi a livello macroscopico. Tuttavia, sappiamo che lo spin ha associato ad esso proprietà magnetiche. Un elettrone può avere uno dei due valori per queste proprietà magnetiche. Ci sono varie etichette date a questi valori: a volte “su” e “giù”, a volte, +1/2 e -1/2. Tuttavia, qualsiasi valore di spin posseduto da un elettrone non fa alcuna differenza energeticamente.
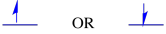
I due possibili stati di spin sono gli stessi energeticamente unless a meno che non sia presente un campo magnetico. Una volta che si verifica questa situazione, c’è una separazione energetica tra i due stati.
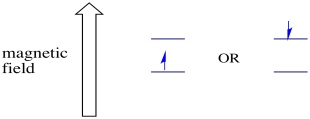
In presenza di un campo magnetico, i due stati di spin si separano in due diversi livelli di energia. La quantità di separazione tra i livelli di energia dipende dalla grandezza del campo magnetico. Più forte è il campo magnetico, maggiore è la separazione.
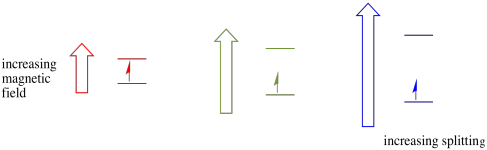
Questo caso è vero solo per gli spin non accoppiati. Ricorda, gli spin spaiati interagiscono con un campo magnetico. Se tutto è spin-accoppiato, non succede nulla. Questo è molto utile, perché ci dà un modo per rilevare quegli elettroni spaiati.
Un elettrone in uno stato di spin può ancora essere eccitato all’altro dall’assorbanza di un fotone. In alternativa, un elettrone nello stato superiore può scendere a quello inferiore se rilascia un fotone.
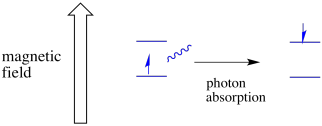
Affinché tutto ciò accada, l’energia del fotone deve corrispondere esattamente alla differenza di energia tra gli stati. Questa regola Goldilocks è chiamata la condizione di risonanza. La quantità di energia fornita per passare da un livello energetico all’altro deve essere giusta. Troppa poca energia e l’elettrone non ce la farà. Troppa energia e l’elettrone non ce la farà neanche. Sta aspettando solo il fotone giusto.
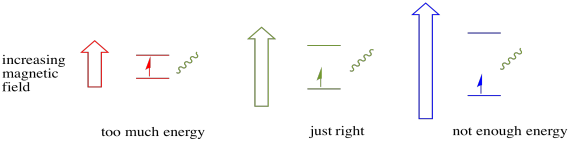
Quanta energia ha un fotone? Ricorda la tua relazione Planck-Einstein. Ha descritto l’energia di un fotone:
\(E=h \nu \)
E è l’energia del fotone, h è la costante di Planck (6,625 x 10-34 Js) e ν è la frequenza del fotone (sembra una vee romana, ma è la lettera greca, nu).
In alternativa, a causa della relazione tra lunghezza d’onda e frequenza:
\(E= \frac{hc}{\lambda}\)
Le nuove quantità sono c, la velocità della luce (3,0 x 108 m s-1) e λ, la lunghezza d’onda del fotone.
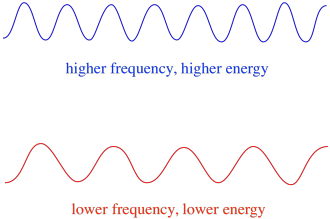
Quindi, in generale, diverse lunghezze d’onda della luce forniscono diverse quantità di energia. La luce blu, con una lunghezza d’onda vicina a 475 nm, ha più energia della luce rossa, con una lunghezza d’onda vicina a 700 nm.
In EPR, la gamma generale di radiazione elettromagnetica, o il tipo generale di fotone, è la radiazione a microonde. La frequenza di questi fotoni è di circa 9 o 10 GHz. (Un altro tipo di spettroscopia, la spettroscopia rotazionale, misura anche l’assorbanza delle microonde. In genere utilizza frequenze leggermente più alte delle microonde. La spettroscopia rotazionale fornisce informazioni strutturali o di legame sulle molecole in fase gassosa.)
A seconda dell’ambiente dell’elettrone spaiato, può essere più suscettibile o meno suscettibile all’influenza del campo magnetico esterno. Ciò significa che la divisione di energia tra i due stati di spin varierà da una molecola all’altra. Di conseguenza, diverse molecole nello stesso campo magnetico assorbirebbero diverse lunghezze d’onda della radiazione a microonde.
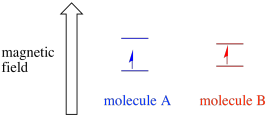
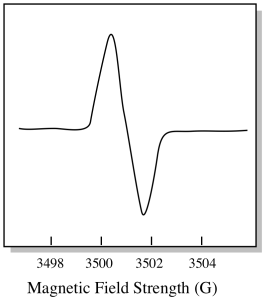
Di solito, uno spettrometro EPR è progettato in modo che fornisca una lunghezza d’onda fissa della radiazione a microonde al campione. Il campo magnetico viene regolato e lo strumento misura l’intensità del campo richiesta per l’assorbimento dei fotoni. Uno spettro EPR mostra l’assorbanza in funzione dell’intensità del campo magnetico.
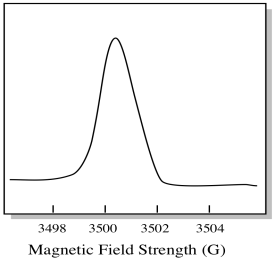
C’è qualcosa di un po ‘ diverso nel modo in cui vengono solitamente visualizzati gli spettri EPR. Viene visualizzato come un derivato della trama mostrata sopra. Questo è dovuto al modo in cui lo strumento misura il cambiamento di assorbanza quando cambia il campo magnetico; cioè misura d(assorbanza)/d(campo magnetico). Questa è la pendenza della trama precedente.
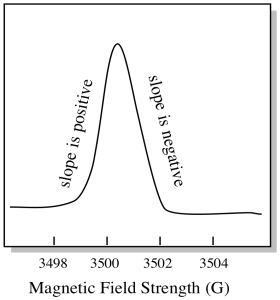
Di conseguenza, uno spettro EPR sembra davvero più simile a questo. La parte sopra la linea di base riflette la pendenza positiva nella trama precedente. La parte sotto la linea di base riflette la pendenza negativa nella trama precedente.
L’intensità del campo magnetico non è in genere il valore riportato per la posizione di picco. Invece, viene riportato qualcosa chiamato g-value. Il valore g deriva dall’equazione per l’effetto Zeeman (l’effetto del campo magnetico sulla divisione tra i livelli di energia di spin). Che rapporto è:
\(\Delta E = g \beta B\)
in cui ∆ E è la differenza di energia tra stati di spin, g è il valore g, una costante di proporzionalità che dipende da quanto suscettibili di elettroni è l’influenza del campo magnetico, b è il Bohr magneton (9.274 x 10-24 J T-1) e B è il campo magnetico applicato.
Ciò significa che, per l’assorbimento del fotone,
\(h \nu = g \beta B\)
e così
\(g = \frac{ h \nu}{\beta B}\)
Ricorda, h e β sono solo costanti. Ciò significa che g è una misura del rapporto tra il fotone assorbito e il campo magnetico utilizzato. È un passo di standardizzazione. Se le persone hanno strumenti che utilizzano lunghezze d’onda leggermente diverse della radiazione a microonde, i campi magnetici che misurano per gli stessi campioni non sarebbero d’accordo. Se tutti misurano solo il rapporto tra lunghezza d’onda e intensità del campo, tutto dovrebbe essere uniforme. Il valore g è una misura riproducibile dell’ambiente di un elettrone che dovrebbe essere lo stesso da un laboratorio all’altro.
Una pratica simile viene utilizzata nella spettroscopia NMR, per ragioni simili. Quando segnaliamo uno spostamento chimico in ppm invece di Hz, stiamo correggendo la forza del campo magnetico nello strumento che stiamo usando. Altrimenti lo stesso campione darebbe due turni diversi su due strumenti diversi.
L’accoppiamento in EPR
L’accoppiamento è un fenomeno in cui i campi magnetici interagiscono tra loro. Nell’EPR, l’accoppiamento avviene a causa dell’influenza dei nuclei vicini sull’elettrone che viene osservato.
Ad esempio, potresti già sapere che il nucleo di un atomo di idrogeno ha uno spin spaiato. Questa è la base della spettroscopia 1H NMR. Se quel nucleo ha uno spin spaiato, ha un campo magnetico associato. Poiché il nucleo di idrogeno potrebbe avere un valore di spin, +1/2 o -1 / 2, allora ha due possibili campi magnetici associati ad esso.
Un elettrone vicino, posto in un campo magnetico esterno, potrebbe ora trovarsi in una delle due situazioni diverse. O il protone vicino aggiunge un po ‘al campo magnetico, o sottrae un po’ dal campo esterno.
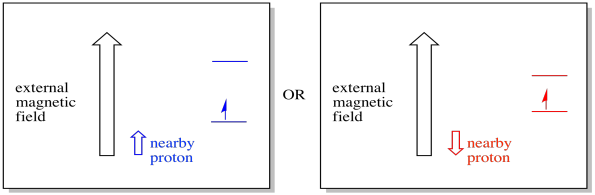
Di conseguenza, l’elettrone può sperimentare due campi diversi. Ricorda, non abbiamo a che fare con una singola molecola in spettroscopia. Abbiamo a che fare con un numero enorme di molecole. Alcune delle molecole saranno in una situazione. Alcune delle molecole saranno nell’altra situazione. Vedremo entrambe le situazioni. Ci sarà assorbanza a due diversi punti di forza del campo magnetico.

Di conseguenza, lo spettro EPR mostra due picchi, come questo:
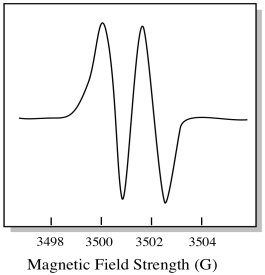
Questo tipo di picco nello spettro è chiamato doppietto, a causa della doppia assorbanza. Questa caratteristica di un picco EPR è chiamata la sua molteplicità. In quante linee è diviso il picco? Due. È un doppietto.
Le cose sono ancora più interessanti se ci sono due protoni vicini. In tal caso, entrambi i protoni vicini hanno spin. O rotazione potrebbe avere valore +1/2 o -1 / 2. Forse sono entrambi + 1/2. Forse sono entrambi -1 / 2. Forse c’è uno di ciascuno. Queste tre possibili combinazioni avranno tre diversi effetti sul campo magnetico sperimentato dall’elettrone.
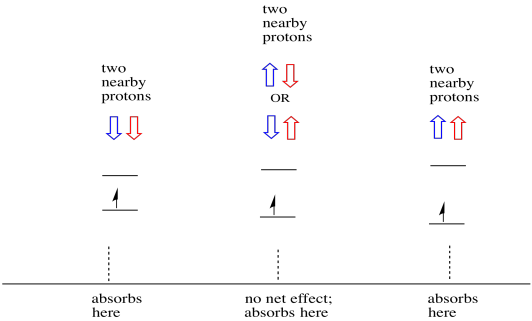
Di conseguenza, ci sono tre picchi nello spettro. Lo spettro è chiamato tripletta. Questa tripletta è mostrata sotto, sotto il diagramma che illustra le combinazioni di spin degli idrogeni vicini.
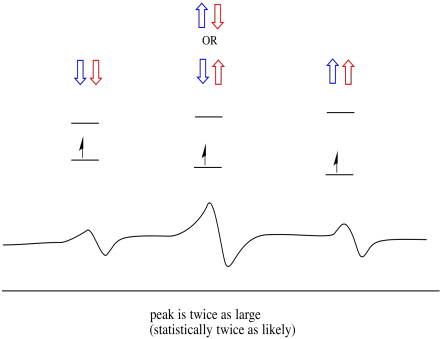
Si noti che, poiché l’idrogeno potrebbe essere in alto o in basso nella combinazione mista, ci sono due modi per arrivare a quello stato intermedio. Quella combinazione è due volte più probabile delle altre due, perché c’è solo un modo per ottenere quelle combinazioni: entrambi gli spin di hydrogens sono in aumento, in un caso. Entrambi gli idrogeni sono giù nell’altro. Di conseguenza, il picco medio in una tripletta è due volte più grande dei picchi sui bordi.
Exercise \(\PageIndex{1}\)
Show that, with three neighbouring hydrogens, a quartet would result, in which the ratio of the peaks are 1:3:3:1.
Risposta
Le combinazioni sono:
a) tutti i giri in giù (e c’è un solo modo per farlo)
b) due giri sono giù, ma uno è alto (e ciascuna delle tre protoni potrebbe essere, ci sono tre modi per farlo)
c) due giri, ma è verso il basso (e ciascuna delle tre protoni potrebbe essere giù, quindi ci sono tre modi per farlo)
d) tutti i giri (e c’è solo un modo di fare che).
Il risultato è un quartetto 1:3:3:1.
Esercizio di \(\PageIndex{2}\)
Prevedere la molteplicità in EPR spettro per ciascuno dei seguenti alcossi radicali (nota che l’ossigeno e il carbonio non hanno spaiati giri; assume la stessa cosa è vera per X):
a) X3C-O. b) X2CH-O. c) XCH2-O. d) CH3-O.
Risposta)
a) singoletto
Risposta b)
b) doppietto
Risposta c)
c) la tripletta
Risposta d)
d) quartetto
Esercizio di \(\PageIndex{3}\)
Supponiamo di benzene sono stati ridotti di un elettrone per ottenere il benzene radicale anione. Quale sarebbe la molteplicità nello spettro EPR?
Risposta
Un settetto (in un 1:3:5:7:5:3:1 rapporto).
Accoppiamento agli ioni metallici
Molti nuclei diversi dall’idrogeno hanno uno spin netto. Se l’elettrone spaiato si trova su un metallo, lo spettro EPR può fornire conferma di tali informazioni strutturali. Questa conferma può provenire sia dall’informazione del campo magnetico (simile allo spostamento chimico in NMR) che dalla molteplicità.
Gli spin nucleari di metalli selezionati sono mostrati di seguito.
| Metallo | Spin |
| V | 7/2 |
| Mn | 5/2 |
| Fe | 0 |
| Co | 7/2 |
| Cu | 3/2 |
In ciascuno di questi metalli, il nucleo ha diverse possibili campi magnetici. Si noti che i loro effetti sono leggermente più complicati di quelli di un atomo di idrogeno. Ad esempio, il rame, con spin 3/2, agisce un po ‘ come tre diversi nuclei di idrogeno (ciascuno con spin +/- 1/2) in termini di effetto sullo spettro EPR di un elettrom vicino. La molteplicità di un elettrone spaiato su uno ion di rame dovrebbe essere piuttosto distintiva.
Esercizio di \(\PageIndex{4}\)
Prevedere la molteplicità di un picco nello spettro EPR per un elettrone spaiato su ciascuno dei seguenti metalli:
a) vanadio b), manganese c) ferro d) cobalto e rame
Risposta)
a) un ottetto (in un 1:3:5:7:7:5:3:1 ratio)
Risposta b)
b) un sestetto (1:3:5:5:3:1 ratio)
Risposta c)
c) un singoletto
Risposta d)
d) un ottetto
Risposta e)
e) un quartetto (in un rapporto 1:3:3:1)
A volte le cose sono più complicate, perché diversi isotopi dello stesso elemento possono avere diversi valori di spin possibili. In realtà, questo è vero con idrogeno e carbonio, ma la grande maggioranza dell’idrogeno si trova come 1H, quindi in generale possiamo pensare che abbia spin = 1/2; la grande maggioranza del carbonio è 12C, con spin = 0.
Gli isotopi naturali del ferro e i loro spin nucleari sono mostrati nella tabella seguente.
| Isotope | Spin | % Abundance |
| 54Fe | 0 | 5.9 |
| 56Fe | 0 | 91.8 |
| 57Fe | 1/2 | 2.1 |
| 58Fe | 0 | 0.2 |
The EPR spectrum of an unpaired electron on iron may be slightly more complicated than we first thought. All’interno del campione, alcuni degli elettroni sarebbero situati su ioni di ferro con spin = 1/2, anche se la maggior parte non lo farebbe. Questa complicazione può essere sufficiente per introdurre una leggera variazione nell’aspetto dello spettro, ma nel complesso sarebbe ancora simile a un singoletto.
Tuttavia, in molti casi le cose diventano molto più complesse. Molibdeno fornisce un buon esempio.
| Isotopo | Spin | % Abbondanza |
| 92Mo | 0 | 14.8 |
| 94Mo | 0 | 9.3 |
| 95Mo | 5/2 | 15.9 |
| 96Mo | 0 | 16.7 |
| 97Mo | 5/2 | 9.6 |
| 98Mo | 0 | 24.1 |
| 100Mo | 0 |
Ci sono sette naturale isotopi di molibdeno. Cinque di loro hanno spin = 0, quindi un elettrone spaiato su quegli isotopi darebbe origine a un semplice singoletto nello spettro EPR. Gli altri due isotopi, comprendenti il 25% del totale, hanno spin = 5/2. La maggior parte degli elettroni spaiati sul molibdeno si presenterebbe come un singoletto. Tuttavia, una frazione significativa si presenterebbe come un sestetto. Ciò significa che, in un caso ideale, un elettrone spaiato su molibdeno darebbe origine a un singoletto con un sestetto sovrapposto su di esso (circa un quarto forte come il singoletto).
Questa situazione potrebbe essere simile al disegno qui sotto.
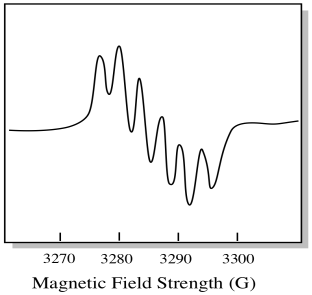
In realtà, gli spettri EPR sono enormemente complicati in molti casi. Spesso sembrano macchie sfocate. Ci sono così tante cose che si accoppiano a così tante altre cose che diventa quasi impossibile decifrare a occhio. Nella maggior parte dei casi, vengono eseguite simulazioni al computer e i dati sperimentali vengono confrontati con le simulazioni al computer per ottenere informazioni strutturali.
Exercise \(\PageIndex{5}\)
Il vanadio è presente in alcune nitrogenasi e quindi c’è stato interesse per i complessi modello (ad esempio Sandro Gambarotta et al, J. Am. Chimica. Soc. 1994, 116, 6927-6928). Gambarotta ha utilizzato la seguente sintesi, in solvente THF:
\(\ce{VCl3 + K- > 3V (THF)}\)
- Disegna la struttura del prodotto della reazione.
- Disegna un diagramma di divisione orbitale d per questo complesso.
- Uno spettro EPR è stato registrato per questo composto. Abbozzare lo spettro, dato che il vanadio ha spin nucleare I = 7/2.
- Stima µeff per questo composto.
Il composto reagisce con N2, formando un dimero a ponte N2.
e) Disegna la struttura di questo prodotto.
f) Questo composto non produce spettro EPR. Fornire una struttura di risonanza di (e) che spiega questa osservazione.
Risposta
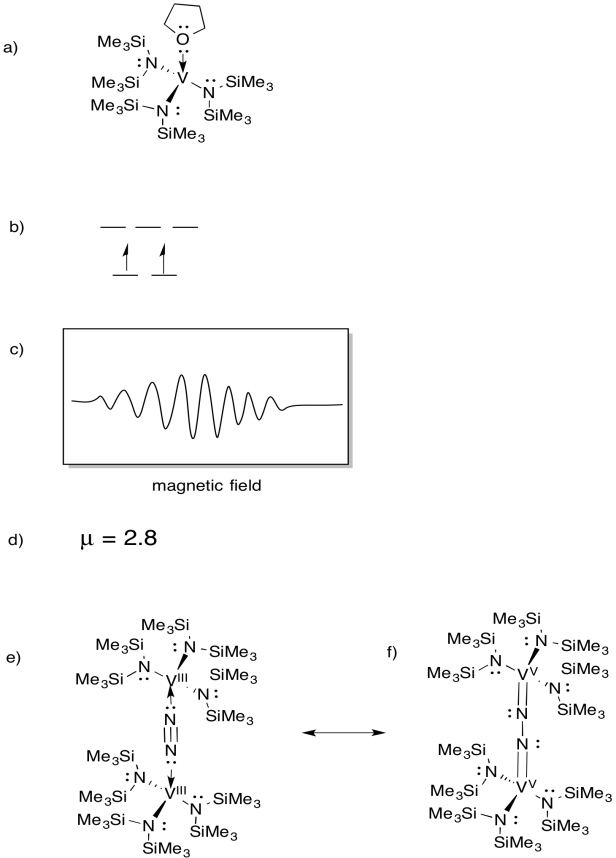
EPR spectra fornito per gentile concessione di Virtual Imagination / Slapdash Chemistry Creations.
Attribuzione
Chris P Schaller, Ph. D., (Collegio di San Benedetto / Università di San Giovanni)