- Introduzione
- Materiali e metodi
- Analisi strumentale
- Colture microbiche
- Preparazione Media
- Fermentazione di Drostanolone Enanthate (1) con C. aphidicola ATCC 28300, e F. lini NRRL 2204
- 2α-Metil-3α,14α,17β-triidrossi-5α-androstano (2)
- 2α-Metil-7alfa-idrossi-5α-androstan-3,17-dione (3)
- 2α-Metil-3α,17β-diidrossi-5α-androstan (4)
- 2-Methylandrosta-1,4-diene-3,17-dione (5)
- 2-Methylandrosta-11α-idrossi-1,4-diene-3,17-dione (6)
- 2-Methylandrosta-14α-idrossi-1,4-diene-3,17-dione (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- Risultati e Discussione
- Delucidazione
- Citotossicità contro il cancro HeLa, PC3, H640 e HCT116 e 3T3 Linee cellulari normali
- Rapporto struttura-Attività
- Conclusione
- Contributi dell’autore
- Dichiarazione sul conflitto di interessi
- Riconoscimenti
- Materiale supplementare
Introduzione
La trasformazione microbica è uno degli approcci più importanti per la trasformazione strutturale di varie classi di composti organici. Questa tecnica è stata impiegata con successo nella chimica verde, vale a dire. la scoperta della droga e programmi di sviluppo, fornendo un’ottima fonte di composti intorno strutture di base, seguita da screening per varie attività biologiche. In diversi casi, la trasformazione microbica è stata utilizzata come strumento importante per le conversioni regio -, chemio-e stereo-selettive di composti organici che sono difficili da ottenere con metodi convenzionali (Holland e Weber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmanska et al., 2005; Borges et al., 2009; Choudhary et al., 2011; Ravindran et al., 2012). A causa della natura inattiva dello scheletro idrocarburico degli steroidi, sono spesso difficili da derivatizzare con metodi sintetici convenzionali. Pertanto, la trasformazione microbica viene spesso utilizzata per l’alterazione strutturale degli steroidi. La presenza di sistemi enzimatici del citocromo P450 nei funghi, rende la biocatalisi a cellule intere uno strumento efficace per l’idrossilazione stereo e regio-specifica (Choudhary et al., 2005a; Tong e Dong, 2009; Kristan e RiŽner, 2012; Baydoun et al., 2014).
Drostanolone ed i suoi derivati degli esteri, quale il proponiato di drostanolone, il pentanoate di drostanolone ed il enanthate di drostanolone (1) sono steroidi anabolici-androgeni (AASs) usati dagli atleti per rinforzare i loro muscoli senza guadagnare il grasso. Inoltre, drostanolone e suoi derivati esteri hanno la capacità di inibire la produzione di estrogeni. L’estere del proponiato di drostanolone inoltre è usato per il trattamento di cancro al seno, nell’ambito della marca commerciale di Masteron (Chowdhury et al., 1976; Clavel et al., 1982; Marinov et al., 1986; Vardar et al., 2002; Bahrke e Yesalis, 2004).
Il cancro è attualmente riconosciuto come una grande sfida per la salute pubblica. I tumori sono la seconda causa di morte negli Stati Uniti e in tutto il mondo. Secondo l’Organizzazione mondiale della Sanità (OMS), la prevalenza del cancro supera i 6 milioni di casi all’anno. Le cellule tumorali hanno un alto tasso di proliferazione. Si diffondono rapidamente nel sistema vivente e possono sopravvivere contro forti chemioterapici e agenti dannosi per il DNA. Allo stesso modo, i farmaci citotossici hanno molti effetti negativi sulle cellule normali, e quindi il loro uso nella chemioterapia del cancro è una sfida terapeutica. A causa di ciò, lo sviluppo di agenti chemioterapici sicuri, efficaci e selettivi è urgentemente necessario contro vari tumori (Munoz-Pinedo et al., 2012; Su et al., 2015; Swadogo et al., 2015; Rebecca et al., 2016).
Il cancro al seno è uno dei tumori più comuni in 140 paesi del mondo. È una delle principali cause di morte correlata al cancro nelle femmine di tutto il mondo, caratterizzata dalla crescita anormale delle cellule nei lobuli o nei dotti del seno con l’alto tasso di proliferazione (Hanahan e Weinberg, 2000; Ferlay et al., 2015).
Il cancro cervicale è il secondo tumore più predominante nelle donne in tutto il mondo, dopo il cancro al seno. La causa principale del cancro cervicale è la formazione di cellule maligne nei tessuti della cervice (Wang et al., 2013; Hafiza e Latifah, 2014; Pariente et al., 2016). La linea cellulare del cancro di HeLa, ottenuta dalle cellule cervicali umane di cancro, è un modello cellulare comune per valutare il potenziale citotossico dei composti della prova.
Il cancro alla prostata è il secondo tumore principale nel maschio in tutto il mondo dopo il cancro del bronco e la terza causa più comune di morte per cancro. È la ragione più comune di malignità negli uomini. La sua incidenza aumenta con l’età, più comune oltre i 50 anni (Henry e Omahony, 1999; De – Bono et al., 2010; Wenbin et al., 2015). La linea di cellule tumorali PC-3, ottenuta da cellule tumorali della prostata maschile, è un modello ampiamente utilizzato per studiare la tossicità dei composti di prova.
Il cancro del polmone è un tumore molto diffuso tra gli uomini negli Stati Uniti dalla metà degli anni 1950 e tra le donne, dalla fine degli anni 1980. È una delle principali cause di morte correlata al cancro. Il cancro ai polmoni è per lo più attribuito al fumo (Travis et al., 2002; Villanti et al., 2013; Mishra et al., 2016). La linea cellulare del cancro H460, ottenuta dalle cellule di cancro del polmone umano (subline metastatica lymphogenous del carcinoma polmonare a grandi cellule umano), è usata spesso per valutare la citotossicità dei composti della prova.
Dopo i tumori al seno, ai polmoni e alla prostata, il cancro del colon è il quarto tumore più diffuso in tutto il mondo. È il cancro trovato in frequenza approssimativamente uguale in maschi e femmine. È la seconda causa più comune di decessi correlati al cancro nei paesi occidentali (Levin et al., 2008; Andre et al., 2009; Ahearn et al., 2012). La linea di cellule tumorali HCT116, ottenuta da cellule tumorali del colon umano, è comunemente usata per valutare la citotossicità dei composti di prova.
In continuazione dei nostri studi sulla trasformazione fungina degli steroidi bioattivi (Choudhary et al., 2005b, c, 2007, 2010; Ahmad et al., 2014; Siddiqui et al., 2017), abbiamo sintetizzato analoghi di drostanolone enanthate (1) attraverso la sua trasformazione con Cefalosporium aphidicola e Fusarium lini. Metaboliti 2-9, così come substrato 1, sono stati valutati contro HeLa (carcinoma cervicale), PC-3 (carcinoma prostatico), H460 (tumore del polmone), HCT116 (cancro del colon), e 3T3 (mouse fibroblasti normali) di linee di cellule, utilizzando high-throughput cell-based test, la più efficiente e conveniente metodo di laboratorio, l’analisi di MTT per predire la risposta del test composti in neoplasie in cui hanno mostrato specificità contro le cellule tumorali. Questo studio ha così identificato i metaboliti anticancro di drostanolone enanthate (1) per ulteriori studi.
Materiali e metodi
Analisi strumentale
La cromatografia a strato sottile (TLC) (gel di silice, 20 × 20, spessore 0,25 mm, PF254, Merck, Germania) è stata utilizzata per l’analisi del grado di trasformazione e purezza. La cromatografia a colonna di gel di silice (70-230 mesh, E. Merck, Germania) è stata utilizzata per la purificazione iniziale dei metaboliti. Inoltre, il riciclaggio di fase inversa preparativa (JAI LC-908W, Giappone), dotato di YMC L-80 (4-5 µm, 20-50 mm i.d.), è stato utilizzato per la purificazione finale dei metaboliti. Le strutture dei metaboliti sono state chiarite con l’aiuto di spettri 1H- (400, 500 e 600 MHz) e 13C-NMR (100, 125 e 150 MHz), che sono stati registrati sugli spettrometri Bruker Avance-NMR (Francia) in CD3OD, CD3COCD3 o DMSO-d6. HREI-MS e IR spettri sono stati eseguiti su JEOL JMS-600H (Giappone) (double-focusing magnetic sector mass analyzer) spettrometro di massa (EI, electron impact ionization), e Bruker Vector 22 FT-IR spettrofotometro, rispettivamente. Le rotazioni ottiche dei metaboliti sono state registrate sul polarimetro JASCO P-2000 (Giappone). Lo spettrofotometro UV-visibile Evolution 300 è stato utilizzato per registrare gli spettri UV. I punti di fusione dei prodotti trasformati sono stati misurati utilizzando lo strumento Buchi M-560 (Svizzera). I dati di diffrazione dei raggi X a cristallo singolo sono stati raccolti sul diffrattometro Bruker APEXII D8 Venture, dotato di rivelatore FOTONICO 100 (tecnologia CMOS) e tubo sigillato a fuoco fine con sorgente di raggi X (radiazioni Cu Ka α = 1,54178 Å). Le intensità di riflessione sono state integrate utilizzando il software SAINT. La correzione dell’assorbimento è stata eseguita su Multi-scan e la struttura è stata risolta dal programma SHELXTL (Gerlier e Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
Colture microbiche
Colture microbiche di C. aphidicola ATCC 28300 e F. lini NRRL 2204 sono state ottenute rispettivamente dall’American Type Culture Collection (ATCC) e dai Northern Regional Research Laboratories (NRRL). Le culture sono state coltivate su Sabouraud dextrose agar (SDA) slant, e mantenuto a 4°C.
Preparazione Media
Quattro litri di supporto per la crescita di C. aphidicola ATCC-28300 è stata preparata mescolando 200 g di glucosio, 4 g di KH2PO4, 8 g di glicina, 4 g di KCl, 8 g di MgSO4.7H2O, e 8 mL di elementi in traccia in 4 L di acqua distillata. Allo stesso modo, quattro litri di mezzi sono stati preparati per F. lini NRRL 2204 mescolando 40 g di glucosio, 20 g di estratto di lievito, 20 g di peptone, 20 g di KH2PO4, 20 g di NaCl e 40 mL di glicerolo in 4 L di acqua distillata.
Fermentazione di Drostanolone Enanthate (1) con C. aphidicola ATCC 28300, e F. lini NRRL 2204
Mezzo per la crescita di C. aphidicola e F. lini è stata preparata mescolando ingredienti di cui sopra in 4 L di acqua distillata per ogni fungo, che è stato poi erogato ugualmente in 40 matracci di Erlenmeyer da 250 mL (100 mL in ciascun flacone). Tutti questi flaconi sono stati autoclavati a 121°C e sono stati inoculati con SDA slants di C. aphidicola ATCC 28300 e F. lini NRRL 2204 in condizioni sterilizzate. Queste colture fungine contenenti fiaschi sono state lasciate sullo shaker rotante (121 giri / min) a 26 ± 2°C per 3-4 giorni per ottenere la massima crescita di C. aphidicola e F. lini. Composto 1 (1 g) è stato sciolto in 20 mL di acetone per ogni fungo, ed è stato erogato 0,5 mL in ogni pallone, e di nuovo posto su agitatore rotante per 12 giorni. Un controllo negativo (mezzo + coltura fungina), così come un controllo positivo (mezzo + substrato) sono stati anche preparati in modo analogo per valutare i metaboliti fungini e la degradazione del composto 1, rispettivamente. Dopo l’incubazione di 12 giorni, tutti i flaconi sono stati filtrati ed estratti con 20 L di diclorometano (DCM), la fase organica è stata separata e quindi evaporata sotto pressione ridotta sull’evaporatore rotante. Ciò ha prodotto 1,5 g di greggio solido giallastro pallido. Questo materiale grezzo è stato frazionato sopra la cromatografia della colonna del gel di silice tramite eluizione con gli esani di pendenza ed i sistemi solventi dell’acetone. La cromatografia su colonna ha prodotto quattro frazioni principali (1-4), che sono state poi purificate riciclando HPLC. Metaboliti 2 (tR = 16 min, 8 mg, 0.8%), 3 (tR = 19 min, 11 mg, l ‘ 1,1%), 4 (tR = 17 min, 35 mg, il 3,5%), 5 (tR = 23 min, 42 mg, il 4,2%), 6 (tR = 20 min, 9 mg, 0.9%), 7 (tR = 21 min, 12 mg, 1,2%) 9 (tR = 18 min, 5 mg, 0.5%) sono stati purificati da frazioni 1-7, rispettivamente, attraverso invertire la fase di riciclaggio HPLC utilizzando metanolo – acqua come solvente di sistema (MeOH: H2O; 70: 30). Considerando che, il metabolita 8 è stato ottenuto dalla frazione 8 attraverso la normale fase di riciclaggio HPLC (tR = 32 min, CHCl3: MeOH; 95: 5, 7.5 mg, 0,75%).
2α-Metil-3α,14α,17β-triidrossi-5α-androstano (2)
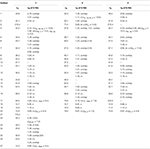
Tabella 1. Dati di spostamento chimico 13C-e 1H-NMR (J e W1 / 2 in Hz) di composti 1-3 (δ ppm).
2α-Metil-7alfa-idrossi-5α-androstan-3,17-dione (3)
2α-Metil-3α,17β-diidrossi-5α-androstan (4)
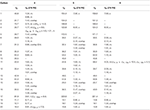
la Tabella 2. Dati di spostamento chimico 13C-e 1H-NMR (J e W1 / 2 in Hz) di composti 4-6 (δ ppm).
2-Methylandrosta-1,4-diene-3,17-dione (5)
2-Methylandrosta-11α-idrossi-1,4-diene-3,17-dione (6)
2-Methylandrosta-14α-idrossi-1,4-diene-3,17-dione (7)
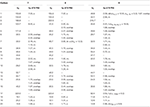
Tabella 3. Dati di spostamento chimico 13C-e 1H-NMR (J e W1 / 2 in Hz) di composti 7-9 (δ ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Le linee cellulari sono state coltivate in mezzi DMEM F12, integrati con 10% FBS sotto un’atmosfera di CO2 del 5% a 37°C in un incubatore.
Il test colorimetrico MTT è stato utilizzato per la valutazione dell’attività metabolica cellulare. In questo test, l’MTT giallo è ridotto a formazon viola nei mitocondri delle cellule viventi (Gerlier e Thomasset, 1986). Più le cellule viventi, più il colore e quindi più assorbanza viene osservato dal colorimetro (Fesahat et al., 2015). Abbiamo utilizzato questo metodo per analizzare l’effetto dei nostri prodotti trasformati sulla citotossicità cellulare contro le cellule tumorali. Circa 10.000 cellule di ciascuna linea cellulare (tumori HeLa, PC3, H460, HCT116 e 3T3 normali) sono state seminate in piastre a 96 pozzetti. Dopo aver raggiunto la confluenza 80-90%, sono stati trattati con varie concentrazioni di composti (25, 50, 75, 100 e 200 µM) per 24 h. Tutti i composti sono stati sciolti in DMSO sterile per ottenere una soluzione madre da 200 mm. La soluzione è stata filtrata e le diluizioni seriali sono state effettuate nel mezzo di crescita. 600 µL di ciascuna diluizione sono stati usati per trattare 3 pozzetti (triplicati di ciascuno) di 96 piastre di pozzetti, cioè 200 µL ciascuno. Ogni esperimento è stato eseguito in tre repliche biologiche. MTT è stato aggiunto e incubato per 4 h. Dopo la rimozione di MTT, i cristalli di formazon viola sono stati sciolti in DMSO e la lettura è stata osservata a 540 e 570 nm per le cellule normali e tumorali, rispettivamente. Il lettore Multiskan dà λmax a 540 nm nelle cellule di fibroblasti 3T3 trattate con DMSO (che sono più confluenti nella morfologia) mentre in caso di cellule tumorali, 570 nm dà λmax (Bonmati-Carrion et al., 2013; Danihelová et al., 2013). In questo esperimento è stata utilizzata una vasta gamma di linee cellulari di carcinoma epiteliale in cui il cisplatino era un farmaco comune di scelta. Si rivolge al DNA, interferisce con la divisione cellulare durante la mitosi e induce l’apoptosi (Eastman, 1999). I valori IC50 sono stati calcolati per determinare la concentrazione minima richiesta per uccidere il 50% delle cellule.
Considerando che,
A = valore di Assorbanza del composto in esame
Ab = valore di Assorbanza del vuoto
Ac = valore di Assorbanza di controllo
Risultati e Discussione
Delucidazione
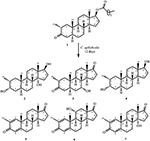
Figura 1. Biotrasformazione di drostanolone enanthate (1) con Cefalosporium aphidicola.
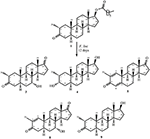
Figura 2. Biotrasformazione di drostanolone enanthate (1) con Fusarium lini.
Il metabolita 2 è stato isolato come cristalli bianchi. La formula molecolare C20H30O3 era basata su HREI-MS che mostrava l’at m / z 322.2517 (calcd. 322.2508, C20H34O3), suggerendo l’aggiunta di tre idrogeno e un atomo di ossigeno, riduzione del carbonile chetonico C-3 e scissione idrolitica della catena laterale eptanoato nel substrato 1. L’assorbanza IR a 3.531 e 3.423 cm-1 era dovuta alla presenza di gruppi idrossilici. Lo spettro 1H-NMR ha mostrato un ulteriore segnale di metin protone a δ 3.69 (Tabella 1) (Scheda tecnica 2). I segnali per la catena laterale dell’eptanoato inoltre sono stati trovati mancanti nello spettro 1H-NMR del composto 2. Lo spettro 13C-NMR ha mostrato segnali per un nuovo carbonio metinico a δ 71.4 e un nuovo carbonio quaternario a δ 84.8. Segnali di carbonio per catena eptanoato e carbonile chetonico sono stati trovati anche mancanti nello spettro 13C-NMR. Ciò ha suggerito la riduzione del carbonile C-3, la perdita idrolitica della catena eptanoato e l’aggiunta di un OH a C-14 (Tabella 1). Il gruppo OH è stato posizionato a C-3 sulla base delle correlazioni HMBC di H3-20 (δ 0.91, d) con C-3 (δ 71.4) (Figura 3). Ciò è risultato dalla riduzione di C-3 carbonile. Secondo gruppo OH è stato posto a C-14, sulla base della correlazione HMBC di H3-18 (δ 0.81, s) con C-14 (δ 84.8). Il terzo OH era a C-17, il risultato di perdita idrolitica di frazione eptanoato. Il gruppo O-H a C-3 è stato dedotto per essere orientato α in base alle correlazioni NOESY di H-3 (δ 3.69, br. s) con β-orientato H-2 (δ 1,64, sovrapposizione) e α-orientato H3-20 (δ 0,91, d) (Figura 4). L’OH-14 è stato dedotto per essere α-orientato, basato sulle correlazioni di NOESY di H-9 (δ 1.32, m) con OH-14 (δ 2.66, s) (acetone-d6). L’analisi di diffrazione a raggi X a cristallo singolo ha ulteriormente supportato la struttura del metabolita 2, composto da tre anelli nella conformazione della sedia (A, B e C) e uno nella conformazione dell’involucro (D). Sono stati assegnati tre gruppi OH a C-3, C-14 e C-17, α -, α-e β-orientamento (Figura 5). I dati di diffrazione a cristallo singolo del metabolita 2 sono stati presentati alla Cambridge Crystallographic Data Collection (CCDC 1500706). La struttura del metabolita 2 è stata quindi dedotta come 2α-metil-3α,14α,17β-triidrossi-5α-androstano.
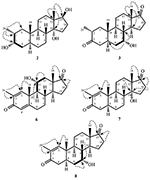
Figura 3. Correlazioni chiave HMBC (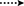 ) e COSY (
) e COSY ( ) nei nuovi metaboliti.
) nei nuovi metaboliti.
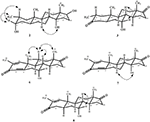
Figura 4. Correlazioni chiave di NOESY in nuovi metaboliti.
Il metabolita 3 è stato ottenuto come solido bianco. Il HREI-MS visualizzato il a m / z 318.2192 (calcd. 318.2195, C20H30O3). Questo ha rappresentato la perdita di catena laterale eptanoato, e l’aggiunta di un atomo di ossigeno nel substrato 1. Lo spettro IR ha mostrato assorbenze per OH (3.436 cm−1) e carbonili chetonici (1.711 cm−1). Nello spettro 1H-NMR, i segnali della catena eptanoato e del protone metinico C-17 sono stati trovati mancanti, mentre un nuovo segnale metino protone di downfield è stato osservato a δ 3.92 (Tabella 1) (Scheda tecnica 3). Ciò ha suggerito l’idrossilazione dello scheletro steroideo e la scissione ossidativa della frazione di eptanoato. Lo spettro 13C-NMR supportava anche le inferenze di cui sopra. I segnali di carbonio per la frazione di eptanoato sono stati trovati mancanti, mentre un nuovo carbonile chetonico e un segnale ossimetrico sono comparsi nello spettro 13C-NMR (Tabella 1). Ciò ha indicato la scissione ossidativa della catena dell’eptanoato e l’idrossilazione nel substrato 1. Il protone metinico appena apparso a δ 3.92 (H-7) ha mostrato correlazioni HMBC con C-5 e C-8, suggerendo un OH a C-7 (Figura 3). Le correlazioni HMBC di H3-18 e H2-16 con un carbonio a δ 223.8 suggerivano un carbonio chetonico a C-17. OH a C-7 è stato ulteriormente supportato da correlazioni ACCOGLIENTI di H-7 con H2-6 e H-8. H-7 (δ 3.92, s) ha mostrato correlazioni NOESY con H-8 orientato assialmente (δ 1.70, sovrapposizione), che ha suggerito un α-orientamento di OH a C-7 (Figura 4). Pertanto, la struttura del metabolita 3 è stata dedotta come 2α-metil-7α-idrossi-5α-androstan-3,17-dione.
Sono state effettuate anche analisi di diffrazione a raggi X monocristallini sui composti 1 e 5. Composto 1 era composto da quattro anelli cioè, A, B, C e D con sedia, sedia, sedia e conformazioni busta. Un metile era presente a C-2 con orientamento equatoriale. La catena dell’estere dell’eptanoato era presente a C-17 dell’anello D (figura 6). Considerando che il metabolita 5 contiene anelli A, B, C e D in conformazioni pialla, sedia, sedia e avvolgimento. La catena laterale dell’eptanoato era assente nel metabolita 5 (Figura 7). I dati di diffrazione a cristallo singolo dei metaboliti 1 e 5 sono stati presentati alla Cambridge Crystallographic Data Collection (CCDC 1500705 e CCDC 1500707, rispettivamente). I dati di analisi della diffrazione dei raggi X a cristallo singolo dei composti 1, 2 e 5 sono presentati nella tabella 4.
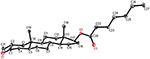
Figura 6. Disegno ORTEP generato al computer del modello a raggi X finale del composto 1. Codici colore: carbonio, nero; ossigeno, rosso.
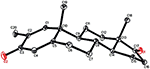
Figura 7. Disegno ORTEP generato al computer del modello a raggi X finale del composto 5. Codici colore: carbonio, nero; ossigeno, rosso.

Tabella 4. Analisi di diffrazione a raggi X monocristallini dei composti 1, 2 e 5.
Citotossicità contro il cancro HeLa, PC3, H640 e HCT116 e 3T3 Linee cellulari normali
Prodotti naturali, ad esempio flavonoidi, steroidi, terpeni, ecc. può servire come fonte eccellente per la produzione di molti farmaci, in quanto sono segnalati per molte attività biologiche come attività anti-cancro, antinfiammatorie, anti-leishmaniali, antibatteriche, ecc. Pertanto, è necessario derivatizzarli, studiare il rapporto struttura-attività che potrebbe essere utile per la sintesi di farmaci sicuri ed efficaci. Attualmente, molti prodotti farmaceutici sono sintetizzati efficientemente via la biotrasformazione microbica dovuto la presenza di una gamma di enzimi in loro. Sulla base dell’attività antitumorale riportata di drostanolone (9), drostanolone propionato e drostanolone eptanoato (1), i composti 1-9 sono stati valutati per citotossicità contro le linee cellulari tumorali HeLa, PC-3, H460 e HCT116. È interessante notare che tutti i composti hanno mostrato un’attività anti-cancro da moderata a potente. L’attività antitumorale dei composti 1-9 è stata dedotta dai valori IC50 contro HeLa (carcinoma cervicale umano), PC-3 (carcinoma prostatico umano), H460 (carcinoma polmonare umano) e HCT116 (carcinoma del colon umano) (Tabella 5). Sulla base di questi risultati, la citotossicità di questi composti è stata valutata anche contro la linea cellulare normale 3T3 (fibroblasto murino), dove tutti i composti, tranne 8 (IC50 = 74,6 ± 3,7 µM) e 9 (IC50 = 62,1 ± 1,2 µM), sono risultati non citotossici.

Tabella 5. Citotossicità dei composti 1-9 contro il cancro HeLa, PC3, H460 e HCT116 e le linee cellulari normali 3T3.
Rapporto struttura-Attività
Le variazioni nelle strutture dei metaboliti hanno effettuato la loro attività antitumorale. Il metabolita 2 con l’assenza di frazione estere e due gruppi aO-H a C-3 e C-14 e un gruppo ßO-H a C-17 hanno mostrato una citotossicità inferiore contro le linee cellulari tumorali HeLa, H460 e HCT116, ma la sua attività anti-cancro era più alta contro la linea cellulare del cancro PC-3, rispetto al composto 1. Il metabolita 3 con la perdita del gruppo estere e due gruppi cheto a C-3 e C-17 e gruppo aO-H a C-7 ha anche mostrato un’attività inferiore contro le linee cellulari di cancro HeLa, H460 e HCT116, ma ha aumentato l’attività contro la linea cellulare di cancro PC-3 rispetto al substrato 1. La riduzione del carbonile C-3 a O-H e la scissione idrolitica della porzione di estere nel composto 4 ha aumentato la sua attività contro le linee cellulari di cancro HeLa e PC-3 in una certa misura, ma la sua attività anti-cancro contro le linee cellulari di cancro H460 e HCT116 è diminuita rispetto al substrato 1. La presenza di C = C tra C-1 / C-2 e C-4/C-5, insieme a C = O a C-3 e C-17 ha reso il metabolita 5 un potente agente anti-cancro contro la linea cellulare del cancro HeLa, rispetto al substrato 1 e al farmaco standard (cisplatino). Inoltre, la sua attività anti-cancro contro la linea cellulare del cancro PC-3 è stata anche aumentata rispetto al substrato 1. È interessante notare che la sua attività anti-cancro contro H460 e le linee cellulari del cancro HCT116 era inferiore rispetto al composto 1. La presenza di C = C tra C-1/C-2 e C-4 / C-5, C = O a C-3 e C-17, insieme al gruppo aO-H a C-11 nel metabolita 6 ha aumentato la sua attività anti-cancro contro HELA e le linee cellulari del cancro PC-3 rispetto al substrato 1 e ha mostrato un potenziale anti-cancro simile contro la linea cellulare del cancro HeLa come farmaco standard (cisplatino). Tuttavia, la sua attività anticancro contro H460 e le linee cellulari del cancro HCT116 sono diminuite rispetto al composto 1. La presenza di C = C tra C-1/C-2 e C-4 / C-5, C = O a C-3 e C-17, insieme al gruppo aO-H a C-14 nel metabolita 7 ha nuovamente aumentato la sua attività anti-cancro contro le linee cellulari HeLa e PC-3 e ha diminuito la sua attività anti-cancro contro le linee cellulari H460 e HCT116 rispetto al substrato 1. La presenza di C = C a C-1 / C-2, C = O a C-3 e C-17 e aOH a C-7 ha reso il metabolita 8 il più potente anti-cancro contro la linea cellulare del cancro HeLa rispetto al substrato 1 e al farmaco standard (cisplatino). Ha anche mostrato una buona attività contro la linea cellulare del cancro PC-3, ma ha diminuito l’attività anti-cancro contro le linee cellulari del cancro H460 e HCT116 rispetto al substrato 1. Il metabolita 9 con solo idrolisi a C-17 ha mostrato un aumento dell’attività anticancro contro le linee cellulari tumorali HeLa, PC-3 e HCT116, ma una diminuzione della citotossicità contro la linea cellulare del cancro H460 rispetto al substrato 1 e al farmaco standard (cisplatino). Sulla base della discussione di cui sopra, si può concludere che l’aumento dell’attività anti-cancro dei composti 5-8 contro HeLa e le linee cellulari del cancro PC-3 era probabilmente dovuto alla presenza di C = C a C-1/C-2 e carbonilchetone a C-3 e C-17 rispetto al substrato 1.
Conclusione
Contributi dell’autore
Il concetto di ricerca presentata è stato sviluppato e progettato da MIC. MIC era anche il supervisore del progetto. Tutti i dati sono stati analizzati e interpretati da MIC, A-t-W e HC. MS, SY, MA e NF hanno eseguito gli esperimenti. MIC, A-t-W e MS hanno scritto il manoscritto. Tutti gli autori hanno rivisto il manoscritto. Anche la versione finale del manoscritto è stata approvata dal MIC prima della presentazione.
Dichiarazione sul conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
A-t-W, e MIC riconoscono il ruolo abilitante della Commissione per l’istruzione superiore, Islamabad, Pakistan, attraverso un sostegno finanziario sotto, “Studi sulla chemioprevenzione della carcinogenesi mammaria da agenti dietetici, (20-3790/NRPU/R&D/HEC/13 / 793).”SY riconosce il sostegno finanziario dell’OPCW (Organizzazione per la proibizione delle armi chimiche) attraverso un progetto di ricerca intitolato “Studi strutturali e biologici su nuovi steroidi anabolizzanti ottenuti dalla biotrasformazione.”HC riconosce il sostegno finanziario di” Il Decanato della Ricerca scientifica (DSR), King Abdulaziz University, Ministero della Pubblica Istruzione, Arabia Saudita.”
Materiale supplementare
Eastman, A. (1999). “Il meccanismo d’azione del cisplatino: dagli addotti all’apoptosi”, in cisplatino: Chimica e biochimica di un farmaco antitumorale leader, ed B. Lippert (Zürich: Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002/9783906390420.ch4
CrossRef Full Text/Google Scholar
Vardar, E., Vardar, SA, e Cengiz, T. (2002). Abuso steroide anabolico-androgeno. Anato. J. Psichiatria 3, 104-107.