Biologiske oljer er forskjellige fra petroleumoljer («vanlig» diesel) i molekylær struktur og egenskaper.

Vanlig petroleum dieselbrensel er en blanding av enkle hydrokarboner, MED gjennomsnittlig kjemisk formel C12H23 (vist nedenfor), men komponenter kan variere omtrent fra c10h20 (dodekan) til c15h28(pentadekan). Derimot er biologiske oljer » triglyserider «(klassifisert som «estere») som glyceryltrilinoleat vist nedenfor:
| C12H23, dodekan | et triglyserid: glyceryltrilinoleat |
på grunn av deres store størrelse og følgelig store intermolekylære attraksjoner, er viskositeten til biologiske oljer generelt for høy til bruk i konvensjonelle dieselmotorer. Biologiske oljer brenner også litt mindre lett, og med en sotere flamme enn petroleumsdiesel. Biologiske oljer kan brukes i konvensjonelle dieselmotorer hvis de forvarmes for å redusere viskositeten, men dette krever en ekstra elektrisk varmeapparat til motoren varmes opp. For disse resons krever bilogiske oljer behandling for bruk som biodiesel.en biologisk olje er en ester, som er en type organisk forbindelse som har atomforbindelsen vist nedenfor.
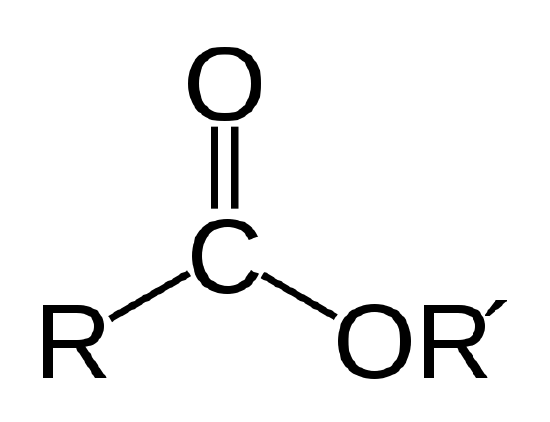 esterforbindelsen. R og R representerer kjeder av karbon-og hydrogenatomer. R = – CH3 og R’=- C18H35O2 for metylstearatet I Eksempel 1 |
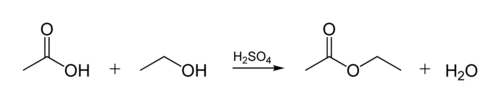
esterforbindelsen i biologiske oljer er opprettet når et glycerolmolekyl reagerer MED ORGANISKE SYRER. Glycerolmolekylet har en kjede av 3 karbonatomer, hver med en-OH (alkohol) gruppe på den. Figuren nedenfor viser hvordan en organisk alkohol reagerer med en organisk syre. Organiske kjemikere forkorter molekylære strukturer-» zig-zag » – linjene i figuren representerer karbonkjeder med Et c-atom ved hver «zig» eller «zag». Hvert karbon har 4 bindinger, og hvis færre enn 4 vises, antas det at De går Til h-atomer. Så alkoholen ER C2H5OH (etanol), og syren er eddiksyre (ELLER etansyre, CH3COOH) i Figuren:
siden glyserol har 3-OH-GRUPPER, festes 3 langkjedede organiske «fettsyrer» for å gjøre det store «triglyserid».
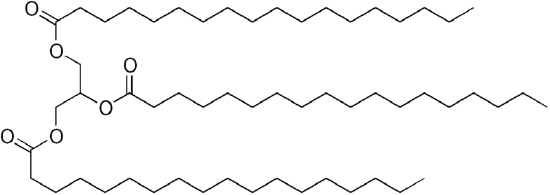
Stearin, eller glyceryl tristearat
men like lett som estere kan fremstilles av alkoholer og syrer, kan de bytte alkoholer eller syrer. I nærvær Av en sterk basekatalysator, Som NaOH, kan et triglyserid reagere med 3 små alkoholmolekyler, som metanol (CH3OH), som erstatter glycerolens «ryggrad», noe som gjør 3 separate estere med lavere molekylvekt
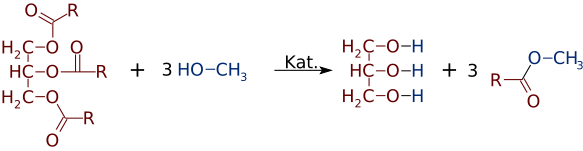
Ganske ofte dannes en blanding av to eller flere produkter. For eksempel, når en vegetabilsk olje reagerer med metanol, kan bare en eller to av syrene forskyves fra glyserinen, og produserer bare 1 eller 2 FAMEs.
C3H5(C18H35O2)3 + NaOH + 2 CH3OH → C3H5(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH → C3H5(C18H35O2)(OH)2 + 1 C17H35COOCH3 C3H5(C18H35O2) (OH)2 + 1 C17H35COOCH3 C3H5 (C18H35O2) 3 + naoh + 3 CH3OH → C3H5 (OH) 3 + 3 C17h35cooch3
VANLIGVIS TILSETTES ET STORT OVERSKUDD AV METANOL OG NATRIUMHYDROKSYD, SLIK AT REAKSJONEN GIR MAKSIMAL BERØMMELSE.
Men i tilfelle transesterifisering, selv om ingen av reaktantene er fullstendig konsumert, oppstår ingen ytterligere økning i mengdene av produktene. Vi sier at en slik reaksjon ikke går til ferdigstillelse. Når en blanding av produkter produseres eller en reaksjon ikke går til fullføring, vurderes effektiviteten av reaksjonen vanligvis i form av prosentutbytte av ønsket produkt. Et teoretisk utbytte beregnes ved å anta at alt begrensende reagens omdannes til produkt. Den eksperimentelt bestemte massen av produktet sammenlignes deretter med det teoretiske utbyttet og uttrykkes som en prosentandel:

EKSEMPEL 1 NÅR 100,0 g C3H5(C18H35O2)3 gass og 15,0 g CH3OH blandes ved 55°C Med NaOH katalysator, reagerer de for å danne 90,96 g C17H35COOCH3 metylstearat biodiesel. Beregn prosent avkastning.
Løsning Vi må beregne det teoretiske utbyttet AV NH3, og for å gjøre dette må vi først oppdage Om N2 eller H2 er begrensningsreagenset. FOR den balanserte ligningen
C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3 stearin + natriumhydroksid + 3 ch3oh → glyserol + 3 metylstearat
det støkiometriske forholdet mellom reaktantene er
 nå er de første mengdene av de to reagensene areand
nå er de første mengdene av de to reagensene areand  forholdet MELLOM INNLEDENDE BELØP ER SÅLEDES
forholdet MELLOM INNLEDENDE BELØP ER SÅLEDES SIDEN dette forholdet er mindre ENN
SIDEN dette forholdet er mindre ENN  , er det et overskudd av ch3oh. Stearin er det begrensende reagenset. Følgelig må vi bruke 0,1122 mol stearin og 0,3366 mol CH3OH (i stedet for 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, er det et overskudd av ch3oh. Stearin er det begrensende reagenset. Følgelig må vi bruke 0,1122 mol stearin og 0,3366 mol CH3OH (i stedet for 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.