Introduksjon
Co-immunoprecipitation, Co-IP kort Sagt, Er en mye brukt teknikk for å identifisere fysiologisk relevante protein-protein interaksjoner ved å utnytte målet protein – spesifikke antistoffer til indirekte fange proteiner som er bundet til dette spesifikke målet protein. Som en forlengelse AV IP kan Co-IP fange og rense ikke bare det primære målet, men også andre makromolekyler som binder seg til målet ved innfødte interaksjoner. Forskjellen MELLOM ip og co-IP er fokus for eksperimentet. IP er fokusert på det primære målet, som binder antistoffet. Mens Co-IP målretter de sekundære målene, som interagerer med de primære proteinene, i stedet for antistoff. Etter immunoprecipitation blir proteiner fanget på perlene vasket og eluert for å få rensede primære og sekundære målproteiner. Disse målproteinene kan karakteriseres i ulike metoder, For Eksempel WesternBlot og massespec analyse under shotgun-strategi, for å identifisere partnerprotein-Ider, bindende slektskap, kinetikk for binding og uoppdagede funksjoner av primærproteinet.
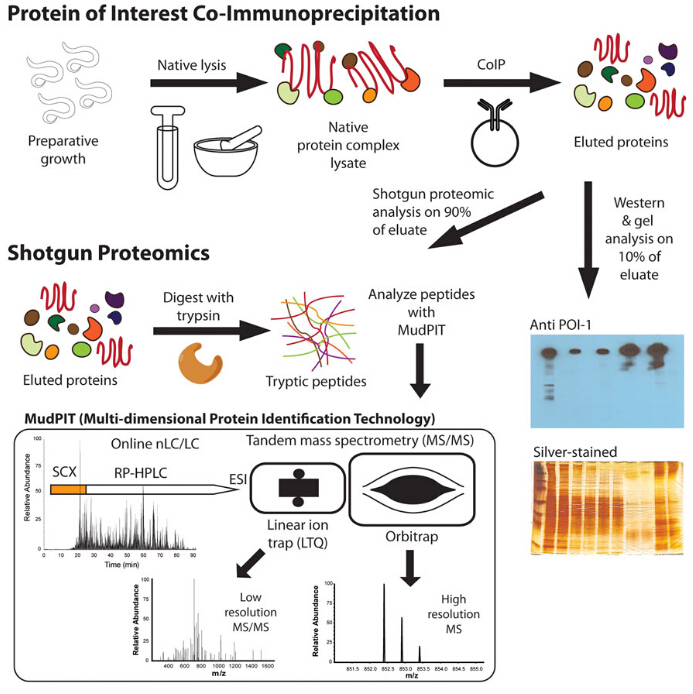
Kritiske faktorer Om Co-IP:
som en kraftig teknikk benyttes Co-IP regelmessig av biokjemikere for å utforske protein–protein-interaksjoner. Mens Co-IP-metoden er grei, er det ikke lett å identifisere fysiologiske protein-protein-interaksjoner gjennom Co-IP-reaksjon på grunn av interaksjonens ustabilitet, ikke-spesifikk binding TIL IP-reagenser og antistoffkontaminering. Alle problemene ovenfor kan ha negative effekter på deteksjon av protein-protein-interaksjoner. Siden Ko-IP avhenger av protein – protein-interaksjoner for å oppdage de bundne proteinene, er bindingsaffiniteten og stabiliteten til de fysiologiske interaksjonene under Hele Ko-IP-prosessen svært viktig. Utilstrekkelig bindingstid og omfattende vasketrinn kan redusere bindingseffektiviteten og føre til svikt i påvisning av proteininteraksjon. Derfor, for proteiner, som er spådd å ha uke binding affinitet eller dynamiske interaksjoner, forhånd stabilisering av protein-protein interaksjoner er nødvendig, for eksempel, tverrbindingsprosesser kan utføres før Co-IP.
Uspesifikke interaksjoner
Brudd på cellemembran og organeller forårsaker frigjøring av store mengder proteiner, som er adskilt av grensen, for å komme i kontakt. Derfor er det uunngåelig at uspesifikke interaksjoner, med andre ord falske positive interaksjoner, kan forekomme, noe som forstyrrer dataanalysen. Dette er spesielt vanlig for proteiner som har utfoldet eller fleksible regioner, som er relativt klissete og uspesifikt binder andre proteiner. Måter å gjenoppleve slike problemer kan være preclearance av lysat ved hjelp av primære antistoffer for å fjerne uspesifikke proteiner, og endre den ioniske styrken til bufferen for å redusere den uspesifikke bindingen.Creative Proteomics kan gi tilpasset eksperimentell design og avgrense Co-IP parametere basert på kundenes behov. Vi lover pålitelig Co-IP analyse av protein-protein interaksjoner med våre erfarne forskere og teknikere.
Overvåke dynamikken i protein interaksjon
Vår Co-IP-tjenesten inneholder:
- Eksperiment design basert på dine spesifikke prosjektbehov: buffere, perler, antistoffer, etc.
- Parametere optimalisering, slik som bindingstid
- Celle lysis, IP, vask& elusjon
- WesternBlot/ massespektrometri, avhengig av prosjektets behov
- dataanalyse& rapporter levering
Bestillingsprosedyre:
