Doseringsform: injeksjon
Medisinsk anmeldt Av Drugs.com. Sist oppdatert 22.Desember 2020.
- Bivirkninger
- Dosering
- Profesjonell
- Interaksjoner
- Graviditet
- Mer
Kun Rx.
Steril Intravenøs Oppløsning
- Inamrinon Beskrivelse
- Inamrinon-Klinisk Farmakologi
- Farmakokinetikk
- Farmakodynamikk
- Indikasjoner og Bruk for inamrinon
- Kontraindikasjoner
- Advarsler
- Forsiktighetsregler
- Generelt
- Laboratorietester
- Legemiddelinteraksjoner
- Kjemiske Interaksjoner
- Karsinogenese, Mutagenese, Nedsatt Fertilitet
- Graviditet
- Ammende Mødre
- Pediatrisk Bruk
- Bivirkninger
- Håndtering av Bivirkninger
- Overdosering
- Inamrinon Dosering og Administrasjon
- Kjemiske Interaksjoner
- Hvordan Leveres Inamrinon
- VIAL LABEL
- More about inamrinone
- Related treatment guides
Inamrinon Beskrivelse
INAMRINON Injeksjon USP representerer en ny klasse av hjerte inotrope midler forskjellig fra digitalis glykosider eller katekolaminer. Inamrinonlaktat er betegnet kjemisk som 5-Amino-6(1h)-en 2-hydroksypropanat og har følgende struktur:
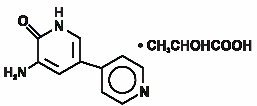
Inamrinon Er en blekgul krystallinsk forbindelse med en molekylvekt PÅ 187,20 OG en molekylformel PÅ C10H9N3O. Hver mol melkesyre har en molekylvekt på 90,08 og en empirisk molekylvekt.formel av c3h6o3. Oppløseligheten Av Inamrinon ved pH 4,1, 6,0 og 8,0 er henholdsvis 25, 0,9 og 0,7 mg/mL.
inamrinon injeksjon er en klar gul steril oppløsning tilgjengelig i 20 mL hetteglass for intravenøs administrering. Hver mL inneholder Inamrinonlaktat tilsvarende 5 mg Inamrinon og 0,25 mg natriummetabisulfitt tilsatt som konserveringsmiddel I Vann til Injeksjonsvæsker. Alle doser uttrykt i pakningsvedlegget uttrykkes i form Av basen, Inamrinon. PH justeres til mellom 3,2 og 4,0 med melkesyre eller natriumhydroksid. Den totale konsentrasjonen av melkesyre kan variere mellom 5 mg og 7,5 mg.
Inamrinon-Klinisk Farmakologi
Inamrinon er et positivt inotrop middel med vasodilatoraktivitet, forskjellig i struktur og virkemåte fra enten digitalisglykosider eller katekolaminer.
mekanismen for dens inotrope og vasodilatoreffekter er ikke fullstendig uttalt.
med hensyn til sin inotrope effekt indikerer eksperimentelle bevis at det ikke er en beta-adrenerg agonist. Det hemmer myokardisk syklisk adenosinmonofosfat (c-AMP) fosfodiesteraseaktivitet og øker cellulære nivåer av c-AMP. I motsetning til digitalis hemmer det ikke natrium-kaliumadenosintrifosfataseaktivitet.
Med hensyn til dens vasodilatoriske aktivitet reduserer Inamrinon afterload og preload ved sin direkte relakserende effekt på vaskulær glatt muskulatur.
Farmakokinetikk
etter intravenøs bolusinjeksjon (1 til 2 minutter) på 0,68 mg/kg til 1,2 mg / kg til normale frivillige, hadde Inamrinon et distribusjonsvolum på 1,2 liter / kg, og etter en distribusjonsfasehalveringstid på ca.4,6 minutter i plasma, hadde en gjennomsnittlig tilsynelatende førsteordens terminal eliminasjonshalveringstid på ca. 3,6 timer. Hos pasienter med kongestiv hjertesvikt som fikk infusjoner Av Inamrinon var gjennomsnittlig tilsynelatende førsteordens terminal eliminasjonshalveringstid omtrent 5,8 timer.Inamrinon er i en studie vist å være 10% til 22% bundet til humant plasmaprotein ved ultrafiltrering in vitro, og i en annen studie 35% til 49% bundet til enten ultrafiltrering eller likevektsdialyse.
den primære utskillelsesveien hos mennesker er via urin som Både Inamrinon og flere metabolitter (N-glykolyl, N-acetat, O-glukuronid og N-glukuronid). Hos normale frivillige ble omtrent 63% av en oral dose På 14 C-Iabellert Inamrinon utskilt i urinen i løpet av en 96-timers periode. I løpet av de første 8 timene var 51% av radioaktiviteten I urinen Inamrinon med 5% Som N-acetat, 8% Som N-glykolat og mindre enn 5% for hvert glukuronid. Omtrent 18% av den administrerte dosen ble utskilt i avføring etter 72 timer.
i en 24-timers ikke-radioaktiv intravenøs studie ble 10% til 40% av dosen utskilt i urin som uendret Inamrinon med n-acetylmetabolitten som representerte mindre enn 2% av dosen.
hos pasienter med kongestiv hjertesvikt kunne steady-state plasmanivåer på ca.2,4 mikrog/mL opprettholdes ved en infusjon på 5 mikrog/kg/min til 10 mikrog/kg/min etter en bolusdose. Hos noen pasienter med kongestiv hjertesvikt, med tilhørende nedsatt nyre-og leverperfusjon, er Det mulig at plasmanivåene Av Inamrinon kan stige i løpet av infusjonsperioden, og hos disse pasientene kan det derfor være nødvendig å overvåke hemodynamisk respons og / eller legemiddelnivå. De viktigste tiltakene for pasientrespons inkluderer hjerteindeks, lungekapillær kiletrykk, sentralt venetrykk og deres forhold til plasmakonsentrasjoner. I tillegg kan målinger av blodtrykk, urinmengde og kroppsvekt være nyttig, som kan slike kliniske symptomer som orthopnea, dyspnø og tretthet.
Farmakodynamikk
hos pasienter med deprimert myokardfunksjon produserer Inamrinon en rask økning i hjerteutgang på grunn av inotrope og vasodilatorhandlinger.
Etter en enkelt intravenøs bolusdose Med Inamrinon på 0.75 mg/kg til 3 mg / kg hos pasienter med kongestiv hjertesvikt oppstår doserelatert maksimal økning i minuttvolum (ca. 28% ved 0,75 mg / kg til ca. 61% ved 3 mg / kg). Toppeffekten oppstår innen 10 minutter ved alle doser. Varigheten av effekten avhenger av dosen, som varer ca. 1/2 time ved 0,75 mg/kg og ca. 2 timer ved 3 mg / kg.
i samme doseområde viser lungekapillær kiletrykk og total perifer motstand doserelaterte reduksjoner (gjennomsnittlig maksimal reduksjon på 29% i lungekapillær kiletrykk og 29% i systemisk vaskulær resistens). Ved doser på opptil 3 mg/kg er det observert doserelatert reduksjon i diastolisk trykk (opptil 13%). Gjennomsnittlig arterielt trykk reduseres (9,7%) i en dose på 3 mg/kg. Hjertefrekvensen er generelt uendret.
endringene i hemodynamiske parametere opprettholdes ved kontinuerlig intravenøs infusjon og i flere timer etterpå.Inamrinon er effektivt hos fullt digitaliserte pasienter uten å forårsake tegn på hjerteglykosidtoksisitet. Dens inotrope effekter er additive til digitalis. I tilfeller av atrieflutter / fibrillering Er Det mulig At Inamrinon kan øke ventrikulær responsrate på grunn av sin svake forbedring av A/V-ledning. I slike tilfeller anbefales tidligere behandling med digitalis.
Forbedring i venstre ventrikulær funksjon og lindring av kongestiv hjertesvikt hos pasienter med iskemisk hjertesykdom er observert. Forbedringen har skjedd uten å fremkalle symptomer eller elektrokardiografiske tegn på myokardisk iskemi.
ved konstant hjertefrekvens og blodtrykk oppstår økning i hjerteutgang uten målbare økninger i myokardisk oksygenforbruk eller endringer i arteriovenøs oksygenforskjell.
Inotrop aktivitet opprettholdes etter gjentatte intravenøse doser Av Inamrinon. Administrering av inamrinon gir hemodynamiske og symptomatiske fordeler for pasienter som ikke er tilfredsstillende kontrollert ved konvensjonell behandling med diuretika og hjerteglykosider.
Indikasjoner og Bruk for inamrinon
inamrinon injeksjon er for kortsiktig behandling av kongestiv hjertesvikt. På grunn av begrenset erfaring og potensial for alvorlige bivirkninger (SE BIVIRKNINGER), Bør Inamrinon kun brukes hos pasienter som kan overvåkes nøye og som ikke har respondert adekvat på digitalis, diuretika og / eller vasodilatorer. Erfaring med intravenøs Inamrinon i kontrollerte studier strekker seg ikke utover 48 timer med gjentatte boluser og / eller kontinuerlige infusjoner.Uansett om Det gis oralt, kontinuerlig intravenøst eller intermittent intravenøst, har verken Inamrinon eller noen annen syklisk-AMP-avhengig inotrope i kontrollerte studier vist seg å være sikker eller effektiv ved langtidsbehandling av kongestiv hjertesvikt. I kontrollerte studier av kronisk peroral behandling med ulike slike midler (inkludert Inamrinon) ble symptomene ikke konsekvent lindret, og de syklisk-AMP-avhengige inotropene var konsekvent forbundet med økt risiko for sykehusinnleggelse og død. Pasienter MED NYHA KLASSE IV symptomer syntes å være spesielt utsatt.
Kontraindikasjoner
Inamrinon er kontraindisert hos pasienter som er overfølsomme for det.
Det er også kontraindisert hos de pasientene som er kjent for å være overfølsomme for bisulfitter.
Advarsler
Inneholder natriummetabisulfitt, en sulfitt som kan forårsake allergiske reaksjoner, inkludert anafylaktiske symptomer og livstruende eller mindre alvorlige astmatiske episoder hos visse følsomme personer. Den totale forekomsten av sulfittfølsomhet i den generelle befolkningen er ukjent og sannsynligvis lav. Sulfitt følsomhet er sett oftere i astmatisk enn i nonasthmatic mennesker.
Forsiktighetsregler
Generelt
Inamrinon skal ikke brukes hos pasienter med alvorlig aorta-eller pulmonal valvulær sykdom i stedet for kirurgisk lindring av obstruksjonen. Som andre inotrope midler, kan det forverre utløpskanalen obstruksjon i hypertrofisk subaortastenose.
under intravenøs behandling med Inamrinon bør blodtrykk og hjertefrekvens overvåkes og infusjonshastigheten bremses eller stoppes hos pasienter som viser kraftig blodtrykksfall.
Pasienter som har fått kraftig diuretisk behandling kan ha utilstrekkelig hjertefyllingstrykk til å reagere adekvat På Inamrinon, i så fall kan forsiktig liberalisering av væske – og elektrolyttinntak være indisert.
Supraventrikulære og ventrikulære arytmier har blitt observert i den svært høyrisikopopulasjonen som ble behandlet. Mens Inamrinon i seg selv ikke har vist seg å være arytmogen, kan potensialet for arytmi, tilstede i kongestiv hjertesvikt i seg selv, økes med et hvilket som helst legemiddel eller kombinasjon av legemidler.
Trombocytopeni og levertoksisitet er observert (SE BIVIRKNINGER).
BRUK VED AKUTT MYOKARDINFARKT
ingen kliniske studier har blitt utført hos pasienter i den akutte fasen av postmyokardinfarkt. Inamrinon anbefales derfor ikke i disse tilfellene.
Laboratorietester
Væske og Elektrolytter
Væske-og elektrolyttendringer og nyrefunksjon bør overvåkes nøye under inamrinonbehandling. Forbedring av minuttvolum med resulterende diurese kan nødvendiggjøre en reduksjon i diuretisk dose. Kaliumtap på grunn av overdreven diurese kan predisponere digitaliserte pasienter til arytmier. Hypokalemi bør derfor korrigeres med kaliumtilskudd før Eller under Bruk Av Inamrinon.
Legemiddelinteraksjoner
i en relativt begrenset erfaring er det ikke observert uønskede kliniske manifestasjoner hos pasienter der Inamrinon ble brukt samtidig med følgende legemidler: digitalisglykosider; lidokain, kinidin; metoprolol, propranolol; hydralazin, prazosin; isosorbiddinitrat, nitroglyserin; klortalidon, etakrynsyre, furosemid, hydroklortiazid, spironolakton, kaptopril, heparin, warfarin, kaliumtilskudd, insulin, diazepam.
en kasusrapport om overdreven hypotensjon er rapportert når Inamrinon ble brukt samtidig med disopyramid.
inntil ytterligere erfaring er tilgjengelig, bør samtidig administrering med disopyramid utføres med forsiktighet.
Kjemiske Interaksjoner
en kjemisk interaksjon skjer sakte over en 24-timers periode når den intravenøse oppløsningen Av Inamrinon blandes direkte med dextrose (glukose)-holdige løsninger. Inamrinon BØR DERFOR IKKE FORTYNNES MED OPPLØSNINGER SOM INNEHOLDER DEKSTROSE (GLUKOSE) før INJEKSJON.
en kjemisk interaksjon skjer umiddelbart, noe som fremgår av dannelsen av et bunnfall når furosemid injiseres i en intravenøs infusjonslinje Av Inamrinon. Furosemid skal derfor ikke administreres i intravenøse linjer som inneholder Inamrinon.
Karsinogenese, Mutagenese, Nedsatt Fertilitet
Det var ingen antydning om karsinogent potensiale med Inamrinon når det ble administrert oralt i opptil to år til rotter og mus i dosenivåer opp til maksimalt tolerert dose på 80 mg/kg/dag.
mikronukleustesten for mus (ved 7,5 til 10 ganger maksimal human dose) og kromosomavviksanalysen For ovariehemmere fra Kinesisk hamster var positive som indikerte både klastogent potensial og suppresjon av antall polykromatiske erytrocytter. Imidlertid Var Ames Salmonella-analysen, muselymfomstudien og dyrkede humane lymfocyttmetafaseanalyser alle negative. De klastogene effektene står i kontrast til negative resultater oppnådd i fertilitetsstudiene hos hann-og hunnrotter, og en tregenerasjonsstudie hos rotter, begge med oral dosering.
Svak forlengelse av drektighetsperioden hos rotter ble sett i disse studiene ved dosenivåer på 50 mg/kg/dag og 100 mg/kg / dag. Dystoki forekom hos demninger som fikk 100 mg / kg / dag, noe som resulterte i økt antall dødfødsler, redusert kullstørrelse og dårlig overlevelse hos valper.
Graviditet
Teratogene Effekter – Graviditetskategori C
Hos Newzealandske hvite kaniner har Inamrinon vist seg å produsere føtale skjelett-og grove ytre misdannelser ved orale doser på 16 mg / kg og 50 mg / kg som var toksiske for kaninen. Studier på franske Hy / Cr kaniner ved bruk av orale doser opp til 32 mg / kg / dag bekreftet ikke dette funnet. Ingen misdannelser ble sett hos rotter som fikk inamrinon intravenøst ved maksimal dose brukt, 15 mg / kg / dag (omtrent anbefalt daglig intravenøs dose for pasienter med kongestiv hjertesvikt). Det foreligger ikke tilstrekkelige og velkontrollerte studier hos gravide kvinner. Inamrinon bør kun brukes under graviditet dersom den potensielle fordelen oppveier den potensielle risikoen for fosteret.
Ammende Mødre
Forsiktighet Bør utvises Når inamrinon administreres til ammende kvinner, siden Det ikke er kjent om Det utskilles i morsmelk.
Pediatrisk Bruk
Sikkerhet og effekt hos pediatriske pasienter er ikke fastslått.
Bivirkninger
Trombocytopeni: Intravenøs injeksjon av Inamrinon resulterte i redusert antall blodplater til under 100 000 / mm3 eller normale grenser hos 2,4 prosent av pasientene.
det er vanligere hos pasienter som får langvarig behandling. Til dags dato, i nøye overvåkede kliniske studier, hos pasienter hvis blodplatetall ikke fikk forbli deprimert, er det ikke observert blødningsfenomener.
Blodplatereduksjon er doseavhengig og vises på grunn av en reduksjon i blodplateoverlevelsestid. Flere pasienter som utviklet trombocytopeni mens De fikk Inamrinon, hadde benmargsundersøkelser som var normale. Det er ingen holdepunkter for reduksjon av blodplater i forhold til immunrespons eller en blodplateaktiverende faktor.Gastrointestinale Bivirkninger: Gastrointestinale bivirkninger rapportert Med Inamrinon under klinisk bruk inkluderte kvalme (1,7%), oppkast (0,9%), magesmerter (0,4%) og anoreksi (0,4%).Kardiovaskulære Bivirkninger: Kardiovaskulære bivirkninger rapportert Med Inamrinon inkluderer arytmi (3%) og hypotensjon (1,3%).
Levertoksisitet: Inamrinon viste doserelatert levertoksisitet hos hunder, VED IV doser mellom 9 mg/kg/dag og 32 mg/kg/dag, enten som enzymhøyde eller levercellenekrose eller begge deler. Levertoksisitet er observert hos mennesker etter langvarig oral dosering, og har med begrenset erfaring (0,2%) blitt observert etter intravenøs administrering Av Inamrinon. Det har også vært sjeldne rapporter om enzym – og bilirubinhøyde og gulsott.
Overfølsomhet: det har vært rapporter om flere tilsynelatende overfølsomhetsreaksjoner hos pasienter behandlet med oral Inamrinon i omtrent to uker. Tegn og symptomer var variable, men inkluderte perikarditt, pleuritt og ascites (1 tilfelle), myositt med interstitiell skygge på brystrøntgen og forhøyet sedimenteringshastighet (1 tilfelle) og vaskulitt med nodulær lungetetthet, hypoksemi og gulsott (1 tilfelle). Den første pasienten døde, ikke nødvendigvis av den mulige reaksjonen, mens de to siste gikk over ved seponering av behandlingen. Ingen av tilfellene ble rechallenged slik At attribusjon Til Inamrinon ikke er sikkert, men mulige overfølsomhetsreaksjoner bør vurderes hos enhver pasient som opprettholdes i en lengre periode på Inamrinon.
Generelt: Ytterligere bivirkninger observert i intravenøse Inamrinon kliniske studier inkluderer feber (0,9%), brystsmerter (0,2%) og brenning på injeksjonsstedet (0,2%).
Håndtering av Bivirkninger
Reduksjon Av Antall Blodplater: Asymptomatisk reduksjon i antall blodplater (til <150 000 / mm3) kan reverseres innen en uke etter en reduksjon i legemiddeldosen. Videre, uten endring i medikamentdosering, kan tellingen stabilisere seg ved lavere enn pre-medikamentnivåer uten noen klinisk følge. Pre-drug blodplatetall og hyppige blodplatetall under behandling anbefales for å bistå i beslutninger om dosejusteringer.
Skulle et blodplateantall mindre enn 150 000 / mm3 forekomme, kan følgende tiltak vurderes:
• Oppretthold den totale daglige dosen uendret, siden antallet i noen tilfeller enten har stabilisert seg eller gått tilbake til nivået før behandling. * Reduser total daglig dose. * Avbryt inamrinon hvis risikoen etter legens kliniske vurdering overstiger den potensielle fordelen. Gastrointestinale Bivirkninger: mens gastrointestinale bivirkninger ble sett sjelden med intravenøs behandling, bør det oppstå alvorlige eller svekkende, kan legen ønske å redusere doseringen eller avbryte legemidlet basert på de vanlige nytte-til-risiko-hensynene.
Levertoksisitet: I klinisk erfaring med intravenøs administrering er levertoksisitet observert i sjeldne tilfeller. Dersom akutte markerte endringer i leverenzymer forekommer sammen med kliniske symptomer som tyder på en idiosynkratisk overfølsomhetsreaksjon, bør Inamrinonbehandling seponeres omgående.
hvis mindre enn merkede enzymendringer forekommer uten kliniske symptomer, bør disse uspesifikke endringene evalueres individuelt. Legen kan ønske Å fortsette Med Inamrinon, redusere dosen eller avslutte behandlingen basert på de vanlige nytte / risiko-betraktningene.
Overdosering
dødsfall er rapportert med en massiv utilsiktet overdose (840 mg over tre timer ved initial bolus og infusjon) Av Inamrinon, selv om årsakssammenheng er usikker. Det bør utvises aktsomhet under preparering og administrasjon av produktet.
Doser Av Inamrinon kan gi hypotensjon på grunn av sin vasodilatoreffekt. Hvis Dette skjer, bør Administrering Av Inamrinon reduseres eller seponeres. Ingen spesifikk antidot er kjent, men generelle tiltak for sirkulasjonsstøtte bør iverksettes.
HOS rotter VAR LD50 Av Inamrinon, som laktatsalt, 102 mg/kg eller 130 mg/kg intravenøst i to forskjellige studier og 132 mg / kg oralt (intragastrisk); som en suspensjon i vandig tannkjøtttragakant var DEN orale LD50 239 mg / kg.
Inamrinon Dosering og Administrasjon
Startdoser Av inamrinon injeksjon skal administreres som levert (ufortynnet). Infusjoner Av Inamrinon kan administreres i normal eller halv normal saltoppløsning til en konsentrasjon på 1 mg / mL til 3 mg / mL. Fortynnede løsninger skal brukes innen 24 timer.
inamrinon injeksjon kan gis i løpende dekstrose (glukose) infusjoner gjennom En Y-Kontakt eller direkte inn i slangen der det er ønskelig.
Kjemiske Interaksjoner
en kjemisk interaksjon skjer sakte over en 24-timers periode når den intravenøse oppløsningen Av Inamrinon blandes direkte med dextrose (glukose)-holdige løsninger. Inamrinon BØR DERFOR IKKE FORTYNNES MED OPPLØSNINGER SOM INNEHOLDER DEKSTROSE (GLUKOSE) før INJEKSJON.
en kjemisk interaksjon skjer umiddelbart, noe som fremgår av dannelsen av et bunnfall når furosemid injiseres i en intravenøs infusjonslinje Av Inamrinon. Furosemid skal derfor ikke administreres i intravenøse linjer som inneholder Inamrinon.
følgende prosedyre anbefales for administrering Av inamrinoninjeksjon:
1. Start behandlingen med en startdose på 0,75 mg/kg gitt langsomt over 2 til 3 minutter.
|
LOADING DOSE DETERMINATION 0.75 mg/kg (undiluted) |
||||||||||
|
Patient Weight in kg |
||||||||||
|
mL of undiluted Inamrinone Injection |
||||||||||
2. Continue therapy with a maintenance infusion between 5 mcg/kg/min and 10 mcg/kg/min.
3. Based on clinical response, an additional loading dose of 0.75 mg/kg may be given 30 minutes after the initiation of therapy.
4. Infusjonshastigheten varierer vanligvis fra 5 mikrogram / kg / min til 10 mikrogram/kg/min slik at den anbefalte totale daglige dosen (inkludert startdoser) ikke overstiger 10 mg / kg. Et begrenset antall pasienter studert ved høyere doser støtter et doseringsregime på opptil 18 mg / kg / dag for kortere behandlingsvarighet.
følgende infusjonshastighetsdiagram kan brukes for å sikre at beregningene er gjort riktig.
for å benytte diagrammet må Konsentrasjonen Av inamrinon infusjonsvæske som brukes være 2,5 mg / mL (2500 mikrogram/mL). Denne konsentrasjonen fremstilles ved å blande inamrinonoppløsningen med et likt volum fortynningsmiddel (normal eller halv normal saltvann).
| * Fortynning: for å tilberede 2,5 mg / mL konsentrasjon anbefalt for infusjonsblanding Inamrinon med et likt volum fortynningsvæske. Bland for eksempel tre 20 mL hetteglass Med Inamrinon (3 x 20 mL = 60 mL) med 60 mL fortynningsmiddel for et totalt volum på 120 mL av Den endelige 2,5 mg/mL oppløsningen Av Inamrinon. | ||||||||||
|
Inamrinone IV INFUSION RATE (mL/hr) CHART Using 2.5 mg/mL Infusion Concentration* |
||||||||||
|
Patient Weight in kg |
||||||||||
|
Dosage: 5.0 mcg/kg/min |
||||||||||
|
7.5 mcg/kg/min |
||||||||||
|
10.0 mcg/kg/min |
||||||||||
Example: A 70 kg patient would require a loading dose of 10.5 mL of undiluted Inamrinone. If the physician selects a dose of 7.5 mikrogram/kg/min for infusjonen vil strømningshastigheten være 13 mL / time ved 2,5 mg/mL konsentrasjon Av Inamrinon.
5. Administrasjonshastigheten og varigheten av behandlingen bør justeres i henhold til pasientens respons. Legen kan ønske å redusere eller titrere infusjonen nedover basert på klinisk respons eller uheldige effekter.
doseringsregimene ovenfor kan forventes å plassere de Fleste pasienters plasmakonsentrasjon Av Inamrinon på omtrent 3 mikrog / mL. Økninger i hjerteindeks viser et lineært forhold til plasmakonsentrasjon i et område på 0.5 mcg / mL til 7 mcg / mL. Ingen observasjoner er gjort ved høyere plasmakonsentrasjoner.
pasientforbedring kan reflekteres av økning i hjerteutgang, reduksjon i lungekapillær kiletrykk og slike kliniske responser som reduksjon av dyspnø og forbedring av andre symptomer på hjertesvikt, som orthopnea og tretthet.Overvåking av sentralt venetrykk (cvp) kan være nyttig ved vurdering av hypotensjon og væskebalansestyring. Tidligere korreksjon eller justering av væske/elektrolytter er nødvendig for å oppnå tilfredsstillende respons med Inamrinon.
Parenterale legemidler bør inspiseres visuelt og bør ikke brukes dersom partikler eller misfarging observeres.
Hvordan Leveres Inamrinon
Inamrinon Injeksjon USP leveres i endose hetteglass med 20 mL steril, klar gul oppløsning individuelt eske. NDC 55390-042-10.
hver 1 mL inneholder inamrinonlaktat tilsvarende 5 mg Inamrinon.
Beskytt mot lys. Emballasjen er lett motstandsdyktig for beskyttelse under lagring. Oppbevares i kartong til brukstid.
Oppbevares ved kontrollert romtemperatur 15° til 30°C (59° til 86°F).
Manufactured by: Manufactured for:
Ben Venue Laboratories, Inc. Bedford Laboratories™
Bedford, OH 44146 Bedford, OH 44146
August 2002 AMR-P01
VIAL LABEL

Vial Label 100 mg/20 mL
| Inamrinone Inamrinone injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Bedford Laboratories (884528407)
Registrant – Ben Venue Laboratories (004327953)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Ben Venue Laboratories Inc. | 004327953 | MANUFACTURE(55390-042) | |
More about inamrinone
- Side Effects
- During Pregnancy
- Dosage Information
- Drug Interactions
- Drug class: inotropic agents
Related treatment guides
- Heart Failure
Medical Disclaimer