
Sau (Larry) Lee, Ph. D., Assisterende Direktør For Office Of Testing Og Forskning, Og Leder Av Emerging Technology Team, Office Of Pharmaceutical Quality, CDER
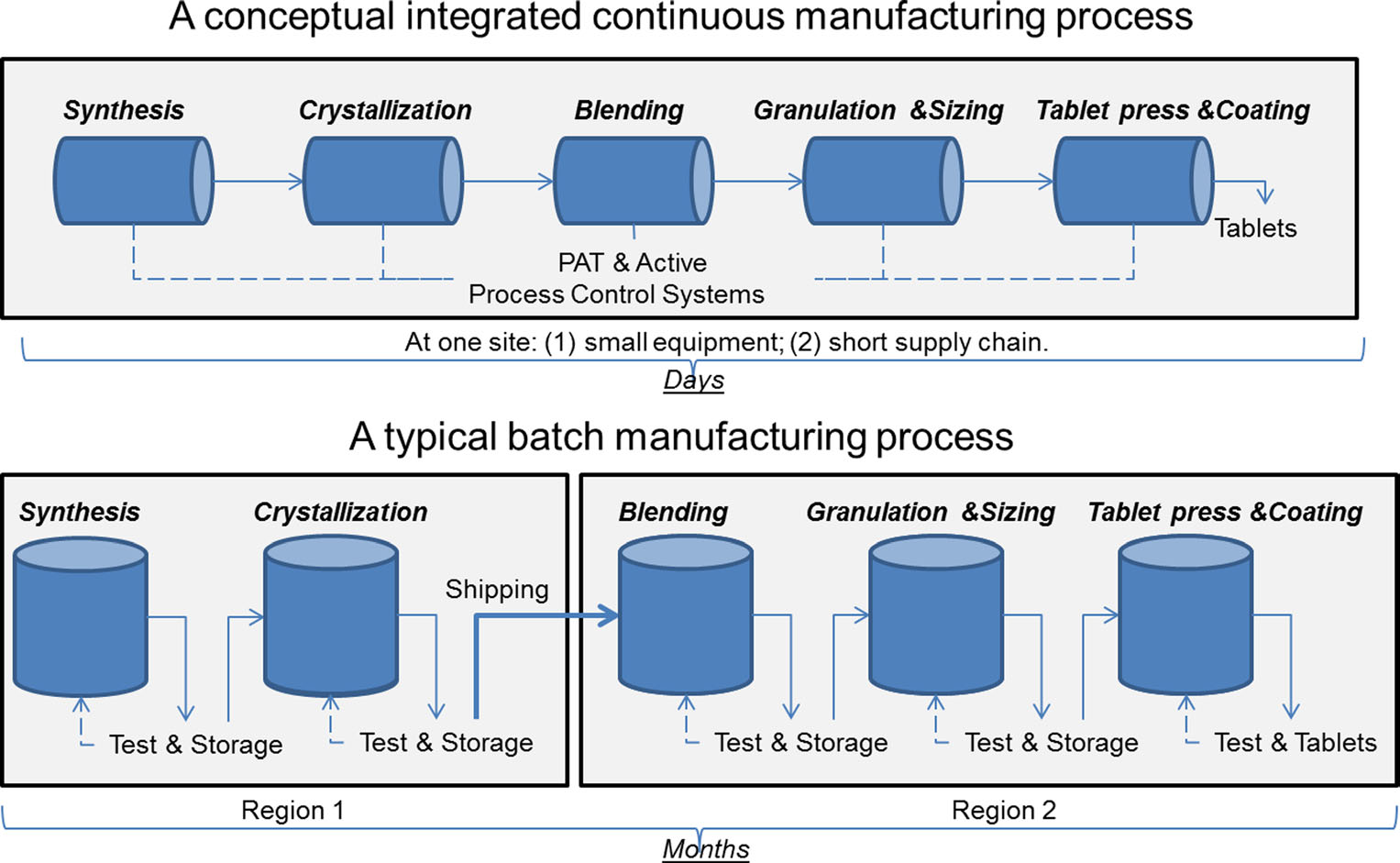 en sammenligning av kontinuerlig produksjon og batchproduksjon. Bilde gjengitt Av Sau Lee. J. Pharm Innov (2015) 10:191-199.
en sammenligning av kontinuerlig produksjon og batchproduksjon. Bilde gjengitt Av Sau Lee. J. Pharm Innov (2015) 10:191-199.i mer enn 50 år har legemidler blitt produsert ved hjelp av en metode som kalles «batchproduksjon», en flertrinns, langvarig prosess som innebærer bruk av uhyggelig, stort utstyr. Nylige fremskritt innen produksjonsteknologi har imidlertid bedt farmasøytisk industri om å vurdere å flytte bort fra batchproduksjon til en raskere og mer effektiv prosess kjent som kontinuerlig produksjon. FDA tar proaktive skritt for å lette legemiddelindustriens implementering av nye teknologier, inkludert kontinuerlig produksjon, for å forbedre produktkvaliteten og adressere mange av de underliggende årsakene til narkotikamangel og tilbakekallinger.
Batch vs kontinuerlig produksjon
Batch produksjon innebærer flere diskrete trinn. Etter hvert trinn i prosessen stopper produksjonen vanligvis, slik at prøver kan testes offline for kvalitet. Noen ganger i løpet av disse «holdtider» mellom trinnene, kan materialet lagres i containere eller sendes til andre anlegg rundt om i verden for å fullføre produksjonsprosessen. Dette kan legge uker eller måneder til behandlingstid. For noen aktive ingredienser som er følsomme for miljøet, kan det også medføre risiko for nedbrytning. I tillegg, hvis etterspørselen etter et bestemt stoff øker, kan økt produksjon kreve større utstyr. Denne oppskaleringen av utstyr krever mer fysisk plass, et større fotavtrykk og mer tid og penger.
i kontrast, legemidler som er laget ved hjelp av kontinuerlig produksjon flyttes nonstop innenfor samme anlegg, eliminere hold ganger mellom trinnene. Materialet mates gjennom et samlebånd av fullt integrerte komponenter. Denne metoden sparer tid, reduserer sannsynligheten for menneskelige feil, og kan reagere mer nimbly på markedsendringer. For å ta hensyn til høyere etterspørsel kan kontinuerlig produksjon løpe i lengre tid, noe som kan redusere sannsynligheten for narkotikamangel.
Begge typer produksjon er underlagt de samme kvalitetskontrollstandardene, men overvåking er automatisert i kontinuerlige produksjonsanlegg og har en tendens til å være hyppigere enn i batchproduksjon. Som all teknologi kan kontinuerlig produksjonsutstyr oppleve slitasje, men automatisert overvåking kan oppdage problemer lenge før en feil oppstår. Slik overvåking kan også bidra til å forutsi forventet levetid for et utstyr, noe som fører til bedre proaktivt vedlikehold.
til slutt kan kontinuerlig produksjon tillate mer fleksibel sporing og sporing, noe som vil være en fordel i tilfelle produktfeil. For eksempel, i batchproduksjon, defineres en bestemt mengde (eller batch) av et stoff av størrelsen på utstyret som produserte det. I kontinuerlig produksjon kan en mengde (eller batch) avgrenses av et tidsstempel, mengde medikament produsert eller mengden rå inngangsmateriale. Disse sporingsmetodene tillater produsenten å isolere en mindre mengde defekt materiale i tilfelle prosessfeil, noe som fører til mindre avfall og mindre sjanse for mangel.
en utfordrende, men verdig overgang
Flere næringer-som kjemisk og petrokjemisk industri – har allerede gjennomgått en produksjonsutvikling og bruker effektive kontinuerlige teknologier for å produsere produkter på en sikker måte. Men for farmasøytisk industri er overgangen til kontinuerlig produksjon fortsatt i sine tidlige stadier av flere grunner. For det første kan oppstartskostnader for en slik overgang være høy. Pensjonering av gammelt batchutstyr, kjøp av ny teknologi og opplæring av ansatte om hvordan man bruker det, og gjenoppbygging av industriinfrastruktur er dyrt, og krever en seriøs forpliktelse fra en narkotikaprodusent. Likevel har økonomiske analyser vist potensielle betydelige langsiktige besparelser. I tillegg må noen teknologier fortsatt modnes før de er kommersielt levedyktige. For visse typer stoffer, for eksempel biologiske produkter, kan teknologien for å produsere dem ved kontinuerlig produksjon ikke eksistere ennå. Forskning pågår for å løse disse og andre utfordringer. Videre oppfatter narkotikaprodusenter fortsatt regulatorisk usikkerhet som kan forsinke produktgodkjenning når en ny produksjonsteknologi brukes.
som industrien vurderer hvordan man gjør bryteren, GIR FDA ressurser og informasjon for å lette overgangen. For eksempel samarbeider byrået Med Biomedical Advanced Research And Development Authority, et program innen US Department Of Health And Human Services, for å bidra til å finansiere og støtte forskning på dette området. Vi trener også våre gjennomgangsansatte og gjennomfører intern forskning på risikoområder knyttet til kontinuerlig produksjon, slik at vi bedre kan vurdere relaterte teknologier.jeg leder et tverrfaglig team under Emerging Technology-Programmet i CDER ‘ S Office Of Pharmaceutical Quality. Programmet ble etablert for å hjelpe industrien med å implementere innovative teknologier for å forbedre produktkvaliteten og modernisere industrien, i et forsøk på å takle de underliggende årsakene til narkotikamangel eller tilbakekallinger. Det Nye Teknologiprogrammet adresserer ikke bare kontinuerlig produksjonsteknologi, men også andre fremskritt som 3D-utskrift, nye doseringsformer og nye containersystemer. Under dette programmet engasjerer vi oss med industrien tidlig i prosessen med å utvikle ny teknologi, og diskuterer eventuelle forventede regulatoriske eller vitenskapelige problemer som kan være en del av en fremtidig søknad.
Mange bedrifter har søkt På Emerging Technology Program om deres interesse for kontinuerlig produksjon. FDA-dokumentet Med TITTELEN Advancement of Emerging Technology Applications For Å Modernisere Veiledningen For Farmasøytisk Produksjon For Industrien gir informasjon og råd om hvordan man skal jobbe med byrået tidlig i utviklingsprosessen.
Les mer Om FDAS innsats for å modernisere narkotikaproduksjon i FDAS Stemmeblogg.