det første biologiske stoffet, humanisert insulin (5.8 kDa), ble tilgjengelig i 1982 etter adventen av bioteknologi, og det markerte en ny epoke i farmasøytisk industri. Moderne fremskritt innen bioteknologi tillater store synteser av biologiske på en mer eller mindre kostnadseffektiv måte. Etter å ha en gang startet med store peptider og rekombinante proteiner, biologiske i dag omfatter et bredt spekter av andre enheter, slik som antistoffer, monoklonale antistoffer, og mer nylig, nanobodies og relaterte objekter, oppløselige reseptorer, rekombinant DNA, antistoff-medikament konjugater (Adc), fusjonsproteiner, immunotherapeutics, og syntetiske vaksiner. den ‘stigende stjernen’ av biologiske legemidler har fanget økende oppmerksomhet fra farmasøytiske fagfolk og industrianalytikere, da dette alternative legemiddeloppdagelsesparadigmet representerer betydelig forretningsutfordring for mer tradisjonelt småmolekylært legemiddeloppdagelsesparadigme som definerer farmasøytisk industri i mer enn et århundre. Så spørsmålet oppstår: mister små molekyler «attraktivitet» som forskningsobjekter for narkotikaoppdagelse i den moderne verden av biologiske fremskritt? Noen eksperter forblir optimistiske om potensialet for små molekyler til å lede løpet i fremtidige farmasøytiske rørledninger, andre oppfatter at «penger skifter lommer», og små molekyler forskning vil bli stadig forsømt av aksjonærer og investorer til fordel for biologer.
for å finne ut hvor bransjen er på vei, la oss først starte med litt statistikk. OVER en periode på 7 år (2010-2017) USA Food And Drug Administration (FDA) godkjente totalt 262 nye molekylære enheter (NMEs), unntatt flere diagnostiske bildebehandlingsmidler og 1 insulinanalog (ref). Det ser ut til at 76% av dem er små molekyler (199) med bare en fjerdedel som biologiske. Interessant er det ingen tilsynelatende vekst i Biologiske NMEs godkjenninger i forhold til små molekyler, da begge kategorier av terapeutiske midler trender på en ganske lignende måte, som vist på diagrammet nedenfor. Men siden biologene er priset veldig annerledes enn små molekyler( de er langt dyrere), er bildet annerledes når man ser på total salg og omsetningsvekst: i perioden fra 2011 til 2017 har biologiske salgsinntekter vokst med 70% etter å ha nådd 232 milliarder dollar. Andelen av det totale farmasøytiske markedet som biologics holder økte fra 16% i 2006 til 25% i 2016, uten tilsynelatende tegn på å bremse ned (ref).
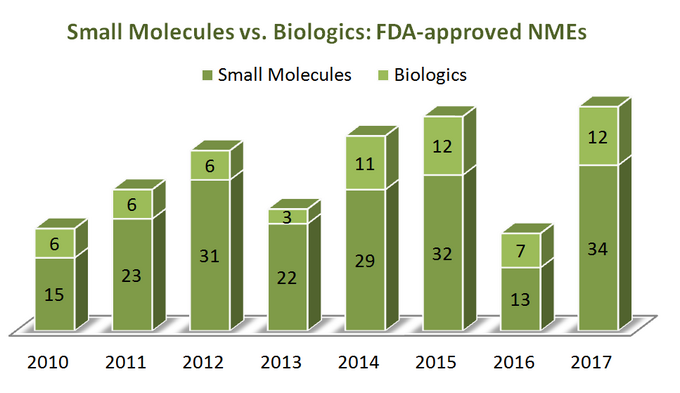
Mens det er særegne fordeler med biologiske over små molekyler på flere måter (for eksempel deres dype selektivitet), er ting ikke «svart-hvitt» når man sammenligner disse to kategoriene av terapeutiske egenskaper, da begge har betydelige fordeler og ulemper å vurdere under strategisk beslutningsprosess. Så det virker litt beklagelig å se hvor mange rapporter sidelined SMs i forhold til biologiske i jakten på «friskhet» av deres synspunkter.En tabell nedenfor oppsummerer noen sterke og svake aspekter av begge kategorier (ref, ref) som illustrerer utfordringer og muligheter som er tilgjengelige i begge «leirene» (merk farger: grå – ingen tilsynelatende fordel i ingen av leirene; grønn-fordelaktig situasjon; gul-ufordelaktig situasjon):
Små Molekyler |
|
|---|---|
|
generelle egenskaper |
|
|
lav molekylvekt (0,1 – 1 kda); vanligvis kjemisk og termisk stabil, bredt spekter av polaritet. |
Meget store molekylvekter >1 kDa; generelt polar, følsom for varme, lett nedbrytes (med unntak av noen langlivede typer som monoklonale antistoffer) |
|
Selektivitet, sikkerhet |
|
|
Heller promiskuøse, vanligvis binde til ulike off-target områder, gjengivelse bivirkninger eller toksisitet.endelig har biologiske utviklere hatt en lettere tid å skaffe patenter fordi det var lite eller ingen state-of-art i feltet, da dagens blockbusters ble oppdaget. |
Svært spesifikk for målene, generelt av lavere toksisitet (med ett stort unntak er immunogenisitet, som kan alvorlig påvirke effektivitet, sikkerhet og disponering av biologiske legemidler). |
cellepermeabilitet |
SMs bindes med mål som G-proteinkoblede reseptorer (GPCRs), ligandstyrte ionekanaler og reseptortyrosinkinaser på de ekstracellulære eller intracellulære domenene. De kan få tilgang til mål i de intracellulære områdene, cytosoler, kjerner og TIL OG MED CNS-mål, adskilt av den tette blod-hjernebarrieren (BBB). |
en stor andel av farmakologiske mål er innebygd og derfor utilgjengelige for biologiske. Spesielt når det gjelder sentralnervesystemet (CNS), er tilstedeværelsen av blod-hjernebarrieren et stort hinder på vei for molekyler større enn 600 Da som begrenser opptil 98% Av SMs og praktisk talt alle biologiske. |
Levering |
Faller I stor grad inn i «Regel av fem» for oral absorpsjon, noe som gjør den egnet for oral levering. Videre permeabilitet via tarmepitel formidles primært ved en kombinasjon av passiv diffusjon og paracellulær transport. |
Iboende ustabilitet og høymolekylære masser gjør nesten alle biologiske oralt inaktive. For det meste, invasiv levering, eller alternative ikke-invasive teknologier pågår. |
Distribusjon |
SMs distribueres via blodsirkulasjonen, noe som gjør det mulig å oppnå plukkkonsentrasjoner raskt. |
for større molekyler (f.eks. >10 kDa) blir et langsommere (100-500 ganger) lymfesystem dominerende i distribusjonsprosessen. Større biologiske legemidler distribueres via både blodet og lymfesystemene som beveger konvektiv transport, reseptormediert endocytose, fagocytose og pinocytose. Resultatet av denne situasjonen er at større biologiske legemidler har lengre halveringstid, begrensede distribusjonsvolumer, og trenger mer tid til å nå toppkonsentrasjoner, sammenlignet Med SMs. |
Disposisjon (metabolisme) |
De Fleste SMs avhendes av ikke-målrettede organer-via cytokrom eller ikke-cytokrom metabolisms, renal filtrering, eller fekal utskillelse. |
Biologics har strammere interaksjoner med mål, slik at deres disposisjoner er direkte påvirket av deres binding (reseptor-mediert narkotika disposisjon), inkludert klaringer av biologiske av proteaser og peptidase. |
legemiddelinteraksjoner |
SMs Er utsatt for legemiddelinteraksjoner som kan oppstå på grunn av samtidig bruk av legemidler som påvirker deres transport -, metabolisme–, transport-eller eliminasjonsveier.. |
Biologiske legemidler er mindre utsatt for tradisjonelle legemiddelinteraksjoner siden de gjennomgår metabolisme og eliminering som endogene substrater. Det er imidlertid dokumentert cytokinmedierte endringer i legemiddelmetaboliserende enzymer, derfor må legemiddelbiologiske interaksjoner vurderes i tilfelle stoffet kan påvirke uttrykket av metabolske enzymer. |
Forretningsaspekter |
Lave priser PÅ SM-legemidler. |
vanligvis svært høye priser for biologiske behandlinger. Dette regnes som en av grunnene til at biologiske legemidler ser ut til å levere bedre samlet økonomisk avkastning, sammenlignet Med SMs. |
Høy grad av slitasje (2009 studie AV KMR Group viste at bare 7,1% Av SMs inn preklinisk testing til slutt nådde markedet). |
Relativt lav utmattelsesgrad (samme KMR-Gruppestudie viste at 24,4% av preklinisk stadium biologics overlevde opp til markedsstadiet). |
|
Severe competition from chemical generics after patents expiration. |
Biologics developers face less severe competition from biosimilars, after patents expiration. |
|
Simpler drug discovery/development process. |
More expensive and complex drug discovery and development process, compared to biologics. |
Med tanke på sammenligningen ovenfor blir det åpenbart at biologiske legemidler ikke er en «magisk kule», og industrien vil ikke bli dominert av biologiske legemidler i overskuelig fremtid, snarere vil en konkurransedyktig likevekt opprettholdes mellom små molekyler, biologiske og hybride former for terapi, som Adc-er-med lokal dominans av hver form i mer egnede terapeutiske områder, brukstilfeller etc.
videre er nedenfor en liste over flere industridrivere som spiller på siden av små molekyler og kan påvirke maktbalansen i det totale farmasøytiske markedet til fordel for kjemiske utgangspunkt:
stigningen av kunstig intelligens (AI) i narkotikaoppdagelse
Etter gjennombrudd i deep learning algorithms (2012) Og nylig, opprettelse av generative adversarial networks (GANs), som er i stand til å utmerke seg i en rekke forskningsoppgaver, har interessen for ULIKE AI-teknologier skyrocketed i ganske mye tid.hver industri. MANGE AI-drevne verktøy har raskt blitt kommersielle mainstream, som chatbots, personlige assistenter, autopiloter etc.– som er en reell bevis på begrepet AI gjennomførbarhet. Drug discovery er ikke et unntak fra denne «AI-drevne trenden», og antall oppstart som prøver Å bruke AI for å øke narkotikaoppdagelsen på forskjellige måter, har vokst betydelig over bare flere år, etter å ha nådd over hundre aktive selskaper til dags dato (her er en liste over noen av dem).Interessant nok er flertallet AV AI-drevne oppstart fokusert på små molekyler narkotikaoppdagelse, i stedet for biologiske, noe som sannsynligvis ikke er overraskende. Historisk ble selv ikke-AI beregningsmetoder (kjeminformatikk) primært brukt til småmolekyleterapeutikk på grunn av deres vesentlig enklere molekylære strukturer og interaksjonsmønstre.diagrammet nedenfor viser en estimert statistikk for 61 aktivt markedsførte oppstart av legemiddeloppdagelser som utvikler eller bruker spesialiserte AI-verktøy i sin forskningsarbeidsflyt. Som du kan se, er halvparten av alle selskapene (51%, 31 oppstart) fokusert på små molekyler, mens bare 23% (14 oppstart) er involvert i å oppdage/utvikle biologiske legemidler (antistoffer, vaksiner etc). Disproportionen mot små molekyler er også godt illustrert av mengden vc-finansiering samlet opp av 61 gjennomgåtte AI-drevne oppstart ( kun offentliggjorte runder) – hvor 770 millioner ble investert i de selskapene som var involvert i små molekyler, og bare litt mer enn 200 millioner ble tildelt for biologikkfokuserte oppstart-som vist nedenfor.
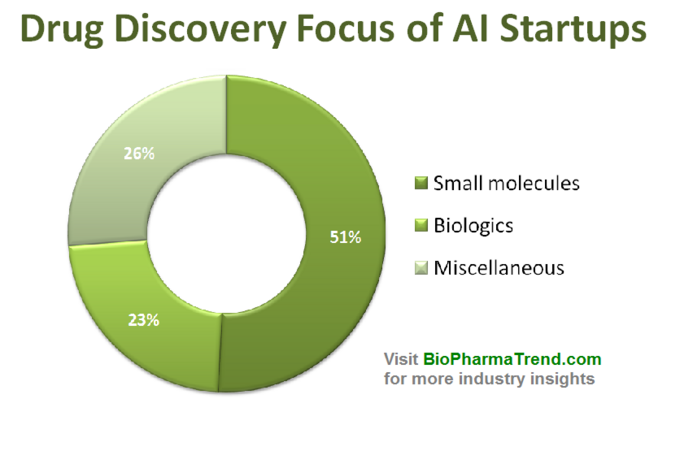
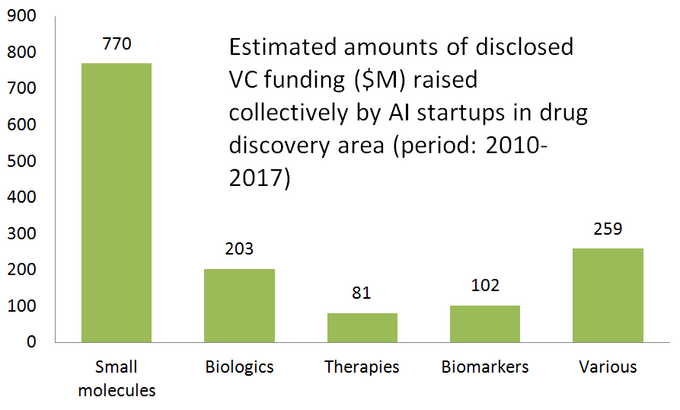
Denne situasjonen antyder at nylige fremskritt I ai-algoritmer og en trend for å anvende maskinlæring for farmasøytisk forskning på tidlig stadium har en tendens til å drive mer vekst i småmolekylmedisinfunn, sammenlignet med biologiske funn-i hvert fall for nå. Dette kan føre til flere fremtidige investeringer i små molekylfokuserte prosjekter støttet av AI-drevne teknologier.
Å nå» undruggable » mål
slike viktige mål som for eksempel protein-protein interaksjoner (Ppi), domineres tradisjonelt av biologiske (mAbs) som potensielle aktører, mens små molekyler lenge hadde vært ansett som uegnet i dette tilfellet på grunn av deres lille størrelse.
med fremskritt i farmakogenomikk, kan denne situasjonen endres ganske raskt etter godkjennelsene maraviroc (514 Da) og tirofiban (441 Da). Det ble avslørt beregningsmessig At SMs faktisk kan ha relativt høye slektskap til spesifikke grensesnitt av proteiner, og viktigere, de kan modulere de ‘iboende uordnede proteinregioner’ knyttet til et sett med komplekse systemsykdommer. Her er en interessant dekke opp av dette emnet oppsummerer noen av de viktige innsikt I PPI maskiner oppnådd de siste tiårene. Et annet raskt voksende område for små molekylære legemiddelfunn er rettet mot ribonukleinsyre (RNA). Dette emnet ble oppført i «Topp 7 Trender I Farmasøytisk Forskning i 2018», og det var også en detaljert gjennomgang av emnet I Celle Kjemisk Biologi og en fin industri dekke Opp I C&EN.
En annen ny ide om å frigjøre kraften til små molekyler ble diskutert i en nylig artikkel «Målrettet protein degraders omdefinerer hvordan små molekyler ser ut og handler»publisert I C&EN i 2018. Strategien her er å utvikle bifunksjonelle små molekyler som er i stand til å rute et målrettet protein helt til proteasom, cellens søppelfjerningsmaskin, i stedet for bare å hemme proteinets handling som i en ‘tradisjonell’ tilnærming.
Overvinne begrensninger av screeningteknologier
mye forskningspotensial for små molekyler har ennå ikke blitt realisert på grunn av ulike teknologiske begrensninger av screeningmetoder som brukes til å identifisere utgangspunkt i narkotikaoppdagelsesprogrammer.et slikt eksempel er fenotypisk screening-tilnærming, som opplever renessanse i dag på grunn av flere teknologiske fremskritt, inkludert den økende evnen til å utvikle fysiologisk relevante cellemodeller, avlesninger og sofistikerte deteksjonsteknologier som bidrar til å avsløre virkningsmekanismer (MoA) mer effektivt, minimere usikkerhet. På den annen side gir implementeringen av storskala profileringsteknikker og beregningsmetoder et nytt nivå av systemanalyse og forståelse av småmolekylære fenotyper. Et annet lovende screeningsparadigme er VIA BRUK AV DNA-kodede biblioteker (DELs). PÅ grunn AV SIN unike ordning, GIR DEL-teknologi en passende måte å teste hundrevis av millioner og til og med milliarder av nye molekyler i målbaserte legemiddeloppdagingsprogrammer. Selv om denne teknologien ikke er uten utfordringer (f. eks. begrensninger AV DNA-kompatibel kjemi, usikkerhet med screening treff, etc), vokser området raskt og regnes til og med som ‘revolusjonerende’ for små molekyl narkotikaoppdagelse.
Overvinne synthesizability barrier
En av de snubler steiner av tidlig stadium små molekyl drug discovery er en begrensning av syntetisk tilgjengelig kjemisk plass-mens mange lovende kjemiske ideer kan genereres beregningsmessig, eller på annen måte, er det alltid en risiko for at syntetisere hele settet av forbindelser for å validere slike ideer ville være kostbart, eller til og med unfeasible.Nylige fremskritt På dette området har blitt gjort igjen, ved HJELP AV AI-basert programvare som tilbyr synteseplanlegging på menneskelig nivå. For Eksempel publiserte BenevolentAI nylig Et papir I Nature, som beskriver hvordan de brukte dype nevrale nettverk i kombinasjon med moderne tre søkealgoritmer for å planlegge syntesen av nye molekyler med bemerkelsesverdig suksessrate og hastighet.Flere interessante cover ups med rike kommentarer ble publisert her og her Av Derek Lowe gir litt mer innsikt i dette fascinerende området av organisk og medisinsk kjemi.En mer empirisk strategi ble utviklet av en kjemisk produsent Enamine, som er KJENT SOM EKTE Kjemisk Rom, og inkluderer for tiden over 3.8 milliarder syntetisk tilgjengelige og søkbare molekyler for hit leting og andre medisinske kjemi oppgaver. Konseptet koker ned til å bruke et sett med interne validerte kjemiske ruter (over 100 reaksjoner) til et stort basseng av kjemiske byggeklosser tilgjengelig i eget lager (over 100 tusen forbindelser)-med sikte på å kombinere dem på kombinatorisk måte for å produsere en kaskade av større «blylignende» eller «stofflignende» molekyler. Når en viss grad av reproduserbarhet og utbytte er oppnådd i et stort nok sett med eksperimenter (minst 80%), finner en ytterligere beregningsopptelling sted for å bygge opp et bredere kjemisk rom basert på de eksperimentelt validerte tilfellene.
Ny R&d markeder og roller for små molekyler
Alt i alt kan man overse eller misforstå størrelsen og vekstpotensialet til små molekyler rørledninger, som ble nevnt under en paneldiskusjon På Interphex. For tiden er rundt 8000 små molekyler aktive i R & D, en 25% vekst de siste par årene. De ovennevnte vekstdrivere kan føre til en ytterligere akselerert vekst i denne sektoren.Det er også viktig å merke seg at de små molekylmedisinene kan spille en viktig rolle i noen neste generasjons medisiner, noe som gjør dem avhengige av små molekylrørledninger. For eksempel, når det gjelder stamcelleterapi, kan små molekyler utløse terapeutiske reaksjoner.Som Det ble fremhevet Under Cphi Nord-Amerika Av Milliporesigmas Jeffrey Shumway, har små molekylprodukter en tendens til å bli mer komplekse, og endrer sin rolle i (bio)farmasøytisk industri.Endelig er det fremtidige området for små molekyler antistoff-stoffkonjugater og relaterte objekter, som dukket opp som en lovende klasse av terapi på grunn av naturlig konvergens av to stoffoppdagelsesparadigmer og flere teknologiske trender. Ansvarsfraskrivelse: informasjonen er kun for generell bevissthet, og er ikke en juridisk / finansiell/aksjehandel / medisinsk råd av noe slag. Du leser det på egen vilje, og all bruk av denne informasjonen er på egen risiko. Det er ditt ansvar å vurdere nytten og sikkerheten av informasjonen i dette innlegget, Og Internett generelt, og hvordan det gjelder din egen situasjon og deretter konsultere relevante eksperter for faglig råd om nødvendig.
Emner: Industri Trender