Er zijn experimentele methoden voor de detectie van ongepaarde elektronen. Een van de kenmerken van ongepaarde elektronen in materialen is interactie met een magnetisch veld. Die interactie kan worden gebruikt om informatie te verstrekken over samenstellingen die ongepaarde elektronen bevatten.
Elektronparamagnetische resonantie
Elektronparamagnetische resonantie (EPR) of elektronspinresonantie (ESR) is een spectroscopische methode. Het hangt af van de energetische scheiding van twee draaistoestanden die alleen bestaat in de aanwezigheid van een magnetisch veld.
EPR is zeer nauw verwant aan een ander veel voorkomend type spinresonantiespectroscopie, NMR.
Spin is een kwantumeigenschap die geen echte analogie heeft die voor ons op macroscopisch niveau zinvol zou zijn. Echter, we weten dat spin heeft geassocieerd met het magnetische eigenschappen. Een elektron kan een van de twee waarden hebben voor deze magnetische eigenschappen. Er zijn verschillende labels gegeven aan deze waarden: soms “omhoog” en “omlaag”, soms, +1/2 en -1/2. Echter, welke waarde van spin een elektron bezit maakt geen verschil energetisch.
de twee mogelijke spintoestanden zijn hetzelfde energetisch — tenzij er een magnetisch veld aanwezig is. Zodra die situatie zich voordoet, is er een energetische scheiding tussen de twee staten.
In aanwezigheid van een magnetisch veld scheiden de twee draaistoestanden zich in twee verschillende energieniveaus. De hoeveelheid scheiding tussen de energieniveaus hangt af van de grootte van het magnetisch veld. Hoe sterker het magnetisch veld, hoe groter de scheiding.
dit geval is alleen waar voor ongepaarde spins. Vergeet niet, ongepaarde spins interageren met een magnetisch veld. Als alles spin-paired is, gebeurt er niets. Dat is erg handig, want het geeft ons een manier om die ongepaarde elektronen te detecteren.
een elektron in de ene spintoestand kan nog steeds naar de andere worden opgewekt door de absorptie van een foton. Als alternatief kan een elektron in de hogere staat naar beneden vallen als het een foton afgeeft.
om dit te laten gebeuren, moet de energie van het foton exact overeenkomen met het energieverschil tussen toestanden. Deze Goudlokje regel wordt de resonantie conditie genoemd. De hoeveelheid energie die wordt geleverd om van het ene energieniveau naar het volgende te springen, moet precies goed zijn. Te weinig energie en het elektron haalt het niet. Te veel energie en het elektron zal het ook niet halen. Het wacht op het juiste foton.
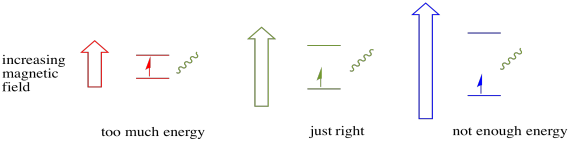
hoeveel energie heeft een foton? Denk aan je Planck-Einstein relatie. Het beschrijft de energie van een foton:
\(E=h \nu \)
E is de energie van het foton, h is Planck ‘ s constante (6.625 x 10-34 Js) en ν is de frequentie van het foton (het lijkt op een Romeinse vee, maar het is de Griekse letter nu).
alternatief, vanwege de relatie tussen golflengte en frequentie:
\(E= \frac{hc}{\lambda}\)
de nieuwe grootheden zijn c, de lichtsnelheid (3,0 x 108 m s-1) en λ, de golflengte van het foton.
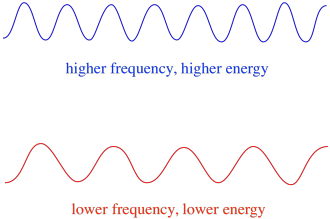
in het algemeen leveren verschillende golflengten van licht verschillende hoeveelheden energie op. Blauw licht, met een golflengte dicht bij 475 nm, heeft meer energie dan rood licht, met een golflengte dicht bij 700 nm.
in EPR is het algemene bereik van elektromagnetische straling, of het algemene soort foton, microgolfstraling. De frequentie van deze fotonen is ongeveer 9 of 10 GHz. (Een ander type van spectroscopie, rotatiespectroscopie, meet ook de absorptie van microgolven. Het gebruikt meestal iets hogere frequenties van microgolven. Rotatiespectroscopie geeft structurele of bindende informatie over moleculen in de gasfase.)
afhankelijk van de omgeving van het ongepaarde elektron kan het vatbaarder of minder gevoelig zijn voor de invloed van het uitwendige magnetische veld. Dat betekent dat de energie splitsing tussen de twee spin Staten zal variëren van de ene molecule naar de andere. Als gevolg hiervan zouden verschillende moleculen in hetzelfde magnetische veld verschillende golflengten van microgolfstraling absorberen.
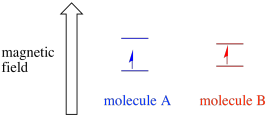
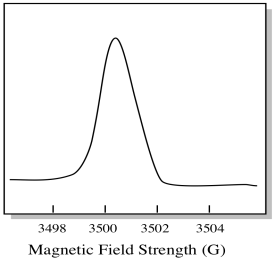
Gewoonlijk is een EPR-spectrometer zo ontworpen dat deze een vaste golflengte van microgolfstraling aan het monster levert. Het magnetisch veld wordt aangepast en het instrument meet welke veldsterkte nodig was voor de absorptie van de fotonen. Een EPR-spectrum toont absorptie als functie van magnetische veldsterkte.
Er is iets anders over hoe EPR spectra gewoonlijk worden weergegeven. Het wordt weergegeven als een afgeleide van de plot hierboven weergegeven. Dat komt door de manier waarop het instrument de verandering in absorptie meet als het het magnetische veld verandert; dat wil zeggen het meet d(absorptie)/d(magnetisch veld). Dat is de helling van de vorige plot.
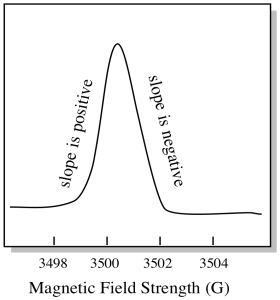
hierdoor ziet een EPR-spectrum er echt meer als dit uit. Het gedeelte boven de basislijn geeft de positieve helling van het vorige perceel weer. Het deel onder de basislijn geeft de negatieve helling in het vorige perceel weer.

De magnetische veldsterkte is doorgaans niet de waarde die wordt gerapporteerd voor de piekpositie. In plaats daarvan wordt iets genaamd de G-waarde gerapporteerd. De G-waarde komt voort uit de vergelijking voor het Zeeman-effect (het effect van het magnetisch veld op de splitsing tussen spin-energieniveaus). Die relatie is:
\(\Delta E = g \beta B\)
waarin ΔE het energieverschil is tussen spintoestanden, g is de G-waarde, een proportionaliteitsconstante die afhangt van hoe gevoelig het elektron is voor de invloed van het magnetische veld, β is de Bohr magneton (9.274 x 10-24 J T-1) en B is het toegepaste magnetische veld.
dat betekent dat, Voor fotonabsorptie,
\(h \nu = g \ beta B\)
en dus
\(g = \frac{ H \nu}{\beta B}\)
onthoud dat h en β slechts constanten zijn. Dat betekent dat g Een maat is voor de verhouding van het geabsorbeerde foton tot het gebruikte magnetische veld. Het is een standaardisatie stap. Als mensen instrumenten hebben die gebruik maken van iets verschillende golflengten van microgolfstraling, dan zijn de magnetische velden die ze meten voor dezelfde monsters niet eens. Als iedereen de verhouding van Golflengte tot veldsterkte meet, zou alles gelijk moeten zijn. De G-waarde is een reproduceerbare maat voor de omgeving van een elektron die van het ene laboratorium tot het andere gelijk moet zijn.
een soortgelijke praktijk wordt gebruikt in NMR-spectroscopie, om soortgelijke redenen. Wanneer we een chemische verschuiving in ppm in plaats van Hz melden, corrigeren we voor de sterkte van het magnetische veld in het instrument dat we gebruiken. Anders zou dezelfde steekproef twee verschillende diensten op twee verschillende instrumenten opleveren.
koppeling in EPR
koppeling is een fenomeen waarbij magnetische velden met elkaar interageren. In EPR, komt de koppeling over wegens de invloed van Nabijgelegen kernen op het elektron dat wordt waargenomen.
u weet bijvoorbeeld al dat de kern van een waterstofatoom een ongepaarde spin heeft. Dat is de basis van 1h NMR spectroscopie. Als die kern een ongepaarde spin heeft, heeft hij een geassocieerd magnetisch veld. Omdat de waterstofkern ofwel een spinwaarde kan hebben, +1/2 of -1 / 2, dan heeft het twee mogelijke magnetische velden die ermee verbonden zijn.
een nabij gelegen elektron, geplaatst in een extern magnetisch veld, kan zich nu in twee verschillende situaties bevinden. Of het naburige proton voegt een beetje toe aan het magnetisch veld, of het trekt een beetje af van het externe veld.
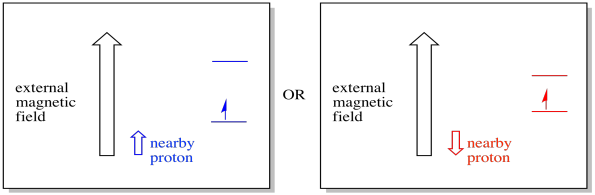
hierdoor kan het elektron twee verschillende velden ervaren. Vergeet niet, we hebben niet te maken met een enkel molecuul in de spectroscopie. We hebben te maken met enorme aantallen moleculen. Sommige moleculen zullen zich in één situatie bevinden. Sommige moleculen zullen zich in de andere situatie bevinden. We zullen beide situaties zien. Er zal absorptie zijn bij twee verschillende magnetische veldsterktes.

als gevolg hiervan toont het EPR-spectrum twee pieken, zoals deze:
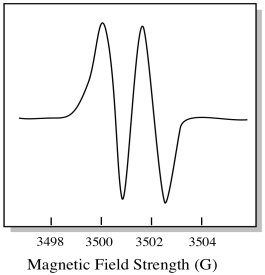
Dit type piek in het spectrum wordt een doublet genoemd vanwege de dubbele absorptie. Dit kenmerk van een EPR-piek wordt de veelheid ervan genoemd. In hoeveel lijnen is de piek gesplitst? Twee. Het is een doublet.
dingen zijn nog interessanter als er twee protonen in de buurt zijn. In dat geval hebben beide naburige protonen spin. Ofwel spin kan waarde + 1/2 of -1 / 2 hebben. Misschien zijn ze allebei + 1/2. Misschien zijn ze allebei -1 / 2. Misschien is er één van elk. Deze drie mogelijke combinaties zullen drie verschillende effecten hebben op het magnetische veld dat door het elektron wordt ervaren.
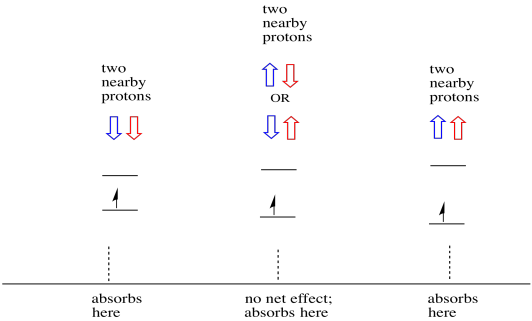
hierdoor zijn er drie pieken in het spectrum. Het spectrum wordt een triplet genoemd. Dit drieluik is hieronder afgebeeld, onder het diagram dat de spincombinaties van de naburige waterstofatomen illustreert.
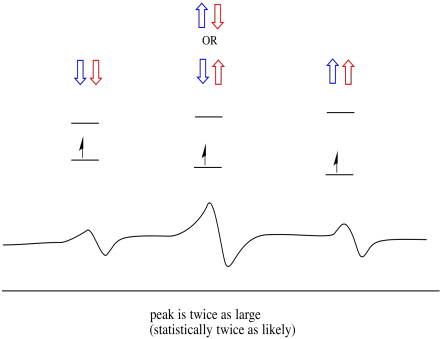
merk op dat, omdat waterstof in de gemengde combinatie omhoog of omlaag kan zijn, er twee manieren zijn om tot die middentoestand te komen. Die combinatie is twee keer zo waarschijnlijk als de andere twee, want er is maar één manier om die combinatie te krijgen: beide waterstofatomen draaien, in één geval. Beide waterstofatomen zitten in de andere. Hierdoor is de middelste piek in een triplet twee keer zo groot als de pieken aan de randen.
oefening \(\Paginindex{1}\)
laat zien dat, met drie aangrenzende waterstofatomen, een kwartet zou resulteren, waarin de verhoudingen van de pieken 1:3:3:1 zijn.
antwoord
de combinaties zijn:
a) alle spins, en er is maar één manier om dat te doen)
b) twee van de spins zijn gedaald, maar is (en elk van de drie protonen kon worden, dus er zijn drie manieren om dat te doen)
c) twee van de spins zijn, maar één is, en elk van de drie protonen kunnen worden vastgesteld, er zijn dus drie manieren om dat te doen)
d) alle spins (en er is slechts één manier om dat te doen).
het resultaat is een kwartet van 1:3:3:1.
Oefening \(\Pagina{2}\)
het Voorspellen van de veelheid in de EPR-spectrum voor elk van de volgende alkoxy radicalen (merk op dat zuurstof en koolstof hebben geen ongepaarde spins, gaan uit van hetzelfde geldt voor X):
a) X3C-O. b) X2CH-O. c) XCH2-O. d) CH3-O.
Antwoord a)
a) singlet
Antwoord b)
b) doublet
Antwoord c)
c) triplet
Antwoord d)
d) voor het kwartet
Oefening \(\Pagina{3}\)
Stel benzeen werden verlaagd door een elektron te verkrijgen van de benzeen-anion radicaal. Wat zou de veelheid in het EPR-spectrum zijn?
antwoord
een septet (in a 1:3:5:7:5:3:1 verhouding).
koppeling aan metaalionen
veel andere kernen dan waterstof hebben een netto spin. Als het ongepaarde elektron toevallig op een metaal wordt gevonden, kan het EPR-spectrum bevestiging van die structurele informatie verstrekken. Deze bevestiging kan van zowel de magnetische veldinformatie (gelijkend op chemische verschuiving in NMR) als van de veelheid komen.
nucleaire spins van geselecteerde metalen worden hieronder weergegeven.
| Metalen | Spin |
| V | 7/2 |
| Mn | 5/2 |
| – Fe | 0 |
| Co | 7/2 |
| Cu | 3/2 |
In elk van deze metalen, de kern heeft verschillende mogelijke magnetische velden. Merk op dat hun effecten iets ingewikkelder zijn dan die van een waterstofatoom. Bijvoorbeeld, koper, met spin 3/2, werkt een beetje als drie verschillende waterstofkernen (elk met spin + / – 1/2) in termen van zijn effect op een nabijgelegen electrom ‘ s EPR spectrum. De veelheid van een ongepaarde elektron op een koper-ion moet behoorlijk onderscheidend zijn.
oefening \(\Paginindex{4}\)
voorspel de multipliciteit van een piek in het EPR-spectrum voor een ongepaard elektron op elk van de volgende metalen:
a) vanadium b) mangaan c) ijzer d) kobalt E) koper
Antwoord A)
A) een octet (in a 1:3:5:7:7:5:3:1 ratio)
antwoord b)
b) een sextet (in a 1:3:5:5: 3:1 verhouding)
antwoord c)
c) een singlet
antwoord d)
d) een octet
antwoord e)
e) een kwartet (in een verhouding van 1:3:3:1)
soms zijn dingen ingewikkelder, omdat verschillende isotopen van hetzelfde element verschillende spinwaarden kunnen hebben. In feite is dat waar voor waterstof en koolstof, maar de grote meerderheid van waterstof wordt gevonden Als 1H, dus in het algemeen kunnen we denken aan het hebben van spin = 1/2; de grote meerderheid van koolstof is 12C, met spin = 0.
de natuurlijke isotopen van ijzer en hun kernspin worden in onderstaande tabel weergegeven.
| Isotope | Spin | % Abundance |
| 54Fe | 0 | 5.9 |
| 56Fe | 0 | 91.8 |
| 57Fe | 1/2 | 2.1 |
| 58Fe | 0 | 0.2 |
The EPR spectrum of an unpaired electron on iron may be slightly more complicated than we first thought. Binnen het monster zouden sommige elektronen zich op ijzerionen bevinden met spin = 1/2, hoewel de meeste dat niet zouden doen. Deze complicatie kan genoeg zijn om een lichte variatie in het uiterlijk van het spectrum te introduceren, maar over het algemeen zou het nog steeds vrij veel op een singlet lijken.
echter, in veel gevallen worden dingen veel complexer. Molybdeen is een goed voorbeeld.
| isotoop | Spin | % abundantie | 92Mo | 0 | 14.8 |
| 94Mo | 0 | 9.3 |
| 95Mo | 5/2 | 15.9 |
| 96Mo | 0 | 16.7 |
| 97Mo | 5/2 | 9.6 |
| 98Mo | 0 | 24.1 |
| 100Mo | 0 |
Er zijn zeven natuurlijk voorkomende isotopen van molybdeen. Vijf daarvan hebben spin = 0, dus een ongepaarde elektron op die isotopen zou leiden tot een eenvoudig singlet in het EPR-spectrum. De andere twee isotopen, die 25% van het totaal uitmaken, hebben spin = 5/2. De meeste ongepaarde elektronen op molybdeen zou verschijnen als een singlet. Echter, een significante fractie zou verschijnen als een sextet. Dat betekent dat, in een ideaal geval, een ongepaarde elektron op molybdeen zou leiden tot een singlet met een sextet bovenop het (ongeveer een kwart zo sterk als het singlet).
deze situatie kan er ongeveer uitzien als de tekening hieronder.
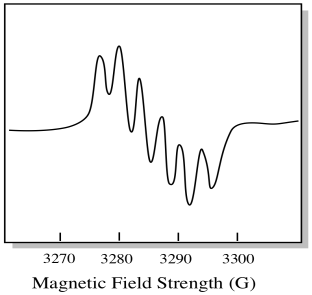
in werkelijkheid zijn EPR-spectra in veel gevallen enorm gecompliceerd. Ze zien er vaak uit als fuzzy blobs. Er zijn zoveel dingen gekoppeld aan zoveel andere dingen dat het bijna onmogelijk wordt om te ontcijferen met het oog. In de meeste gevallen worden computersimulaties uitgevoerd en worden de experimentele gegevens vergeleken met de computersimulaties om structureel inzicht te verkrijgen.
oefening \(\Paginindex{5}\)
Vanadium is aanwezig in sommige nitrogenasen en daarom is er belangstelling geweest voor modelcomplexen (bijv. Sandro Gambarotta et al, J. Am. Scheikunde. Soc. 1994, 116, 6927-6928). Gambarotta gebruikte de volgende synthese, in THF-oplosmiddel:
\(\ce{VCl3 + K – > 3V (THF)}\)
- teken de structuur van het product van de reactie.
- teken een D orbitaal splitsingsdiagram voor dit complex.
- voor deze verbinding werd een EPR-spectrum geregistreerd. Schets het spectrum, gezien het feit dat vanadium nucleaire spin I = 7/2 heeft.
- schatting µeff voor deze verbinding.
de verbinding reageert met N2 en vormt een N2-overbrugd dimeer.
e) Teken de structuur van dit product.
f) deze verbinding produceert geen EPR-spectrum. Zorg voor een resonantiestructuur van (e) die deze waarneming verklaart.
antwoord
EPR spectra werd geleverd met dank aan Virtual Imagination / Slapdash Chemistry Creations.
Attribution
Chris P Schaller, Ph. D., (College Of Saint Benedict / Saint John ‘ s University)