- introductie
- materialen en methoden
- Instrumentele analyse
- microbiële culturen
- Mediumpreparaat
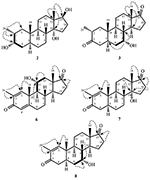
- 2α-Methyl-3α, 14α, 17β-trihydroxy-5α-androstane (2)
- 2α-Methyl-7α-hydroxy-5α-androstan-3,17-dion (3)
- 2α-Methyl-3α,17β-dihydroxy-5α-androstane (4)
- 2-Methylandrosta-1,4-diene-3,17-dione (5)
- 2-Methylandrosta-11α-hydroxy-1,4-diene-3,17-dione (6)
- 2-Methylandrosta-14α-hydroxy-1,4-diene-3,17-dione (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- Resultaten en Discussie
- Structuur Opheldering
- cytotoxiciteit tegen Hela -, PC3 -, H640-en HCT116-kanker, en 3T3 normale cellijnen
- structuur-Activiteitsrelatie
- conclusie
- Auteursbijdragen
- belangenconflict verklaring
- erkenningen
- Supplementary Material
introductie
microbiële transformatie is een van de belangrijkste benaderingen voor de structurele transformatie van verschillende klassen organische verbindingen. Deze techniek is met succes toegepast in groene chemie, d.w.z. de programma ‘ s van de drugontdekking en ontwikkeling, die een uitstekende bron van samenstellingen rond kernstructuren verstrekken, door onderzoek voor diverse biologische activiteiten wordt gevolgd. In verschillende gevallen, microbiële transformatie is gebruikt als een belangrijk instrument voor de regio -, chemo -, en stereo-selectieve conversies van organische verbindingen die moeilijk te bereiken zijn met conventionele methoden (Holland en Weber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmanska et al., 2005; Borges et al., 2009; Choudhary et al., 2011; Ravindran et al., 2012). Vanwege de inactieve aard van koolwaterstof skelet van steroïden, zijn ze vaak moeilijk te worden afgeleid door conventionele synthetische methoden. Daarom wordt de microbiële transformatie vaak gebruikt voor de structurele wijziging van steroïden. De aanwezigheid van P450 cytochroom enzymsystemen in schimmels maakt biokatalyse van hele cellen een efficiënt instrument voor stereo – en regiospecifieke hydroxylatie (Choudhary et al., 2005a; Tong and Dong, 2009; Kristan and RiŽner, 2012; Baydoun et al., 2014).
Drostanolone en zijn esters derivaten, zoals drostanolon propionaat, drostanolon pentanoaat, en drostanolon enanthate (1) zijn anabole-androgene steroïden (AASs) gebruikt door atleten om hun spieren te versterken zonder vet te winnen. Bovendien hebben drostanolone, en zijn esters derivaten de capaciteit om de productie van oestrogeen te remmen. De propionaatester van drostanolone wordt ook gebruikt voor de behandeling van borstkanker, onder de merknaam van Masteron (Chowdhury et al., 1976; Clavel et al., 1982; Marinov et al., 1986; Vardar et al., 2002; Bahrke and Yesalis, 2004).
kanker wordt momenteel erkend als een belangrijke uitdaging voor de volksgezondheid. Kanker is de tweede belangrijkste doodsoorzaak in de Verenigde Staten, en over de hele wereld. Volgens de Wereldgezondheidsorganisatie (WHO) is de prevalentie van kanker meer dan 6 miljoen gevallen per jaar. Kankercellen hebben een hoge proliferatiegraad. Ze verspreiden zich snel in het levende systeem en kunnen overleven tegen sterke chemotherapeutica en DNA-schadelijke stoffen. Op dezelfde manier hebben cytotoxische drugs vele nadelige gevolgen voor normale cellen, en zo is hun gebruik in kankerchemotherapie een therapeutische uitdaging. Hierdoor is de ontwikkeling van veilige, effectieve en selectieve chemotherapeutische middelen dringend nodig tegen verschillende vormen van kanker (Munoz-Pinedo et al., 2012; Su et al., 2015; Swadogo et al., 2015; Rebecca et al., 2016).
borstkanker is een van de meest voorkomende vormen van kanker in 140 landen van de wereld. Het is een belangrijke oorzaak van kankergerelateerde dood bij vrouwen over de hele wereld, gekenmerkt door de abnormale groei van cellen in de borstklieren of kanalen met een hoge proliferatiegraad (Hanahan en Weinberg, 2000; Ferlay et al., 2015).
baarmoederhalskanker is de op één na meest voorkomende kanker bij vrouwen over de hele wereld, na borstkanker. De belangrijkste oorzaak van baarmoederhalskanker is de vorming van kwaadaardige cellen in weefsels van de baarmoederhals (Wang et al., 2013; Hafiza and Latifah, 2014; Pariente et al., 2016). De Hela kankercellijn, verkregen uit humane baarmoederhalskanker cellen, is een gemeenschappelijk cellulair model om het cytotoxische potentieel van testverbindingen te evalueren.
prostaatkanker is de op een na belangrijkste kanker bij mannen wereldwijd na de bronchus kanker, en de derde meest voorkomende oorzaak van kankerdood. Het is de meest voorkomende reden van maligniteit bij mannen. De incidentie neemt toe met de leeftijd, vaker dan de leeftijd van 50 jaar (Henry en omahony, 1999; De-Bono et al., 2010; Wenbin et al., 2015). De PC – 3 kankercellijn, verkregen uit mannelijke prostaatkankercellen, is een veel gebruikt model om de toxiciteit van testsamenstellingen te onderzoeken.longkanker is een zeer voorkomende vorm van kanker bij mannen in de Verenigde Staten sinds het midden van de jaren vijftig en bij vrouwen, sinds het einde van de jaren tachtig. Longkanker wordt meestal toegeschreven aan roken (Travis et al., 2002; Villanti et al., 2013; Mishra et al., 2016). De h460 kankercellijn, verkregen uit menselijke longkankercellen (lymfogene metastatische subline van humaan grootcellig longcarcinoom), wordt vaak gebruikt om de cytotoxiciteit van testverbindingen te evalueren.
na borst -, long-en prostaatkanker is darmkanker de vierde meest voorkomende kanker wereldwijd. Het is de kanker gevonden in ongeveer gelijke frequentie bij mannen en vrouwen. Het is de tweede meest voorkomende oorzaak van kankergerelateerde sterfgevallen in westerse landen (Levin et al., 2008; Andre et al., 2009; Ahearn et al., 2012). De hct116 kankercellijn, verkregen uit menselijke colonkankercellen, wordt vaak gebruikt om de cytotoxiciteit van testsamenstellingen te beoordelen.
In vervolg op onze studies naar de schimmeltransformatie van bioactieve steroïden (Choudhary et al.,2005b, c, 2007, 2010; Ahmad et al., 2014; Siddiqui et al., 2017), synthetiseerden wij analogen van drostanolone enanthate (1) door zijn transformatie met Cephalosporium aphidicola, en Fusarium lini. Metabolieten 2-9, evenals substraat 1, werden geëvalueerd tegen hela (cervicaal carcinoom), PC-3 (prostaatcarcinoom), H460 (longkanker), HCT116 (colonkanker) en 3T3 (muis fibroblast normaal) cellijnen, met behulp van high-throughput cell-based assay, de meest efficiënte en handige laboratoriummethode, de MTT assay om de respons van testverbindingen in maligniteiten te voorspellen waar ze specificiteit tegen de kankercellen vertoonden. Deze studie heeft aldus anti-kankermetabolieten van drostanolone Enanthate (1) voor verdere studies geïdentificeerd.
materialen en methoden
Instrumentele analyse
dunnelaagchromatografie (TLC) (silicagel, 20 × 20, 0,25 mm dik, PF254, Merck, Duitsland) werd gebruikt voor de analyse van de mate van omzetting en zuiverheid. Silicagel-kolomchromatografie (70-230 mesh, E. Merck, Duitsland) werd gebruikt voor de initiële zuivering van metabolieten. Bovendien, preparatieve omgekeerde fase recycling (Jai LC-908W, Japan), uitgerust met YMC L-80 (4-5 µm, 20-50 mm i.d.), werd gebruikt voor de definitieve zuivering van metabolieten. Structuren van metabolieten werden opgehelderd met behulp van 1h-(400, 500, en 600 MHz), en 13C-NMR (100, 125, en 150 MHz) spectra, die werden geregistreerd op Bruker Avance-NMR spectrometers (Frankrijk) in CD3OD, CD3COCD3 of DMSO-d6. Hrei-MS en IR spectra werden uitgevoerd op JEOL JMS-600H (Japan) (double-focusing magnetische sector mass analyzer) massaspectrometer (EI, elektron impact ionisatie), en Bruker Vector 22 FT-IR spectrofotometer, respectievelijk. Optische rotaties van metabolieten werden geregistreerd op JASCO P-2000 polarimeter (Japan). Evolution 300 uv-Zichtbare Spectrofotometer werd gebruikt om de UV-spectra te registreren. De smeltpunten van de getransformeerde producten werden gemeten met behulp van het Buchi m-560 (Zwitserland) instrument. Er werd eenkristal Röntgendiffractiegegevens verzameld op de Bruker Apexii D8 Venture diffractometer, uitgerust met een foton 100 detector (CMOS-technologie) en een verzegelde buis met fijn focus met röntgenbron (cu Ka radiaties α = 1,54178 Å). Reflectie intensiteiten werden geà ntegreerd met behulp van SAINT software. Absorptie correctie werd gedaan op Multi-scan, en structuur werd opgelost door SHELXTL programma (Gerlier en Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
microbiële culturen
microbiële culturen van C. aphidicola ATCC 28300 en F. lini NRRL 2204 werden verkregen uit respectievelijk de American Type Culture Collection (ATCC) en Northern Regional Research Laboratories (NRRL). Culturen werden geteeld met Sabouraud dextrose agar (SDA) slant, en gehandhaafd op 4°C.
Mediumpreparaat
vier liter media voor de groei van C. aphidicola ATCC-28300 werd bereid door 200 g glucose, 4 g KH2PO4, 8 g glycine, 4 g KCl, 8 g MgSO4.7H2O en 8 mL sporenelementen te mengen in 4 L gedestilleerd water. Ook werd vier liter media bereid voor F. lini NRRL 2204 door 40 g glucose, 20 g gistextract, 20 g pepton, 20 g KH2PO4, 20 g NaCl en 40 mL glycerol te mengen in 4 L gedestilleerd water.fermentatie van Drostanolon enanthaat (1) met C. aphidicola ATCC 28300 en F. lini NRRL 2204
Medium voor de groei van C. aphidicola en F. lini werd bereid door bovengenoemde ingrediënten te mengen in 4 L gedestilleerd water voor elke schimmel, dat vervolgens gelijkmatig werd verdeeld in 40 erlenmeyer-kolven van 250 mL (100 mL in elke kolf). Al deze kolven werden geautoclaveerd bij 121°C en werden geïnoculeerd met SDA-schuine lagen van C. aphidicola ATCC 28300 en F. lini NRRL 2204 onder gesteriliseerde omstandigheden. Deze schimmel cultuur met kolven werden gelaten op de roterende shaker (121 rpm) bij 26 ± 2°C gedurende 3-4 dagen om maximale groei van C. aphidicola en F. lini te verkrijgen. Verbinding 1 (1 g) werd opgelost in 20 mL aceton voor elke schimmel en werd in elke kolf 0,5 mL toegediend en gedurende 12 dagen opnieuw op het roterende schudapparaat geplaatst. Een negatieve controle (medium + schimmel cultuur), evenals positieve controle (medium + substraat) werden ook analoog bereid om de schimmel metabolieten en afbraak van verbinding 1, respectievelijk te evalueren. Na incubatie van 12 dagen werden alle kolven gefilterd en geëxtraheerd met 20 L dichloormethaan (DCM), werd de organische fase gescheiden en vervolgens verdampt onder verminderde druk op de rotatieverdamper. Dit leverde 1,5 g bleekgelige vaste ruwe ruwe olie op. Dit ruwe materiaal werd gefractioneerd over de chromatografie van de silicagelkolom door elutie met gradiënthexanen en acetonoplossensystemen. Kolomchromatografie leverde vier hoofdfracties (1-4) op, die vervolgens werden gezuiverd door HPLC te recyclen. De metabolieten 2 (tR = 16 min, 8 mg, 0,8%), 3 (tR = 19 min, 11 mg, 1,1%), 4 (tR = 17 min, 35 mg, 3,5%), 5 (tR = 23 min, 42 mg, 4,2%), 6 (tR = 20 min, 9 mg, 0,9%), 7 (tR = 21 min, 12 mg, 1,2%) en 9 (TR = 18 min, 5 mg, 0,5%) werden gezuiverd uit fracties 1-7, respectievelijk, door reverse phase recycling HPLC met methanol – water als oplosmiddel systeem (MeOH: H2o; 70: 30). Terwijl metaboliet 8 werd verkregen uit fractie 8 door middel van normale fase recycling HPLC (tR = 32 min, CHCl3: MeOH; 95: 5, 7.5 mg, 0,75%).
2α-Methyl-3α, 14α, 17β-trihydroxy-5α-androstane (2)
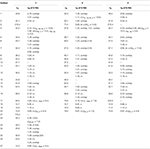
Tabel 1. 13C-en 1H-NMR chemische verschuivingsgegevens (J en W1 / 2 in Hz) van verbindingen 1-3 (δ ppm).
2α-Methyl-7α-hydroxy-5α-androstan-3,17-dion (3)
2α-Methyl-3α,17β-dihydroxy-5α-androstane (4)
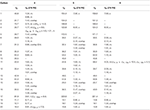
tabel 2. 13C-en 1H-NMR chemische verschuivingsgegevens (J en W1 / 2 in Hz) van verbindingen 4-6 (δ ppm).
2-Methylandrosta-1,4-diene-3,17-dione (5)
2-Methylandrosta-11α-hydroxy-1,4-diene-3,17-dione (6)
2-Methylandrosta-14α-hydroxy-1,4-diene-3,17-dione (7)
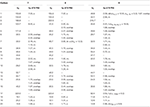
Tabel 3. 13C-en 1H-NMR chemische verschuivingsgegevens (J en W1 / 2 in Hz) van verbindingen 7-9 (δ ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Cellijnen werden gekweekt in dmem F12 media, aangevuld met 10% FBS onder een 5% CO2 atmosfeer bij 37°C in een incubator.
de colorimetrische test MTT werd gebruikt voor de evaluatie van de celmetabole activiteit. In deze test wordt de gele MTT gereduceerd tot purpere formazon in de mitochondriën van de levende cellen (Gerlier en Thomasset, 1986). Hoe meer de levende cellen, hoe meer de kleur en dus meer absorptie wordt waargenomen door colorimeter (Fesahat et al., 2015). Wij hebben deze methode gebruikt om het effect van onze getransformeerde producten op cellulaire cytotoxiciteit tegen kankercellen te analyseren. Ongeveer 10.000 cellen van elke cellijn (HeLa, PC3, h460, hct116 kanker, en 3T3 normaal) werden geplaatst in 96-well platen. Na het bereiken van 80-90% samenvloeiing, werden ze behandeld met verschillende concentraties van verbindingen (25, 50, 75, 100, en 200 µM) gedurende 24 uur. alle verbindingen werden opgelost in steriele DMSO om een 200 mM stamoplossing te maken. De oplossing werd gefilterd en seriële verdunningen werden gemaakt in groeimedium. 600 µL van elke verdunning werd gebruikt om 3 putjes (drievoud van elk) van 96 putplaat te behandelen, d.w.z. elk 200 µL. Elk experiment werd uitgevoerd in drie biologische replicaten. MTT werd toegevoegd, en geïncubeerd gedurende 4 h. na verwijdering van MTT, werden de Purpere formazon kristallen opgelost in DMSO, en de lezing werd waargenomen bij 540 en 570 nm voor normale en kankercellen, respectievelijk. De Multiskan reader geeft λmax bij 540 nm in met DMSO behandelde 3T3 fibroblastcellen (die meer samenvloeien in de morfologie) terwijl in het geval van kankercellen 570 nm λmax geeft (Bonmati-Carrion et al., 2013; Danihelová et al., 2013). Een brede waaier van de cellijnen van het epitheliaale carcinoom werd gebruikt in dit experiment waar cisplatin een gemeenschappelijke drug van keus was. Het richt zich op DNA, interfereert met celdeling tijdens mitose en veroorzaakt apoptose (Eastman, 1999). IC50-waarden werden berekend om de minimale concentratie te bepalen die nodig is om 50% van de cellen te doden.
Dat
Op = Absorptie waarde van de test-verbinding
Ab = Absorptie waarde van leeg
Ac = Absorptie waarde van control
Resultaten en Discussie
Structuur Opheldering
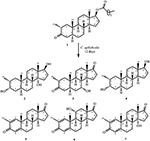
Figuur 1. Biotransformatie van drostanolon ENANTAAT (1) met Cephalosporium aphidicola.
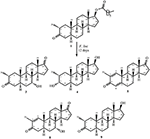
Figuur 2. Biotransformatie van Drostanolon enanthaat (1) met Fusarium lini.
metaboliet 2 werd geïsoleerd als witte kristallen. De moleculaire formule C20H30O3 was gebaseerd op HREI-MS die de bij M/z 322.2517 (calcd toonde. 322.2508, C20H34O3), die de toevoeging van drie waterstof voorstellen, en een zuurstofatoom, vermindering van C-3 ketonic carbonyl, en hydrolytische splitsing van heptanoate zijketen in substraat 1. De IR-absorptie bij 3.531 en 3.423 cm-1 was te wijten aan de aanwezigheid van hydroxylgroepen. Het 1h-NMR-spectrum vertoonde een extra methineprotonsignaal bij δ 3,69 (Tabel 1) (datablad 2). De signalen voor heptanoate zijketting werden ook gevonden die in 1h-NMR spectrum van verbinding 2 ontbreken. Het 13C – NMR spectrum toonde signalen voor een nieuwe methine koolstof bij δ 71.4, en een nieuwe quaternaire koolstof bij δ 84.8. De koolstofsignalen voor heptanoate keten en ketonic carbonyl werden ook gevonden die in het 13C-NMR spectrum ontbreken. Dit suggereerde vermindering van C-3 carbonyl, hydrolytisch verlies van heptanoaatketen, en toevoeging van een OH bij C-14 (Tabel 1). De OH-groep werd op C-3 geplaatst op basis van hmbc-correlaties van H3-20 (δ 0,91, d) met C-3 (δ 71.4) (Figuur 3). Dit is het gevolg van de reductie van C-3 carbonyl. De tweede OH groep werd geplaatst op C-14, gebaseerd op de hmbc correlatie van H3-18 (δ 0,81, s) met C-14 (δ 84.8). De derde OH was bij C-17, het gevolg van hydrolytisch verlies van heptanoaat deel. De O-H-groep bij C-3 werd afgeleid als α-georiënteerd op basis van de NOESY correlaties van H-3 (δ 3.69, br. s) met β-georiënteerde H-2 (δ 1,64, overlapping) en α-georiënteerde H3-20 (δ 0,91, d) (Figuur 4). De OH-14 werd afgeleid als α-georiënteerd, gebaseerd op NOESY correlaties van H-9 (δ 1,32, m) met OH-14 (δ 2,66, s) (aceton-d6). De de diffractieanalyse van de éénkristal Röntgenstraal ondersteunde verder de structuur van metabolite 2, samengesteld uit drie ringen in stoelbouw (A, B, en C), en één in envelopbouw (D). Drie OH-groepen op C-3, C-14 en C-17 werden toegewezen, α -, α-En β-oriëntatie (Figuur 5). Enkelkristaldiffractiegegevens van metaboliet 2 werden ingediend bij Cambridge Crystallografic Data Collection (CCDC 1500706). De structuur van metaboliet 2 werd dus afgeleid als 2α-methyl-3α,14α,17β-trihydroxy-5α-androstane.
Figuur 3. Belangrijke hmbc (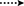 ) en COSY (
) en COSY ( ) correlaties in nieuwe metabolieten.
) correlaties in nieuwe metabolieten.
Figuur 4. Belangrijke NOESY correlaties in nieuwe metabolieten.
metaboliet 3 werd verkregen als een witte vaste stof. De HREI-MS toonde de at M/z 318.2192 (calcd. 318,2195, C20H30O3). Dit vertegenwoordigde het verlies van heptanoate zijketen, en toevoeging van een zuurstofatoom in substraat 1. IR spectrum vertoonde absorbanties voor OH (3.436 cm-1) en ketonische carbonyls (1.711 cm−1). In het 1h-NMR-spectrum ontbraken signalen van heptanoaatketens en c-17 methineproton, terwijl een nieuw downfield methineprotonsignaal werd waargenomen bij δ 3,92 (Tabel 1) (datablad 3). Dit suggereerde hydroxylatie van steroïdaal skelet en oxidatieve splitsing van heptanoaat deel. Het 13C-NMR spectrum steunde ook de bovengenoemde gevolgtrekkingen. De koolstofsignalen voor heptanoaatgroep ontbraken, terwijl een nieuwe ketoncarbonyl en een Oxy-methinesignalen in 13C-NMR spectrum verschenen (Tabel 1). Dit wees op oxidatieve splitsing van de heptanoaatketen en hydroxylering in substraat 1. Het nieuw verschenen methine proton bij δ 3,92 (H-7) toonde hmbc correlaties met C-5, en C-8, wat een OH suggereert bij C-7 (figuur 3). De hmbc correlaties van H3-18 en H2-16 met een koolstof bij δ 223.8 suggereerden een ketonische koolstof bij C-17. OH bij C-7 werd verder ondersteund door gezellige correlaties van H-7 met H2-6 en H-8. H-7 (δ 3,92, s) vertoonde NOESY correlaties met axiaal georiënteerde H-8 (δ 1,70, overlapping), die een α-oriëntatie van OH bij C-7 suggereerde (Figuur 4). De structuur van metaboliet 3 werd dus afgeleid als 2α-methyl-7α-hydroxy-5α-androstan-3,17-dion.
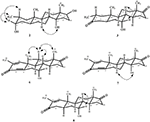
eenkristal Röntgendiffractieanalyses werden ook uitgevoerd op de verbindingen 1 en 5. Samenstelling 1 werd samengesteld uit vier ringen d.w.z., A, B, C, en D met stoel, stoel, stoel, en envelop conformations. Een methyl was aanwezig op c-2 met equatoriale oriëntatie. Heptanoaat ester keten was aanwezig op C-17 van ring D (Figuur 6). Terwijl, metabolite 5 ringen A, B, C, en D in schaafmachine, stoel, stoel, en omhulsel conformations bevat. De zijketen van heptanoaat was afwezig in metaboliet 5 (Figuur 7). Enkelkristaldiffractiegegevens van metabolieten 1 en 5 werden ingediend bij de Crystallografische gegevensverzameling van Cambridge (respectievelijk CCDC 1500705 en CCDC 1500707). De analyse-gegevens voor röntgendiffractie van éénkristalverbindingen 1, 2 en 5 zijn weergegeven in Tabel 4.
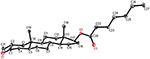
Figuur 6. Computergegenereerde ORTEP-tekening van het uiteindelijke Röntgenmodel van compound 1. Kleurcodes: koolstof, zwart; zuurstof, rood.
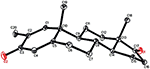
Figuur 7. Computergegenereerde ORTEP-tekening van het uiteindelijke Röntgenmodel van compound 5. Kleurcodes: koolstof, zwart; zuurstof, rood.

Tabel 4. Eenkristal X-ray diffractie analyse van verbindingen 1, 2, en 5.
cytotoxiciteit tegen Hela -, PC3 -, H640-en HCT116-kanker, en 3T3 normale cellijnen
natuurlijke producten, bv. flavonoïden, steroïden, terpenen, enz. kan dienen als een uitstekende bron voor de productie van vele geneesmiddelen, zoals ze worden gemeld voor vele biologische activiteiten zoals anti-kanker, anti-inflammatoire, anti-leishmanial, anti-bacteriële activiteiten, enz. Daarom is het noodzakelijk om ze af te leiden, om structuur-activiteitsrelatie te bestuderen die nuttig kan zijn voor de synthese van veilige en effectieve geneesmiddelen. Op dit moment worden veel farmaceutische producten efficiënt gesynthetiseerd via microbiële biotransformatie toe te schrijven aan de aanwezigheid van een waaier van enzymen daarin. Op basis van de gerapporteerde antikankeractiviteit van drostanolon (9), drostanolonpropionaat en drostanolonheptanoaat (1) werden de verbindingen 1-9 beoordeeld op cytotoxiciteit tegen de kankercellijnen HeLa, PC-3, H460 en HCT116. Interessant, alle samenstellingen toonden een gematigde tot krachtige anti-kankeractiviteit. De antikankeractiviteit van verbindingen 1-9 werd afgeleid uit de IC50-waarden tegen HeLa (humaan cervicaal carcinoom), PC-3 (humaan prostaatkanker), H460 (humaan longkanker) en HCT116 (humaan colonkanker) (Tabel 5). Op basis van deze resultaten werd de cytotoxiciteit van deze verbindingen ook geëvalueerd tegen 3T3 (muis fibroblast) normale cellijn, waarbij alle verbindingen, behalve 8 (IC50 = 74,6 ± 3,7 µM) en 9 (IC50 = 62,1 ± 1,2 µM), niet-cytotoxisch bleken te zijn.

Tabel 5. Cytotoxiciteit van verbindingen 1-9 tegen hela -, PC3 -, H460-en HCT116-kanker en 3T3-normale cellijnen.
structuur-Activiteitsrelatie
variaties in de structuren van metabolieten hebben hun antikankeractiviteit beïnvloed. Metaboliet 2 met de afwezigheid van estergroep, en twee ao-h-groepen bij C-3, en C-14, en een ßO-H-groep bij C-17 vertoonden een lagere cytotoxiciteit tegen hela, h460 en HCT116 kankercellijnen, maar zijn anti-kankeractiviteit was hoger tegen PC-3 kankercellijnen, in vergelijking met verbinding 1. Metaboliet 3 met het verlies van estergroep en twee keto-groepen bij C-3 en C-17 en Ao-H-groep bij C-7 toonde ook een lagere activiteit tegen hela, h460 en hct116 kankercellijnen, maar verhoogde activiteit tegen PC-3 kankercellijn in vergelijking met substraat 1. Reductie van C-3 carbonyl tot O-H en hydrolytische splitsing van estergedeelte in verbinding 4 verhoogde de activiteit tegen zowel HeLa als PC-3 kankercellijnen tot op zekere hoogte, maar de anti-kankeractiviteit tegen h460 en hct116 kankercellijnen nam af in vergelijking met substraat 1. De aanwezigheid van C = C tussen C-1/C-2 en C-4/C-5, samen met C = O bij C-3, en C-17 maakte metaboliet 5 tot een krachtig middel tegen kanker tegen de cellijn van HeLa kanker, in vergelijking met substraat 1 en het standaardgeneesmiddel (cisplatine). Bovendien werd zijn anti-kankeractiviteit tegen de kankercellijn van PC-3 ook verhoogd in vergelijking met substraat 1. Interessant, was zijn anti-kankeractiviteit tegen h460, en hct116 kankercellijnen lager in vergelijking met samenstelling 1. De aanwezigheid van C = C tussen C-1/C-2 en C-4 / C-5, C = O bij C-3 en C-17, samen met de Ao-H-groep bij C-11 in metaboliet 6 verhoogde zijn anti-kankeractiviteit tegen HeLa en PC-3 kankercellijnen in vergelijking met substraat 1 en toonde een vergelijkbaar anti-kanker potentieel tegen HeLa kankercellijn als standaard geneesmiddel (cisplatine). Nochtans, verminderde zijn anti-kankeractiviteit tegen h460, en hct116 kankercellijnen in vergelijking met samenstelling 1. De aanwezigheid van C = C tussen C-1/C-2 en C-4 / C-5, C = O bij C-3 en C-17, samen met de Ao-H-groep bij C-14 in metaboliet 7 verhoogde opnieuw zijn anti-kankeractiviteit tegen HeLa en PC-3 kankercellijnen, en verminderde zijn anti-kankeractiviteit tegen h460 en hct116 cellijnen in vergelijking met substraat 1. De aanwezigheid van C = C bij C-1/C-2, C = O bij C-3, en C-17, en aOH bij C-7 maakte van metaboliet 8 de meest krachtige anti-kanker tegen HeLa kankercellijn in vergelijking met substraat 1 en het standaardgeneesmiddel (cisplatine). Het toonde ook een goede activiteit tegen PC – 3 kankercellijn maar verminderde anti-kankeractiviteit tegen h460, en hct116 kankercellijnen in vergelijking met substraat 1. Metaboliet 9 met alleen hydrolyse bij C-17 vertoonde een verhoogde antikankeractiviteit tegen hela, PC-3 en HCT116 kankercellijnen, maar verminderde de cytotoxiciteit tegen h460 kankercellijnen in vergelijking met substraat 1 en het standaardgeneesmiddel (cisplatine). Op basis van bovenstaande discussie kan worden geconcludeerd dat de verhoogde antikankeractiviteit van verbindingen 5-8 tegen HeLa en PC-3 kankercellijnen waarschijnlijk te wijten was aan de aanwezigheid van C = C bij C-1/C-2, en carbonylketon bij C-3 en C-17 in vergelijking met substraat 1.
conclusie
Auteursbijdragen
het concept van het gepresenteerde onderzoek werd ontwikkeld en ontworpen door MIC. MIC was ook de projectleider. Alle gegevens werden geanalyseerd en geïnterpreteerd door MIC, A-t-W en HC. MS, SY, MA en NF voerden de experimenten uit. MIC, A-T-W, en MS schreven het manuscript. Alle auteurs hebben het manuscript herzien. De definitieve versie van het manuscript werd ook goedgekeurd door MIC voordat het werd ingediend.
belangenconflict verklaring
De auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict kon worden opgevat.
erkenningen
A-t-W, en MIC erkennen de stimulerende rol van de Higher Education Commission, Islamabad, Pakistan, door middel van een financiële steun in het kader van “Studies on the chemopreventie of Mammary Carcinogenesis by Dietary Agents, (20-3790/NRPU/R&D/HEC/13/793).”SY erkent de financiële steun van de OPCW (Organization for the Prohibition of Chemical Weapons) via een onderzoeksproject getiteld, “Structural and biological studies on new anabole steroids obtained by biotransformation.”HC erkent de financiële steun van” The Deanship of Scientific Research (DSR), King Abdulaziz University, Ministerie van Onderwijs, Saudi-Arabië.”
Supplementary Material
Eastman, A. (1999). “Het werkingsmechanisme van cisplatine: van adducten tot apoptose,” in cisplatine: Chemistry and Biochemistry of a Leading antikanker Drug, ed B. Lippert (Zürich: Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002 / 9783906390420. ch4
CrossRef Full Text / Google Scholar
Vardar, E., Vardar, S. A., and Cengiz, T. (2002). Anabool-androgene steroïde misbruik. Anato. J. Psychiatrie 3, 104-107.