- wprowadzenie
- materiały i metody
- Analiza instrumentalna
- Kultury drobnoustrojów
- Przygotowanie podłoża
- fermentację drostanolonu Enanthate (1) Z C. aphidicola ATCC 28300 i pożywką F. lini NRRL 2204
- 2α-metylo-3α,14α,17β-trihydroksy-5α-androstan (2)
- 2α-metylo-7α-hydroksy-5α-androstan-3,17-dion (3)
- 2α-metylo-3α,17β-dihydroksy-5α-androstan (4)
- 2-Methylandrosta-1,4-glikol-3,17-Dione (5)
- 2-Methylandrosta-11α-hydroxy-1,4-glikol-3,17-Dione (6)
- 2-Methylandrosta-14α-hydroxy-1,4-glikol-3,17-Dione (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- wyniki i dyskusja
- wyjaśnienie struktury
- cytotoksyczność przeciwko rakowi HeLa, PC3, H640 i Hct116 oraz normalnym Liniiom komórkowym 3T3
- zależność struktura-aktywność
- wnioski
- wkład autora
- Oświadczenie o konflikcie interesów
- podziękowania
- materiał uzupełniający
wprowadzenie
transformacja mikrobiologiczna jest jednym z najważniejszych podejść do transformacji strukturalnej różnych klas związków organicznych. Technika ta została z powodzeniem zastosowana w chemii ekologicznej, tj. programy odkrywania i rozwoju leków, zapewniające doskonałe źródło związków wokół struktur rdzenia, a następnie badania przesiewowe pod kątem różnych aktywności biologicznych. W kilku przypadkach transformacja mikrobiologiczna była używana jako ważne narzędzie do Regio-, chemo-i stereo-selektywnych konwersji związków organicznych, które są trudne do osiągnięcia konwencjonalnymi metodami (Holland and Weber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmańska et al., 2005; Borges et al., 2009; Choudhary et al., 2011; Ravindran et al., 2012). Ze względu na nieaktywny charakter węglowodorowego szkieletu steroidów, są one często trudne do wyprowadzenia konwencjonalnymi metodami syntetycznymi. Dlatego transformacja mikrobiologiczna jest często stosowana do zmiany strukturalnej steroidów. Obecność układów enzymatycznych cytochromu P450 w grzybach sprawia, że biokataliza pełnokomórkowa jest skutecznym narzędziem do hydroksylacji stereo-i regio-specyficznej (Choudhary et al., 2005a; Tong and Dong, 2009; Kristan and RiŽner, 2012; Baydoun et al., 2014).
DROSTANOLON i jego pochodne estrowe, takie jak propionian drostanolonu, pentanian drostanolonu i enantan drostanolonu (1) są sterydami anaboliczno-androgennymi (Aass) stosowanymi przez sportowców w celu wzmocnienia mięśni bez przyrostu tłuszczu. Ponadto Drostanolon i jego pochodne estrowe mają zdolność hamowania produkcji estrogenu. Ester propionianowy drostanolonu jest również stosowany w leczeniu raka piersi pod marką Masteron (Chowdhury et al., 1976; Clavel et al., 1982; Marinov et al., 1986; Vardar et al., 2002; Bahrke i Yesalis, 2004).
rak jest obecnie uznawany za poważne wyzwanie dla zdrowia publicznego. Nowotwory są drugą główną przyczyną zgonów w Stanach Zjednoczonych i na całym świecie. Według Światowej Organizacji Zdrowia (WHO) częstość występowania raka przekracza 6 milionów przypadków rocznie. Komórki nowotworowe mają wysoki wskaźnik proliferacji. Szybko rozprzestrzeniają się w systemie żywym i mogą przetrwać przed silnymi chemioterapeutykami i czynnikami uszkadzającymi DNA. Podobnie leki cytotoksyczne mają wiele niekorzystnych skutków dla normalnych komórek, a zatem ich zastosowanie w chemioterapii nowotworów jest wyzwaniem terapeutycznym. Z tego powodu pilnie potrzebne jest opracowanie bezpiecznych, skutecznych i selektywnych chemioterapeutyków przeciwko różnym nowotworom (Munoz-Pinedo et al., 2012; Su et al., 2015; Swadogo et al., 2015; Rebecca et al., 2016).
rak piersi jest jednym z najczęstszych nowotworów w 140 krajach świata. Jest główną przyczyną zgonów związanych z rakiem u kobiet na całym świecie, charakteryzującą się nieprawidłowym wzrostem komórek w zrazach piersiowych lub przewodach o wysokim współczynniku proliferacji (Hanahan and Weinberg, 2000; Ferlay et al., 2015).
rak szyjki macicy jest drugim najbardziej dominującym nowotworem u kobiet na całym świecie, po raku piersi. Główną przyczyną raka szyjki macicy jest tworzenie się komórek nowotworowych w tkankach szyjki macicy (Wang et al., 2013; Hafiza and Latifah, 2014; Pariente et al., 2016). Linia komórek nowotworowych HeLa, uzyskana z ludzkich komórek raka szyjki macicy, jest powszechnym modelem komórkowym do oceny potencjału cytotoksycznego badanych związków.
rak prostaty jest drugim wiodącym nowotworem u mężczyzn na świecie po raku oskrzeli i trzecią najczęstszą przyczyną śmierci nowotworowej. Jest to najczęstsza przyczyna nowotworu u mężczyzn. Jego częstość wzrasta wraz z wiekiem, częściej w wieku powyżej 50 lat (Henry and Omahony, 1999; De-Bono et al., 2010; Wenbin et al., 2015). Linia komórek nowotworowych PC-3, otrzymywana z męskich komórek raka prostaty, jest szeroko stosowanym modelem do badania toksyczności badanych związków.
rak płuc jest bardzo rozpowszechnionym nowotworem wśród mężczyzn w Stanach Zjednoczonych od połowy lat 50., a wśród kobiet od końca lat 80. jest główną przyczyną zgonów związanych z rakiem. Rak płuc jest głównie przypisywane do palenia (Travis et al., 2002; Villanti et al., 2013; Mishra et al., 2016). Linia komórek nowotworowych H460, otrzymywana z ludzkich komórek raka płuc (limfogenna podlina przerzutowa wielkokomórkowego raka płuca człowieka), jest często wykorzystywana do oceny cytotoksyczności badanych związków.
Po rakach piersi, płuc i prostaty Rak jelita grubego jest czwartym najbardziej rozpowszechnionym rakiem na świecie. Jest to rak występujący w przybliżeniu z równą częstotliwością u mężczyzn i kobiet. Jest to druga najczęstsza przyczyna zgonów związanych z rakiem w krajach zachodnich (Levin et al., 2008; Andre et al., 2009; Ahearn et al., 2012). Linia komórek nowotworowych HCT116, otrzymywana z ludzkich komórek raka jelita grubego, jest powszechnie stosowana do oceny cytotoksyczności badanych związków.
w kontynuacji naszych badań nad transformacją grzybiczą bioaktywnych sterydów (Choudhary et al., 2005b, c, 2007, 2010; Ahmad et al., 2014; Siddiqui et al., 2017), zsyntetyzowaliśmy analogi drostanolonu enanthate (1) poprzez jego transformację z Cephalosporium aphidicola i Fusarium lini. Metabolity 2-9, jak również substrat 1, oceniano w odniesieniu do linii komórkowych HeLa (rak szyjki macicy), PC-3 (rak gruczołu krokowego), H460 (rak płuc), hct116 (rak jelita grubego) i 3T3 (fibroblast mysi prawidłowy), stosując wysokoprzepustowy test komórkowy, najbardziej efektywną i wygodną metodę laboratoryjną, test MTT w celu przewidywania odpowiedzi badanych związków w nowotworach nowotworowych, w których wykazywały one swoistość wobec komórek nowotworowych. W tym badaniu zidentyfikowano przeciwnowotworowe metabolity drostanolonu enanthate (1) do dalszych badań.
materiały i metody
Analiza instrumentalna
chromatografia cienkowarstwowa (TLC) (żel krzemionkowy, 20 × 20, grubość 0,25 mm, PF254, Merck, Niemcy) została wykorzystana do analizy stopnia transformacji i czystości. Do wstępnego oczyszczania metabolitów zastosowano chromatografię kolumnową na żelu krzemionkowym (70-230 mesh, E. Merck, Niemcy). Ponadto do ostatecznego oczyszczania metabolitów zastosowano preparatywny recykling fazy odwrotnej (jai LC-908w, Japonia), wyposażony w YMC L-80 (4-5 µm, 20-50 mm i.d.). Struktury metabolitów zostały wyjaśnione za pomocą widm 1h- (400, 500 i 600 MHz) i 13C-NMR (100, 125 i 150 MHz), które zostały zarejestrowane na Spektrometrach Bruker Avance-NMR (Francja) W CD3OD, CD3COCD3 lub DMSO-D6. Widma HREI-MS i IR wykonano odpowiednio na spektrometrze masowym jeol JMS-600h (Japan) (double-focusing magnetic sector mass analyzer) (EI, electron impact jonization) i Spektrofotometrze Bruker vector 22 FT-IR. Obroty optyczne metabolitów zarejestrowano na POLARYMETRZE JASCO P-2000 (Japonia). Spektrofotometr Evolution 300 UV-visible został użyty do rejestracji widm UV. Temperaturę topnienia przetwarzanych produktów mierzono przy pomocy instrumentu Buchi m – 560 (Szwajcaria). Monokrystaliczne dane dyfrakcji rentgenowskiej zebrano na Dyfraktometrze Bruker APEXII D8 Venture, wyposażonym w detektor PHOTON 100 (technologia CMOS) i szczelną tubę o drobnym ognisku mającą źródło promieniowania rentgenowskiego (promieniowanie cu Ka α = 1,54178 Å). Intensywność refleksji została zintegrowana za pomocą oprogramowania SAINT. Korekcja absorpcji została wykonana na Multi-skanie, a struktura została rozwiązana przez program SHELXTL (Gerlier i Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
Kultury drobnoustrojów
Kultury drobnoustrojów C. aphidicola ATCC 28300 i F. lini NRRL 2204 uzyskano odpowiednio z American Type Culture Collection (ATCC) i Northern Regional Research Laboratories (Nrrl). Kultury hodowano na skośnym agarze dekstrozy Sabouraud (SDA) i utrzymywano w temperaturze 4°C.
Przygotowanie podłoża
cztery litry podłoża do wzrostu C. aphidicola ATCC-28300 przygotowano przez zmieszanie 200 g glukozy, 4 G KH2PO4, 8 g glicyny, 4 G KCl, 8 g MgSO4.7H2O i 8 mL pierwiastków śladowych w 4 L wody destylowanej. Podobnie przygotowano cztery litry pożywki dla F. lini NRRL 2204 przez zmieszanie 40 g glukozy, 20 g ekstraktu drożdżowego, 20 g peptonu, 20 g KH2PO4, 20 g NaCl i 40 mL glicerolu w 4 L wody destylowanej.
fermentację drostanolonu Enanthate (1) Z C. aphidicola ATCC 28300 i pożywką F. lini NRRL 2204
do wzrostu C. aphidicola i F. lini przygotowano przez zmieszanie wyżej wymienionych składników w 4 L wody destylowanej dla każdego grzyba, która następnie była równomiernie dozowana do 40 Kolb Erlenmeyera po 250 mL (100 mL w każdej kolbie). Wszystkie te kolby sterylizowano w autoklawie w temperaturze 121°C i zaszczepiono skosami SDA C. aphidicola ATCC 28300 i F. lini NRRL 2204 w sterylizowanych warunkach. Te kultury grzybowe zawierające kolby pozostawiano na wytrząsarce obrotowej (121 obr. / min) w temperaturze 26 ± 2°C przez 3-4 dni, aby uzyskać maksymalny wzrost C. aphidicola i F. lini. Związek 1 (1 g) rozpuszczono w 20 mL acetonu dla każdego grzyba i dozowano 0,5 mL do każdej kolby i ponownie umieszczano na obrotowym shakerze na 12 dni. Analogicznie przygotowano również kontrolę negatywną (pożywka + hodowla grzybów), jak również kontrolę pozytywną (pożywka + substrat) w celu oceny odpowiednio metabolitów grzybów i degradacji związku 1. Po 12 dniach inkubacji wszystkie kolby przesączono i ekstrahowano 20 L dichlorometanu (DCM), oddzielono fazę organiczną, a następnie odparowano pod zmniejszonym ciśnieniem na wyparce obrotowej. Otrzymano w ten sposób 1,5 g jasnożółtej bryły surowej. Surowy materiał frakcjonowano za pomocą chromatografii kolumnowej na żelu krzemionkowym przez elucję za pomocą gradientowych heksanów i systemów rozpuszczalników acetonowych. W chromatografii kolumnowej uzyskano cztery główne frakcje (1-4), które następnie oczyszczono metodą recyklingu HPLC. Oczyszczono metabolity 2 (tR = 16 min, 8 mg, 0,8%), 3 (tR = 19 min, 11 mg, 1,1%), 4 (tR = 17 min, 35 mg, 3,5%), 5 (tR = 23 min, 42 mg, 4,2%), 6 (tR = 20 min, 9 mg, 0,9%), 7 (tR = 21 min, 12 mg, 1,2%) i 9 (tR = 18 min, 5 mg, 0,5%) z frakcji 1-7, odpowiednio, poprzez odwrotną fazę recyklingu HPLC przy użyciu metanol – woda jako system rozpuszczalnika (meoh: H2O; 70: 30). Natomiast metabolit 8 otrzymano z frakcji 8 poprzez normalną fazę recyklingu HPLC (TR = 32 min, CHCl3: MeOH; 95: 5, 7.5 mg, 0, 75%).
2α-metylo-3α,14α,17β-trihydroksy-5α-androstan (2)
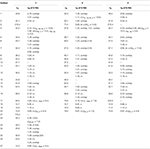
Tabela 1. 13C-i 1H-NMR dane przesunięcia chemicznego (J I W1/2 W Hz) związków 1-3 (δ ppm).
2α-metylo-7α-hydroksy-5α-androstan-3,17-dion (3)
2α-metylo-3α,17β-dihydroksy-5α-androstan (4)
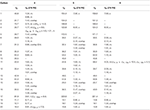
tabela 2. 13C-i 1H-NMR dane przesunięcia chemicznego (J I W1/2 W Hz) związków 4-6 (δ ppm).
2-Methylandrosta-1,4-glikol-3,17-Dione (5)
2-Methylandrosta-11α-hydroxy-1,4-glikol-3,17-Dione (6)
2-Methylandrosta-14α-hydroxy-1,4-glikol-3,17-Dione (7)
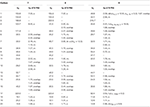
Tabela 3. 13C and 1H-NMR chemical shift data (J and W1 / 2 in Hz) of compounds 7-9 (δ ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Linie komórkowe hodowano w pożywce Dmem F12, uzupełnionej 10% FBS w atmosferze 5% CO2 w 37°C w inkubatorze.
do oceny aktywności metabolicznej komórek wykorzystano oznaczenie MTT metodą kolorymetryczną. W tym teście żółty MTT jest redukowany do fioletowego formazonu w mitochondriach żywych komórek (Gerlier i Thomasset, 1986). Im więcej żywych komórek, tym więcej koloru, a tym samym większa absorbancja jest obserwowana przez kolorymetr(Fesahat et al., 2015). Wykorzystaliśmy tę metodę do analizy wpływu naszych przekształconych produktów na cytotoksyczność komórkową przeciwko komórkom nowotworowym. Około 10 000 komórek każdej linii komórkowej (nowotwory hela, PC3, h460, hct116 i 3T3 normal) zaszczepiono w 96-studzienkowych płytkach. Po osiągnięciu 80-90% zbiegu, traktowano je różnymi stężeniami związków (25, 50, 75, 100 i 200 µM) przez 24 godziny. wszystkie związki rozpuszczono w sterylnym DMSO, tworząc 200 mM roztwór podstawowy. Roztwór filtrowano i seryjnie rozcieńczano w pożywce wzrostowej. 600 µL każdego rozcieńczenia użyto do leczenia 3 studzienek (w trzech egzemplarzach) płytki 96 studzienek, tj. po 200 µL każda. Każdy eksperyment przeprowadzono w trzech replikach biologicznych. Dodano MTT i inkubowano przez 4 godziny. po usunięciu MTT fioletowe kryształy formazonu rozpuszczono w DMSO, a odczyt obserwowano przy 540 i 570 nm odpowiednio dla komórek normalnych i nowotworowych. Czytnik Multiskan daje λmax przy 540 nm w komórkach fibroblastów 3T3 leczonych DMSO (które są bardziej zbieżne w morfologii), podczas gdy w przypadku komórek nowotworowych 570 nm daje λmax (Bonmati-Carrion et al., 2013; Danihelová et al., 2013). W tym eksperymencie wykorzystano szeroki zakres linii komórek raka nabłonkowego, w których cisplatyna była powszechnym lekiem z wyboru. Celuje w DNA, zakłóca podział komórek podczas mitozy i indukuje apoptozę (Eastman, 1999). Wartości IC50 obliczono w celu określenia minimalnego stężenia wymaganego do zabicia 50% komórek.
natomiast,
At = wartość absorbancji badanego związku
Ab = wartość absorbancji ślepej
Ac = wartość absorbancji kontroli
wyniki i dyskusja
wyjaśnienie struktury
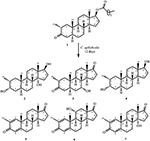
rysunek 1. Biotransformacja drostanolonu enanthate (1) z Cephalosporium aphidicola.
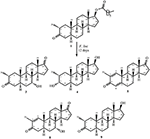
Rysunek 2. Biotransformacja drostanolonu enanthate (1) z Fusarium lini.
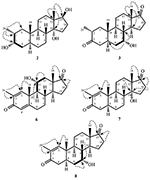
metabolit 2 wyizolowano w postaci białych kryształów. Wzór cząsteczkowy C20H30O3 został oparty na HREI-MS, który wykazał at M / z 322.2517 (calcd. 322.2508, C20H34O3), co sugeruje dodanie trzech wodoru i atomu tlenu, redukcję karbonylu ketonowego C-3 i hydrolityczne rozszczepienie łańcucha bocznego heptanianu w substracie 1. Absorbancja IR przy 3531 i 3423 cm-1 wynikała z obecności grup hydroksylowych. Widmo 1H-NMR wykazało dodatkowy sygnał protonu metinowego przy δ 3,69 (Tabela 1) (Karta Danych 2). Stwierdzono również brak sygnałów dla łańcucha bocznego heptanianu w widmie 1H-NMR Związku 2. Widmo 13C-NMR wykazało sygnały dla nowego węgla metinowego przy δ 71,4 i nowego czwartorzędowego węgla przy δ 84,8. Stwierdzono również brak sygnałów węglowych dla łańcucha heptanianowego i karbonylu ketonowego w widmie 13C-NMR. Sugeruje to redukcję karbonylu C – 3, utratę hydrolityczną łańcucha heptanianowego i dodanie OH Przy C-14 (Tabela 1). Grupę OH umieszczono w C-3 na podstawie korelacji HMBC H3-20 (δ 0,91, d) Z C-3 (δ 71,4) (Rysunek 3). Wynikało to z redukcji karbonylu C – 3. Druga grupa OH została umieszczona w C-14, na podstawie korelacji HMBC H3-18 (δ 0,81, s) z C-14 (δ 84,8). Trzeci OH był w C-17, wynikał z hydrolitycznej utraty części heptanianowej. Grupę O-H W C-3 dedukowano jako zorientowaną α na podstawie korelacji NOESY H-3 (δ 3,69, br. s) z β-zorientowanym H-2 (δ 1,64, D) i α-zorientowanym H3-20 (δ 0,91, d) (Rysunek 4). OH-14 został wyprowadzony jako α-zorientowany, na podstawie korelacji NOESY H-9 (δ 1,32, m) z OH-14 (δ 2,66, s) (aceton-d6). Monokrystaliczna analiza dyfrakcji rentgenowskiej dodatkowo wspierała strukturę metabolitu 2, składającego się z trzech pierścieni w konformacji krzesła (A, B I C) i jednego w konformacji otoczki (D). Trzy grupy OH w C-3, C-14 i C-17 zostały przypisane, α -, α-i β-orientacja (Rysunek 5). Dane dotyczące dyfrakcji monokrystalicznej metabolitu 2 przedłożono do Cambridge Crystallographic Data Collection (CCDC 1500706). Struktura metabolitu 2 została zatem wydedukowana jako 2α-metylo-3α, 14α, 17β-trihydroksy-5α-androstan.
Rysunek 3. Kluczowe korelacje HMBC (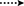 ) I COSY (
) I COSY ( ) w nowych metabolitach.
) w nowych metabolitach.
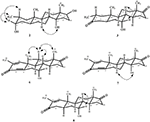
Rysunek 4. Kluczowe korelacje NOESY w nowych metabolitach.
metabolit 3 otrzymano w postaci białego ciała stałego. Hrei-MS wyświetlał at M / z 318.2192 (calcd. 318.2195, C20H30O3). Oznaczało to utratę łańcucha bocznego heptanianu i dodanie atomu tlenu w substracie 1. Widmo IR wykazało absorbcje dla OH (3436 cm−1) i karbonylów ketonowych (1711 cm−1). W widmie 1H-NMR stwierdzono brak sygnałów łańcucha heptanianowego i protonu metynowego C-17, podczas gdy nowy sygnał protonu metynowego zaobserwowano przy δ 3,92 (Tabela 1) (Karta Danych 3). Sugeruje to hydroksylację szkieletu steroidowego i oksydacyjne rozszczepienie części heptanianowej. Widmo 13C-NMR wspierało również powyższe wnioski. Stwierdzono brak sygnałów węglowych dla ugrupowania heptanianowego, podczas gdy w widmie 13C-NMR pojawiły się nowe sygnały karbonylu ketonowego i oksymetiny (Tabela 1). Wskazywało to na utleniające rozszczepienie łańcucha heptanianowego i hydroksylację w substracie 1. Nowo pojawiający się Proton metiny przy δ 3,92 (H-7) wykazywał korelacje HMBC z C-5 i C-8, co sugeruje OH Przy C-7 (Fig.3). Korelacje HMBC H3-18 i H2-16 z węglem przy δ 223,8 sugerowały węgiel ketonowy Przy C-17. OH w C-7 był dodatkowo wspierany przez korelację h-7 z H2-6 I H-8. H – 7 (δ 3.92, s) nie wykazywał korelacji z osiowo zorientowanym h-8 (δ 1.70, nakładanie się), co sugerowało orientację α OH w C-7 (Rysunek 4). Tak więc, struktura metabolitu 3 została wydedukowana jako 2α-metylo-7α-hydroksy-5α-androstan-3,17-dion.
Monokrystaliczne analizy dyfrakcji rentgenowskiej przeprowadzono również na związkach 1 i 5. Związek 1 składał się z czterech pierścieni tj. A, B, C i D o konformacjach krzesło, krzesło, krzesło i koperta. Metyl był obecny w C – 2 z orientacją Równikową. Łańcuch estru heptanianowego był obecny w C-17 pierścienia D (Fig.6). Natomiast metabolit 5 zawiera pierścienie A, B, C i D w konformacjach planer, chair, chair i envelop. Łańcuch boczny heptanianu był nieobecny w metabolicie 5 (Fig.7). Monokrystaliczne dane dyfrakcyjne metabolitów 1 i 5 poddano zebraniu danych krystalograficznych Cambridge (odpowiednio CCDC 1500705 i CCDC 1500707). Dane z monokrystalicznej analizy dyfrakcji rentgenowskiej związków 1, 2 i 5 przedstawiono w tabeli 4.
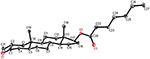
Rysunek 6. Komputerowo wygenerowany rysunek końcowego modelu rentgenowskiego związku 1. Kody kolorów: węgiel, czarny; tlen, czerwony.
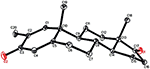
Rysunek 7. Komputerowo wygenerowany rysunek końcowego modelu rentgenowskiego związku 5. Kody kolorów: węgiel, czarny; tlen, czerwony.

Tabela 4. Monokrystaliczna analiza dyfrakcji rentgenowskiej związków 1, 2 i 5.
cytotoksyczność przeciwko rakowi HeLa, PC3, H640 i Hct116 oraz normalnym Liniiom komórkowym 3T3
produkty naturalne, np. flawonoidy, steroidy, terpeny itp. może służyć jako doskonałe źródło do produkcji wielu leków, ponieważ są one zgłaszane do wielu działań biologicznych, takich jak działania przeciwnowotworowe, przeciwzapalne, przeciwleśniackie, antybakteryjne itp. Dlatego konieczne jest ich derywatyzowanie, badanie relacji struktura-aktywność, która może być pomocna w syntezie bezpiecznych i skutecznych leków. Obecnie wiele produktów farmaceutycznych jest skutecznie syntetyzowanych poprzez biotransformację drobnoustrojów dzięki obecności w nich szeregu enzymów. Na podstawie zgłoszonych działań przeciwnowotworowych drostanolonu (9), propionianu drostanolonu i heptanianu drostanolonu (1), związki 1-9 oceniano pod kątem cytotoksyczności wobec linii komórek nowotworowych hela, PC-3, H460 i HCT116. Co ciekawe, wszystkie związki wykazywały umiarkowaną do silnej aktywność przeciwnowotworową. Działanie przeciwnowotworowe związków 1-9 wnioskowano na podstawie wartości IC50 przeciwko HeLa (rak szyjki macicy u człowieka), PC-3 (rak gruczołu krokowego u człowieka), H460 (rak płuc u człowieka) i hct116 (rak jelita grubego u człowieka) (Tabela 5). Na podstawie tych wyników, cytotoksyczność tych związków oceniano również w stosunku do normalnej linii komórkowej 3T3 (fibroblastów mysich), gdzie wszystkie związki, z wyjątkiem 8 (IC50 = 74,6 ± 3,7 µM) i 9 (IC50 = 62,1 ± 1,2 µM), okazały się niecytotoksyczne.

Tabela 5. Cytotoksyczność związków 1-9 wobec raka HeLa, PC3, H460 i hct116 oraz prawidłowych linii komórkowych 3T3.
zależność struktura-aktywność
różnice w strukturze metabolitów wpływały na ich działanie przeciwnowotworowe. Metabolit 2 bez grupy estrowej i dwie grupy ao-h W C-3 i C-14 oraz grupa ßO-h W C-17 wykazywały mniejszą cytotoksyczność wobec linii komórek nowotworowych HeLa, H460 i HCT116, ale jego aktywność przeciwnowotworowa była wyższa w stosunku do linii komórek nowotworowych PC-3 w porównaniu ze Związkiem 1. Metabolit 3 z utratą grupy estrowej i dwóch grup ketonowych w C-3 i C-17 oraz grupa aO-H W C-7 również wykazywał mniejszą aktywność wobec linii komórek nowotworowych HeLa, H460 i HCT116, ale zwiększoną aktywność wobec linii komórek nowotworowych PC-3 w porównaniu z substratem 1. Redukcja karbonylu C-3 do O-H I hydrolityczne rozszczepienie ugrupowania estrowego w związku 4 zwiększyły w pewnym stopniu jego aktywność wobec linii komórek nowotworowych HeLa i PC-3, ale jego aktywność przeciwnowotworowa wobec linii komórek nowotworowych H460 i HCT116 zmniejszyła się w porównaniu z substratem 1. Obecność C = C pomiędzy C-1/C-2 i C-4 / C-5, wraz z C = O W C-3 i C-17 sprawiła, że metabolit 5 stał się silnym środkiem przeciwnowotworowym przeciwko linii komórek nowotworowych HeLa, w porównaniu z substratem 1 i standardowym lekiem (cisplatyną). Ponadto jego aktywność przeciwnowotworowa wobec linii komórek nowotworowych PC-3 była również zwiększona w porównaniu z substratem 1. Co ciekawe, jego aktywność przeciwnowotworowa wobec linii komórek nowotworowych H460 i HCT116 była niższa w porównaniu do Związku 1. Obecność C = C pomiędzy C-1/C-2 i C-4 / C-5, C = O W C-3 i C-17, wraz z grupą ao-H W C-11 w metabolicie 6 zwiększyła jego aktywność przeciwnowotworową wobec Hela i linii komórek nowotworowych PC-3 w porównaniu z substratem 1 i wykazała podobny potencjał przeciwnowotworowy wobec linii komórek nowotworowych HeLa jak standardowy lek (cisplatyna). Jednak jego aktywność przeciwnowotworowa wobec linii komórek nowotworowych H460 i HCT116 zmniejszyła się w porównaniu do Związku 1. Obecność C = C pomiędzy C-1/C-2 i C-4 / C-5, C = O W C-3 i C-17, wraz z grupą ao-H W C-14 w metabolicie 7 ponownie zwiększyła jego aktywność przeciwnowotworową wobec Hela i linii komórek nowotworowych PC-3 oraz zmniejszyła jego aktywność przeciwnowotworową wobec linii komórkowych H460 i HCT116 w porównaniu do substratu 1. Obecność C = C w C-1 / C-2, C = O W C-3 i C-17 oraz AOH w C-7 sprawiły, że metabolit 8 był najsilniejszym lekiem przeciwnowotworowym przeciwko linii komórek nowotworowych HeLa w porównaniu do substratu 1 i standardowego leku (cisplatyna). Wykazał również dobrą aktywność przeciwko linii komórek nowotworowych PC-3, ale zmniejszył aktywność przeciwnowotworową przeciwko linii komórek nowotworowych H460 i HCT116 w porównaniu z substratem 1. Metabolit 9 z tylko hydrolizą w C – 17 wykazywał zwiększoną aktywność przeciwnowotworową wobec linii komórek nowotworowych hela, PC-3 i HCT116, ale zmniejszał cytotoksyczność wobec linii komórek nowotworowych h460 w porównaniu do substratu 1 i standardowego leku (cisplatyna). Na podstawie powyższej dyskusji można stwierdzić, że zwiększona aktywność przeciwnowotworowa związków 5-8 wobec Hela i linii komórek nowotworowych PC-3 była prawdopodobnie spowodowana obecnością C = C w C-1/C-2 oraz karbonyloketonu w C-3 i C – 17 w porównaniu z substratem 1.
wnioski
wkład autora
koncepcja prezentowanych badań została opracowana i zaprojektowana przez MIC. Mic był również kierownikiem projektu. Wszystkie dane zostały przeanalizowane i zinterpretowane przez MIC,A-t-w I HC. MS, SY, MA i NF przeprowadziły eksperymenty. Mic, A-t-W I MS napisali manuskrypt. Wszyscy autorzy poprawili manuskrypt. Ostateczna wersja rękopisu została również zatwierdzona przez MIC przed złożeniem.
Oświadczenie o konflikcie interesów
autorzy oświadczają, że badanie zostało przeprowadzone przy braku jakichkolwiek relacji handlowych lub finansowych, które mogłyby być interpretowane jako potencjalny konflikt interesów.
podziękowania
A-t-W, i MIC uznają rolę Komisji Szkolnictwa Wyższego, Islamabad, Pakistan, poprzez wsparcie finansowe w ramach, „badania nad Chemoprewencją rakotwórczości sutka przez środki dietetyczne, (20-3790/NRPU/r&D/HEC/13 / 793).”SY przyznaje wsparcie finansowe OPCW (Organizacja ds. zakazu broni chemicznej) poprzez projekt badawczy zatytułowany „strukturalne i biologiczne badania nad nowymi sterydami anabolicznymi uzyskanymi przez biotransformację.”HC potwierdza finansowe wsparcie” dziekanatu Badań Naukowych (DSR), King Abdulaziz University, Ministerstwo Edukacji, Arabia Saudyjska.”
materiał uzupełniający
Eastman, A. (1999). „Mechanizm działania cisplatyny: od adduktów do apoptozy” w Cisplatynie: Chemistry and Biochemistry of a Leading Anticancer Drug, ed B. Lippert (Zürich: Verlag Helvetica Chimica Acta), 111-134. DOI: 10.1002/9783906390420.ch4
CrossRef Full Text/Google Scholar
Vardar, E., Vardar, S. A., and Cengiz, T. (2002). Nadużywanie sterydów anaboliczno-androgennych. Anato. J. Psychiatria 3, 104-107.