os óleos biológicos são diferentes dos óleos de petróleo (gasóleo”regular”) na estrutura molecular e propriedades.

Common combustível diesel de petróleo é um mixure de hidrocarbonetos simples, com uma média de fórmula química C12H23 (mostrado abaixo), mas os componentes podem variar de cerca de C10H20 (dodecane) para C15H28(pentadecane). Em contrapartida, os óleos biológicos são ” triglicéridos “(classificados como” ésteres”) como o trilinoleato de glicerilo a seguir indicado.:
| C12H23, dodecane | Um triglicérides: trinitrato de trilinoleate |
Devido a seu grande tamanho e consequente grandes atrações intermoleculares, a viscosidade dos biológica de óleos é geralmente muito altas para o uso em motores a diesel convencionais. Os óleos biológicos também queimam um pouco menos prontamente, e com uma chama mais suave do que o diesel de petróleo. Óleos biológicos podem ser usados em motores diesel convencionais se eles são pré-aquecidos para reduzir a sua viscosidade, mas isso requer um aquecedor elétrico auxiliar até que o motor aqueça. Para estes resons, óleos bilógicos requerem processamento para uso como biodiesel.um óleo biológico é um éster, que é um tipo de composto orgânico com a ligação atômica mostrada abaixo.
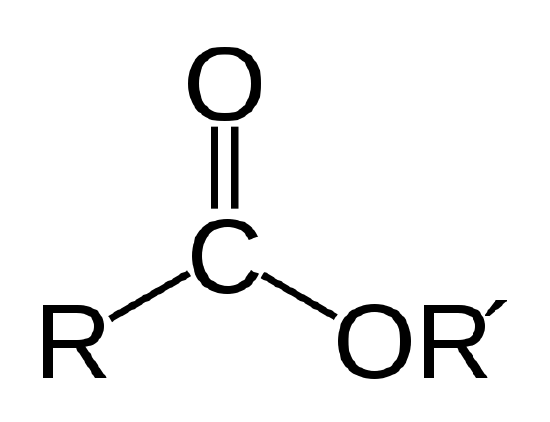 A ligação éster. R E R ‘ representam cadeias de átomos de carbono e hidrogénio. R = -CH3 e R’ = -C18H35O2 para o metil estearato no Exemplo 1 |
glicerol |
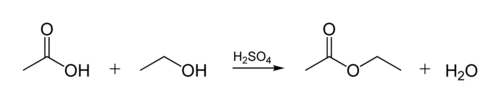
O éster ligação biológica de óleos é criado quando uma molécula de glicerol reage com ácidos orgânicos. A molécula de glicerol tem uma cadeia de 3 átomos de carbono, cada um com um grupo an-OH (álcool) nela. A figura abaixo mostra como um álcool orgânico reage com um ácido orgânico. Químicos orgânicos abreviam estruturas moleculares–as linhas ” zig-zag “na figura representam cadeias de carbono com um átomo C em cada” zig “ou”zag”. Cada carbono tem 4 ligações, e se menos de 4 são mostrados, assume-se que eles vão para átomos H. Assim, o álcool é C2H5OH (etanol), e o ácido acético (ou ethanoic ácido, CH3COOH) na Figura:
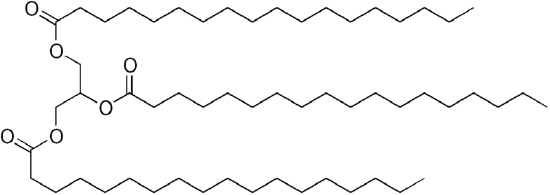
Desde o glicerol 3 -OH grupos, de 3 de cadeia longa orgânica “ácidos graxos” anexar ao fazer o volumoso “de triglicerídeos”.
Mas, tão facilmente como os ésteres podem ser feitas a partir de álcoois e ácidos, eles podem mudar de álcoois ou ácidos. Na presença de uma base forte catalisador, como o NaOH, um de triglicérides podem reagir com 3 pequenas moléculas de álcool, como o metanol (CH3OH), que substituem o glicerol “espinha dorsal”, fazendo 3 separada ésteres de menor peso molecular
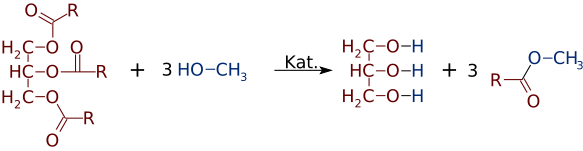
muitas vezes uma mistura de dois ou mais produtos, é formado. Por exemplo, quando um óleo vegetal reage com metanol, apenas um ou dois dos ácidos podem ser deslocados da glicerina, produzindo apenas 1 ou 2 FAMEs.
C3H5(C18H35O2)3 + NaOH + 2 CH3OH → C3H5(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH → C3H5(C18H35O2)(OH)2 + 1 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3
Normalmente, um grande excesso de metanol e hidróxido de sódio são adicionados, para que a reação produz a quantidade máxima de FAMA.
mas no caso de uma transesterificação, mesmo que nenhum dos reagentes seja completamente consumido, não ocorre mais nenhum aumento nas quantidades dos produtos. Dizemos que tal reacção não se concretiza. Quando uma mistura de produtos é produzida ou uma reação não vai para a conclusão, a eficácia da reação é geralmente avaliada em termos de percentagem de rendimento do produto desejado. Calcula-se um rendimento teórico partindo do princípio de que todo o reagente limitante é convertido em produto. O determinado experimentalmente a massa do produto é então comparado com o rendimento teórico e expressa como porcentagem:

EXEMPLO 1 Quando 100.0 g C3H5(C18H35O2)3 gás e 15,0 g CH3OH são misturados a 55°C com NaOH catalisador, eles reagem para formar 90.96 g C17H35COOCH3 metil estearato de biodiesel. Calcule a percentagem de rendimento.
solução deve-se calcular o rendimento teórico de NH3, e para fazer isso, deve-se primeiro descobrir se N2 ou H2 é o reagente limitante. Para o balanceamento de equações
C3H5(C18H35O2)3 + NaOH + 3 CH3OH → C3H5(OH)3 + 3 C17H35COOCH3 estearina + hidróxido de sódio + 3 CH3OH → glicerol + 3 metil estearato
A razão estequiométrica dos reagentes é
 Agora, a inicial quantidades de dois reagentes areand
Agora, a inicial quantidades de dois reagentes areand O rácio dos montantes iniciais é assim
O rácio dos montantes iniciais é assim uma vez que esta relação é menor do que
uma vez que esta relação é menor do que , há um excesso de CH3OH. Estearina é o reagente limitante. Por conseguinte, temos de utilizar 0,1122 mol stearin e 0,3366 mol CH3OH (em vez de 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, há um excesso de CH3OH. Estearina é o reagente limitante. Por conseguinte, temos de utilizar 0,1122 mol stearin e 0,3366 mol CH3OH (em vez de 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.