- Host Específico de Interação Entre as estirpes de rizóbios e Plantas Parceiros
- desenvolvimento de nódulos determinados e indeterminados
- o crescimento das células simbióticas envolve a amplificação do genoma do hospedeiro por ciclos de Endorreduplicação. O citoplasma de uma célula simbiótica fixadora de azoto abriga cerca de 50.000 Bacteróides. Para acomodar um número tão elevado de endossimbiontes, as células hospedeiras crescem. Nos nódulos de M. truncatula, o volume das células fixadoras de azoto é 80 vezes maior do que o das células meristemáticas diplóides. O crescimento das células infectadas ocorre passo a passo na zona II e é a consequência da endorreduplicação (ER) repetida do genoma sem mitose. Na zona II, A maquinaria do ciclo celular ainda está activa, mas a ausência de ciclinas mitóticas inibe a mitose e transforma os ciclos mitóticos em ciclos de endorreduplicação (Cebolla et al., 1999). Isto é conseguido pela troca do ciclo celular da proteína CCS52A que pela destruição das ciclinas mitóticas induz repetidas rodadas de duplicação do genoma levando à formação de células poliplóides em crescimento gradual (Roudier et al., 2003; Kondorosi and Kondorosi, 2004). Nas espécies de Medicago, os níveis de ploidia podem atingir 64C, representando um teor de ADN 64 vezes superior ao das células haplóides (C corresponde ao teor de ADN haplóide; Vinardell et al., 2003). Down-regulation CCS52A em M. truncatula não teve efeito sobre o primórdio de formação, mas foi prejudicial para o nódulo diferenciação, indicando que o ER ciclos e formação de grandes altamente polyploid células são essenciais para o nódulo funcionamento (Vinardell et al., 2003). Curiosamente, as células corticais que contêm fungos de micorrizas arbusculares também são poliploidas, bem como as células raízes gigantes alimentadoras de nemátodos (Fadery et al., 2002; Genre et al., 2008). Do mesmo modo, as células simbióticas dos insectos, os bacteriócitos que abrigam endossimbiontes intracelulares, também são grandes e poliplóides (Nakabachi et al., 2010). Nas plantas angiospérmicas, a poliploidia é frequente e o padrão hereditário específico da poliploidia em diferentes órgãos, tecidos e tipos celulares sugere que pode ser uma fonte importante da fisiologia especializada das células hospedeiras (Nagl, 1976; Edgar et al., 2014). Para além do crescimento celular, as múltiplas cópias dos genes, a falta de condensação cromossómica pode contribuir para actividades metabólicas e transcritoriais mais elevadas. No entanto, a associação da poliploidia com diferentes funções celulares sugere um impacto da poliploidia também na arquitetura dos nucleossomas e na ativação controladora epigenoma ou repressão de regiões genômicas específicas. Consequentemente, o conteúdo do genoma poliplóide das células simbióticas parece ser um pré-requisito para a diferenciação dos nódulos e para a expressão da maioria dos genes hospedeiros simbióticos (Maunoury et al., 2010). diferentes destinos de Bacteróides fixadores de azoto
- NCR247: um exemplo para o operador multi-alvo do hospedeiro
- conclusão
- Declaração de conflito de interesses
Host Específico de Interação Entre as estirpes de rizóbios e Plantas Parceiros
As bactérias que formam fixação de nitrogênio em simbiose com leguminosas plantas pertencentes a diversos grupos de α – e β-proteobacteria são coletivamente denominadas rizóbios (Chen et al., 2003; MacLean et al., 2007). Muitas α-proteobactérias estão envolvidas em interações a longo prazo com eucariotas superiores. Essas interações vão desde a colonização da superfície através de relações simbióticas facultativas para obrigar o patógeno intracelular ou estilos de vida endossimbiontes. Os genes simbióticos necessários para a formação de nódulos, infecção das células hospedeiras e fixação de nitrogênio foram adquiridos pela transferência lateral de genes, que é a principal fonte de diversidade genética de rhizobia. Portanto, a rhizobia poderia estar mais intimamente relacionada com patógenos (como Agrobacterium ou Brucella) do que uma com a outra. Rhizobia tende a ter genomas grandes (até 10.5 Mbp) que em rápido crescimento rhizobia são dispersos em múltiplas réplicas (MacLean et al., 2007). Por exemplo, Sinorhizobium meliloti, o endossimbionte da espécie Medicago, tem um genoma tripartido; um cromossomo de 3,65 Mbp e dois megaplasmídeos, pSymA e pSymB (1,35 e 1,68 Mbp), ambos são indispensáveis e carregam a maioria dos genes simbióticos. No entanto, muitas estirpes de S. meliloti contêm outros plasmídeos auxiliares de tamanho médio e, portanto, o genoma de S. meliloti pode conter até 9.000 genes (Barnett et al., 2001; Capela et al., 2001). Em contraste com rhizobia, endossimbiontes obrigatórios de insetos geralmente possuem um genoma fortemente reduzido (160-450 Kbp) que garante sua multiplicação e códigos para algumas vias biossintéticas específicas, incluindo aquelas que satisfazem a necessidade do hospedeiro (Moran et al., 2008; Price et al., 2011). Estes genomas incrivelmente reduzidos são, no entanto, amplificados compensando o genoma diminuído com um conteúdo de DNA poliplóide.
os parceiros vegetais de rhizobia pertencem à família Leguminosae / Fabaceae. A simbiose fixadora de azoto evoluiu em várias linhagens, mas nem todas as leguminosas formam simbiose. Até agora, 12.000 espécies de leguminosas noduladas são conhecidas e cada uma tem seu próprio parceiro(s) Rhizobium. A simbiose é desencadeada pela fome de nitrogênio da planta hospedeira que tem que selecionar seu parceiro de Rizóbio de bilhões de bactérias na rizosfera. Isto é conseguido pela secreção de moléculas de sinal flavonóide da raiz que agem como quimio-atrativos, mas mais importante como indutores dos genes de nodulação de Rizóbio (Oldroyd, 2013). Estes genes são necessários para a produção de moléculas de sinal bacteriano; the Nod factors (NFs) which trigger the nodule developmental program in the host plant (Walker and Downie, 2000). Os NFs são moléculas lipocitooligossacáridas que carregam substituições específicas hospedeiras nos resíduos de açúcar terminal e cadeias lipídicas características, que são reconhecidas pelos receptores hospedeiros do tipo LysM e são necessárias tanto para o desenvolvimento do nódulo e infecção bacteriana. Curiosamente, a simbiose antiga de plantas terrestres com fungos micorrízicos arbusculares (AM) opera com moléculas de sinal lipocitooligossacáridos semelhantes, os fatores Myc que são percebidos por receptores similares mas diferentes do tipo Lism como o NFs (Abdel-Lateif et al., 2012; Oldroyd, 2013). Os fatores Myc e NFs ativam uma via sinalizadora comum, mas após o envolvimento dos genes simbióticos comuns conservados em plantas, os caminhos se desviam; um levando à nodulação, o outro para a simbiose AM.a infecção vegetal e a formação de nódulos são processos intrincados.; Os fatores Nod desempenham papéis distintos na organogênese do nódulo e infecção do cabelo da raiz. Além disso, além dos fatores Nod, vários polissacáridos de superfície bacteriana são cruciais para uma infecção eficiente (Fraysse et al., 2003). Na maioria das leguminosas, a rizobia entra no hospedeiro através dos pêlos da raiz, onde por invaginação da membrana plasmática se forma um fio de infecção (IT) que contém as bactérias multiplicadoras e cresce em direção ao córtex da raiz. Um modo de infecção menos frequente e antigo ocorre através de fissuras na superfície da raiz de certas leguminosas.
desenvolvimento de nódulos determinados e indeterminados
desenvolvimento de nódulos requer reativação mitótica de células corticais levando à formação de primórdio de nódulos que então diferencia em nódulos raiz fixadores de nitrogênio fornecendo condição microaeróbica na zona central para o funcionamento da enzima nitrogenase sensível ao oxigênio nos Bacteróides. Dependendo da natureza transitória e persistente da proliferação celular Hospedeira, os nódulos podem ser determinados ou indeterminados (Terpolilli et al., 2012; Kondorosi et al., 2013). Os nódulos determinados não têm meristem e contêm uma população homogénea de células simbióticas. Os nódulos determinados desenvolvem-se, por exemplo, nas raízes de Phaseolus vulgaris e Lotus japonicus.
ao contrário, a divisão celular ativa é mantida nos nódulos indeterminados. Um merismo de nódulo está presente na região apical (zona I) que, por geração constante de novas células, provoca um crescimento contínuo e forma alongada de nódulos. As células que saem do meristem não se dividem mais e entram em uma fase de diferenciação. O fio de infecção liberta as bactérias para as células submeristemáticas, que se diferenciam gradualmente ao longo das 12-15 camadas celulares da zona de infecção (zona II), levando ao desenvolvimento de células simbióticas fixadoras de azoto na zona de nódulos III (figura 1; Franssen et al., 1992). Medicago sativa, M. truncatula, Vicia sativa, e Pisum sativum são exemplos de plantas formando nódulos indeterminados.
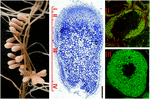
a FIGURA 1. Estrutura dos nódulos root fixadores de azoto formados na simbiose de S. meliloti-M. truncatula. As diferentes zonas dos nódulos são indicadas na secção longitudinal do nódulo: (I) meriste, (II) zona de infecção, (III) zona de fixação do azoto, (IV) zona de senescência. As células simbióticas na zona II contêm os endossimbiontes diferenciadores, enquanto na zona III o citoplasma hospedeiro está completamente cheio de Bacteróides fixadores de azoto longos. Os endossimbiontes manchados com Syto9 têm fluorescência verde.
o crescimento das células simbióticas envolve a amplificação do genoma do hospedeiro por ciclos de Endorreduplicação. O citoplasma de uma célula simbiótica fixadora de azoto abriga cerca de 50.000 Bacteróides. Para acomodar um número tão elevado de endossimbiontes, as células hospedeiras crescem. Nos nódulos de M. truncatula, o volume das células fixadoras de azoto é 80 vezes maior do que o das células meristemáticas diplóides. O crescimento das células infectadas ocorre passo a passo na zona II e é a consequência da endorreduplicação (ER) repetida do genoma sem mitose. Na zona II, A maquinaria do ciclo celular ainda está activa, mas a ausência de ciclinas mitóticas inibe a mitose e transforma os ciclos mitóticos em ciclos de endorreduplicação (Cebolla et al., 1999). Isto é conseguido pela troca do ciclo celular da proteína CCS52A que pela destruição das ciclinas mitóticas induz repetidas rodadas de duplicação do genoma levando à formação de células poliplóides em crescimento gradual (Roudier et al., 2003; Kondorosi and Kondorosi, 2004). Nas espécies de Medicago, os níveis de ploidia podem atingir 64C, representando um teor de ADN 64 vezes superior ao das células haplóides (C corresponde ao teor de ADN haplóide; Vinardell et al., 2003). Down-regulation CCS52A em M. truncatula não teve efeito sobre o primórdio de formação, mas foi prejudicial para o nódulo diferenciação, indicando que o ER ciclos e formação de grandes altamente polyploid células são essenciais para o nódulo funcionamento (Vinardell et al., 2003). Curiosamente, as células corticais que contêm fungos de micorrizas arbusculares também são poliploidas, bem como as células raízes gigantes alimentadoras de nemátodos (Fadery et al., 2002; Genre et al., 2008). Do mesmo modo, as células simbióticas dos insectos, os bacteriócitos que abrigam endossimbiontes intracelulares, também são grandes e poliplóides (Nakabachi et al., 2010). Nas plantas angiospérmicas, a poliploidia é frequente e o padrão hereditário específico da poliploidia em diferentes órgãos, tecidos e tipos celulares sugere que pode ser uma fonte importante da fisiologia especializada das células hospedeiras (Nagl, 1976; Edgar et al., 2014). Para além do crescimento celular, as múltiplas cópias dos genes, a falta de condensação cromossómica pode contribuir para actividades metabólicas e transcritoriais mais elevadas. No entanto, a associação da poliploidia com diferentes funções celulares sugere um impacto da poliploidia também na arquitetura dos nucleossomas e na ativação controladora epigenoma ou repressão de regiões genômicas específicas. Consequentemente, o conteúdo do genoma poliplóide das células simbióticas parece ser um pré-requisito para a diferenciação dos nódulos e para a expressão da maioria dos genes hospedeiros simbióticos (Maunoury et al., 2010).
diferentes destinos de Bacteróides fixadores de azoto
as bactérias libertadas do IT estão presentes no citoplasma hospedeiro como estruturas tipo organela, chamadas simbiossomas. As bactérias não têm contato direto com o citoplasma, pois estão cercadas por uma membrana peribacteróide, conhecida também como membrana simbiossoma (SM). O bacteróide, o SM e o espaço entre eles compõem o simbiossomo (Catalano et al., 2004). O SM durante sua formação reflete a origem da membrana plasmática, modificações posteriores de sua composição abrem novos papéis especializados na interface hospedeiro-endossimbionte (Limpens et al., 2009; Ivanov et al., 2012; Brear et al., 2013; Sinharoy et al., 2013). Os Bacteróides multiplicam-se nas células do nódulo hospedeiro em crescimento a uma certa densidade celular, adaptam-se ao estilo de vida endossimbiótico e às condições microaeróbicas e amadurecem a Bacteróides fixadores de azoto. A forma e a fisiologia dos Bacteróides podem ser, no entanto, muito diferentes nas várias leguminosas. Em certos hospedeiros de leguminosas, os Bacteroides fixadores de nitrogênio têm a mesma morfologia que as células cultivadas; este tipo de Bacteroides pode reverter para a forma de vida livre. Em outras Associações, os Bacteroides são irreversivelmente transformados em endossimbiontes poliplóides, ampliados, não cultiváveis. Estes Bacteroides diferenciados terminalmente podem ser alongados e até mesmo ramificados e 5 a 10 vezes mais do que as células livres ou podem ser esféricos de 8 a pelo menos 20 vezes o genoma amplificado dependendo do hospedeiro (Mergaert et al., 2006; Nakabachi et al., 2010). A diferenciação Terminal dos Bacteróides é controlada pelo hospedeiro, evoluindo em vários ramos da família Leguminosae indicando a vantagem do hospedeiro e provável maior desempenho simbiótico (Oono et al., 2010). A diferenciação bacteróide Terminal é a melhor elucidada na simbiose truncatula S. meliloti – M. Em M. nódulos de truncatula, os eventos mais visíveis da diferenciação bacteróide terminal ocorrem na zona II. A multiplicação de Bacteróides pára no meio da zona II, onde o alongamento celular e a amplificação uniforme dos múltiplos replicões por ciclos de endorreduplicação começam. Ao longo de 2-3 camadas celulares na fronteira da zona II e III (chamada interzona), o crescimento súbito de Bacteróides é visível atingindo praticamente o seu tamanho final, no entanto, a fixação de azoto ocorre apenas na zona III.a comparação de transcriptomas de nódulos de leguminosas com diferenciação bacteróide reversível e irreversível revelou a existência de várias centenas de pequenos genes que só estavam presentes no genoma das plantas hospedeiras onde a diferenciação bacteróide era terminal. In M. truncatula the nodule cells produce at least 600 nodule-specific symbiotic peptides (symPEPs). Os genes symPEP só são ativados nas células simbióticas poliploidas infectadas por S. meliloti (Kevei et al., 2002; Mergaert et al., 2003), no entanto, alguns conjuntos no início, outros durante as fases posteriores do desenvolvimento de nódulos. A large portion, more than 500 genes encode nodule-specific cysteine-rich (NCR) peptides (Mergaert et al., 2003; Alunni et al., 2007; Nallu et al., 2014). Os peptídeos NCR destinam-se aos Bacteróides e quando a sua entrega aos endossimbiontes foi bloqueada, a diferenciação bacteróide foi abolida, demonstrando que os peptídeos são responsáveis pela diferenciação terminal dos Bacteróides de S. meliloti (Van De Velde et al., 2010). A variedade de sequência elevada e os padrões característicos de expressão dos genes NCR sugerem diversidade nas suas funções, modos de acção e alvos bacterianos em diferentes fases de maturação bacteriana (Figura 2). No entanto, porque é que a célula anfitriã produz um arsenal de NCRs? Qual pode ser a vantagem de um repertório peptídico tão diversificado? É necessário para a interacção do hospedeiro com várias bactérias? Os parceiros simbióticos de M. truncatula São S. meliloti e S. medicae, no entanto, no solo existem inúmeras variantes de estirpe de ambas as espécies. M. truncatula é também representada por muitos ecotipos e adesões diferentes no número, seqüências e perfil de expressão dos genes NCR e em suas interações simbióticas com diferentes estirpes de S. meliloti E S. medicae (Nallu et al., 2014; Roux et al., 2014). Enquanto um nódulo contém um único tipo de bactéria, os diferentes nódulos no mesmo sistema radicular podem possuir populações bacterianas distintas. É possível que a planta reconhecendo os vários endossimbiontes manipula-os com um repertório específico da estirpe de peptídeos. Estas diferenças podem adicionar um nível de controlo adicional para a especificidade hospedeiro-simbionte e, assim, para a eficiência da nodulação.

FIGURA 2. Differential expression of symPEP genes in M. truncatula nódulos. Sinal negro: hibridização in situ, sinal azul: GUS atividade do promotor symPEP-GUS fusões em nódulos transgênicos.embora os symPEPs representem classes peptídicas únicas, as suas estruturas assemelham-se aos peptídeos antimicrobianos (AMPs). As AMPs com amplo espectro de atividade de occisão de células microbianas são mais freqüentemente provocadoras de morte celular catiônica por formação de poros, ruptura de membranas e conseqüente lise de células microbianas. O fato de que a capacidade de divisão celular é definitivamente perdida durante a diferenciação endossimbionte indica que pelo menos certos simpeps têm atividades antimicrobianas. O tratamento de bactérias com NCRs catiónicas sintéticas provocou, de facto, uma eliminação rápida e eficiente, dependente da dose, de várias bactérias Gram-negativas e Gram-positivas, incluindo importantes agentes patogénicos humanos e vegetais (Van De Velde et al., 2010; Tiricz et al., 2013). Este efeito de occisão ex-planta correlacionado com a permeabilização de membranas microbianas, no entanto, os symPEPs em seu ambiente natural – nas células dos nódulos – não permeabilizam as membranas bacterianas e não matam os endossimbiontes. É muito provável que as concentrações de peptídeo nos nódulos sejam significativamente inferiores às aplicadas nos ensaios in vitro. Além disso, os péptidos catiónicos são produzidos juntamente com os péptidos aniónicos e neutros na mesma célula, e a possível combinação de algumas dezenas ou centenas de péptidos com várias cargas e hidrofobicidade pode neutralizar o efeito bactericida directo dos péptidos catiónicos.
o envolvimento de AMPs ou péptidos semelhantes a AMP não é único para a simbiose das leguminosas de Rizóbio. No gorgulho Sitophilus, a simbiose com células produzem o peptídeo antimicrobiano coleoptericin-A (ColA), que provoca o desenvolvimento de gigante filamentosos endosymbionts inibindo a divisão celular e protege o vizinho de insetos tecidos de invasão bacteriana (Login et al., 2011). Neste sistema, um peptídeo único é suficiente para a diferenciação do endossimbionte verticalmente transmitido obrigatório, ao contrário dos nódulos que operam com centenas de symPEPs e podem hospedar inúmeras variantes de estirpe como seus endossimbiontes. Na simbiose aphid-Buchnera, as células hospedeiras também produzem peptídeos bacteriocitários específicos, incluindo peptídeos ricos em cisteína (BCRs) que se assemelham aos peptídeos Medicago NCR, no entanto as funções destes peptídeos simbióticos ainda não foram relatadas (Shigenobu e Stern, 2013).
NCR247: um exemplo para o operador multi-alvo do hospedeiro
análise transcriptoma de M. nódulos de truncatula em diferentes fases de seu desenvolvimento, Microdissecção laser de regiões de nódulos, hibridização in situ, imunolocalização de peptídeos selecionados, e fusão de genes promotor-repórter symPEP em nódulos transgênicos permitem mapear a ação de peptídeos individuais nas células simbióticas desde a infecção inicial até o estado de fixação tardia do nitrogênio. NCR247 é expresso nas camadas celulares mais antigas da zona II e na interzona onde a divisão celular bacteriana pára e notável alongamento dos endossimbiontes ocorre (Farkas et al., 2014). Este pequeno peptídeo catiónico matou efectivamente vários micróbios in vitro e a análise in silico indicou as suas capacidades extremas de ligação às proteínas. O FITC-rotulado NCR247 entrou no citosol bacteriano onde suas interações com numerosas proteínas bacterianas foram possíveis. Os parceiros de ligação foram identificados através do tratamento de bactérias ou Bacteróides de S. meliloti com peptídeos marcados com StrepII / bandeira, seguidos por cromatografia de afinidade e identificação de parceiros de interacção com CL-MS/MS e análise Ocidental (Farkas et al., 2014).
Um dos interactores foi a proteína da divisão celular FtsZ desempenhando um papel primário crucial na divisão celular. Sabe-se que alguns péptidos antibióticos exercem um efeito bactericida ou bacteriostático através da interacção com a FtsZ, inibindo a sua polimerização, impedindo assim a formação adequada de anel Z e septo (Handler et al., 2008). A NCR247 foi co-purificada com FtsZ do citoplasma bacteriano e demonstrou perturbar a formação do septo. NCR035 que exibem in vitro também efeito bactericida e produzido nas mesmas células simbióticas que a NCR247 acumula no septo da divisão, o que indica a acção simultânea ou consecutiva destes peptídeos e a evolução de estratégias múltiplas hospedeiras para inibir a proliferação de endossimbiontes. Outro estudo mostrou que a expressão de genes importantes da divisão celular, incluindo genes necessários para a função do anel Z, foram fortemente atenuados em células tratadas por NCR247 (Penterman et al., 2014). O pré-tratamento de bactérias com concentrações sub-letais NCR247 aboliu a localização de FITC-NCR035 ao septo e provocou alongamento celular (Farkas et al., 2014).as proteínas Ribossómicas foram os parceiros de interacção NCR247 mais abundantes. Observou-se que a NCR247 inibe fortemente a síntese proteica bacteriana de uma forma dose-dependente tanto in vivo como in vitro (Farkas et al., 2014). Estes resultados sugerem que um modo de Acção do peptídeo NCR247 se liga aos ribossomas tanto nas células bacterianas como nos Bacteróides. Curiosamente, um padrão alterado e reduzida complexidade das proteínas interagentes foram observados nos Bacteróides. Consequentemente, o nível de expressão geral das proteínas ribossómicas foi, em média, 20 vezes mais baixo nos Bacteróides do que nas células livres com abundância relativa diferente de transcrições de proteínas ribossómicas individuais. A diversificação dos ribossomas nos Bacteróides pode ter um papel significativo ao contribuir para a tradução avançada de proteínas específicas, apoiando assim a fisiologia especializada e exigente em energia da função de fixação de azoto altamente abundante.
O “GroEL chaperon” também foi um parceiro de interação direta da NCR247 (Farkas et al., 2014). Das 5 proteínas do GroEL, o GroEL1 ou o GroEL2 é suficiente para a sobrevivência, enquanto o GroEL1, expresso a um nível elevado no nódulo, é essencial para a simbiose (Bittner et al., 2007). É necessário para a ativação completa dos genes de nodulação e montagem do complexo de nitrogenase. GroEL possui extrema versatilidade funcional ao interagir com centenas de proteínas. A interação NCR247-GroEL1 pode ter consequências diretamente sobre GroEL, mas indiretamente também sobre os substratos do GroEL e os processos biológicos associados. Ausência de GroEL1 infecção bacteriana gravemente afectada e manutenção e diferenciação de Bacteróides demonstrando uma necessidade Geral de GroEL1 em todas as fases de desenvolvimento do nódulo fixador de azoto.o envolvimento dos péptidos do GroEL e do hospedeiro nas interacções do micróbio-hospedeiro não é único na simbiose do Rizóbio-legume. Nas células simbióticas dos weevil coleoptericina-a (ColA) interage também com GroEL (Login et al., 2011). GroEL também desempenha um papel importante na manutenção dos endossimbionts (Moran, 1996; Kupper et al., 2014). Como a maioria dos sistemas simbióticos ainda são inexplorados e ferramentas genômicas e proteômicas de alta produção estão disponíveis apenas recentemente, podemos apenas prever que a diferenciação endossimbionte mediada por peptídeos hospedeiros, da mesma forma a amplificação do genoma das células hospedeiras e endossimbiontes terminalmente diferenciados são estratégias gerais de simbiose.
conclusão
bactérias simbióticas e patogénicas utilizam abordagens semelhantes para interagir com os seus hospedeiros e sobreviver dentro das células hospedeiras, mesmo que os resultados destas interacções sejam muito diferentes. Plantas e Animais podem gerar respostas imunitárias inatas a microorganismos sobre a percepção de MAMPs (padrões moleculares associados ao microorganismo). Esta percepção resulta na ativação de cascatas sinalizadoras e na produção de efetores antimicrobianos. Péptidos hospedeiros semelhantes a AMP, como o M. os peptídeos truncatula NCR ou o peptídeo antimicrobiano weevil ColA desempenham papéis fundamentais e multifacetados no controlo da multiplicação e diferenciação dos endossimbiontes, restringindo assim a presença de bactérias às células simbióticas. Assim, os organismos hospedeiros utilizam esses péptidos efetores para domesticar e até mesmo contratar invasores microbianos selecionados para o serviço.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.o trabalho nos nossos laboratórios é apoiado pela subvenção avançada”SYM-BIOTICS” do Conselho Europeu de investigação a Éva Kondorosi (número de subvenção 269067) e por TÁMOP-4.2.2.A-11/1 / KONV-2012-0035 apoiado pela União Europeia e co-financiado pelo Fundo Social Europeu.
Abdel-Lateif, K., Bogusz, D., and Hocher, V. (2012). O papel dos flavonóides no estabelecimento de endossimbioses de raízes vegetais com fungos de micorrizas arbusculares, rizobia e bactérias Frankia. Sinal Da Planta. Behav. 7, 636–641. doi: 10.4161 / psb.20039
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alunni, B., Kevei, Z., Redondo-Nieto, M., Kondorosi, A., Mergaert, P., and Kondorosi, E. (2007). Genomic organization and evolutionary insights on GRP and NCR genes, two large nodule-specific gene families in Medicago truncatula. Mol. Plant Microbe Interact. 20, 1138–1148. doi: 10.1094/MPMI-20-9-1138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barnett, M. J., Fisher, R. F., Jones, T., Komp, C., Abola, A. P., Barloy-Hubler, F., et al. (2001). Sequência nucleotídica e funções previstas de todo o Sinorhizobium meliloti pSymA megaplasmid. Procedimento. Natl. Acad. Ciência. U. S. A. 98, 9883-9888. doi: 10.1073 / pnas.161294798
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Bittner, A. N., Foltz, A., and Oke, V. (2007). Apenas um dos cinco genes do groEL é necessário para a viabilidade e simbiose bem sucedida no Sinorhizobium meliloti. J. Bacteriol. 189, 1884–1889. doi: 10.1128 / JB.01542-06
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brear, E. M., Day, D. A., and Smith, P. M. (2013). Iron: an essential micronutrient for the legume-Rhizobium symbiosis. Front. Plant Sci. 4:359. doi: 10.3389/fpls.2013.00359
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Catalano, C. M., Lane, W. S., and Sherrier, D. J. (2004). Biochemical characterization of symbiosome membrane proteins from Medicago truncatula root nodules. Electrophoresis 25, 519–531. doi: 10.1002/elps.200305711
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Capela, D., Barloy-Hubler, F., Gouzy, J., Bothe, G., Ampe, F., Batut, J.,et al. (2001). Analysis of the chromosome sequence of the legume symbiont Sinorhizobium meliloti estirpe 1021. Procedimento. Natl. Acad. Ciência. U. S. A. 98, 9877-9882. doi: 10.1073 / pnas.161294398
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Cebolla, A., Vinardell, J. M., Beijo, E., Oláh, B., Roudier, F., Kondorosi, A.,et al. (1999). O inibidor mitótico ccs52 é necessário para a endorreduplicação e ampliação celular dependente da ploidia nas plantas. EMBO J. 18, 4476-4484. doi: 10.1093/emboj/18.16.4476
CrossRef Texto Completo
Chen, W. M., Moulin, L., Bontemps, C., Vandamme, P., Béna, G., e Boivin-Masson, C. (2003). A fixação do azoto simbiótico das leguminosas por proteobactérias β é generalizada na natureza. J. Bacteriol. 185, 7266–7272. doi: 10.1128 / JB.185.24.7266-7272.2003
CrossRef Texto Completo
Edgar, B. A., Zielke, N., e Gutierrez, C. (2014). Endociclos: a recurrent evolutionary innovation for post-mitotic cell growth. Conversao. Rev. Mol. Celula. Biol. 15, 197–210. doi: 10.1038/nrm3756
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Farkas, A., Maróti, G., Dürgõ, H., Györgypál, Z.; Lima, R. M., Medzihradszky, K. F.,et al. (2014). O peptídeo simbiótico Medicago truncatula NCR247 contribui para a diferenciação bacteróide através de múltiplos mecanismos. Procedimento. Natl. Acad. Ciência. U. S. A. 111, 5183-5188. doi: 10.1073 / pnas.1404169111
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Favery, B., Complainville, A., Vinardell, J. M., Lecomte, P., Vaubert, D., Mergaert, P.,et al. (2002). The endosymbiosis-induced genes ENOD40 and CCS52a are involved in endoparasitic-nematode interactions in Medicago truncatula. Mol. Plant-Microbe Interact. 15, 1008–1013. doi: 10.1094/MPMI.2002.15.10.1008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franssen, H. J., Vijn, I., Yang, W. C., and Bisseling, T. (1992). Developmental aspects of the Rhizobium-legume symbiosis. Plant Mol. Biol. 19, 89–107. doi: 10.1007
CrossRef Full Text
Fraysse, N., Couderc, F., and Poinsot, V. (2003). Surface polysaccharide involvement in establishing the Rhizobium–legume symbiosis. Eur. J. Biochem. 270, 1365–1380. doi: 10.1046/j.1432-1033.2003.03492.x
CrossRef Full Text
Genre, A., Chabaud, M., Faccio, A., Barker, D. G., and Bonfante, P. (2008). O conjunto do aparelho de pré-enetração precede e prevê os padrões de colonização dos fungos micorrízicos arbusculares dentro do córtex raiz de Medicago truncatula e Daucus carota. Plant Cell 20, 1407-1420. doi: 10.1105/tpc.108.059014
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Handler, A. A., Lim, J. E., and Losick, R. (2008). Inibidor do peptídeo da citoquinese durante a esporulação em Bacillus subtilis. Mol. Microbiol. 68, 588–599. doi: 10.1111 / J. 1365-2958. 2008. 06173.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ivanov, S., Fedorova, E. E., Limpens, E., De Mita, S., Genre, A., Bonfante, P.,et al. (2012). Rhizobium–legume symbiosis shares an exocytotic pathway required for arbuscule formation. Proc. Natl. Acad. Sci. U.S.A. 109, 8316–8321. doi: 10.1073/pnas.1200407109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kevei, Z., Vinardell, J. M., Kiss, G. B., Kondorosi, A., and Kondorosi, E. (2002). Proteínas ricas em glicina codificadas por uma família genética específica de nódulos estão envolvidas em diferentes fases de desenvolvimento simbiótico de nódulos em Medicago spp. Mol. O Micróbio Da Planta Interage. 15, 922–931. doi: 10.1094 / MPMI.2002.15.9.922
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kondorosi, E., and Kondorosi, A. (2004). Endoreduplicação e ativação do complexo de promoção da anáfase durante o desenvolvimento de células simbióticas. FEBS Lett. 567, 152–157. doi: 10.1016 / j. febslet.2004.04.075
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kondorosi, E., Mergaert, P., and Kereszt, A. (2013). Um paradigma para a vida endossimbiótica: diferenciação celular de bactérias Rizóbias provocadas por fatores vegetais hospedeiros. Annu. Rev. Microbiol. 67, 611–628. doi: 10.1146/annurev-micro-092412-155630
CrossRef Texto Completo
Kupper, M., Gupta, S. K., Feldhaar, H., e Gross, R. (2014). Papéis versáteis do GroEL da chaperonina em interações microorganismo-inseto. HEMS Microbiol. Lett. 353, 1–10. doi: 10.1111/1574-6968.12390
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Limpens, E., Ivanov, S., van Esse, W., Voets, G., Fedorova, E., e Bisseling, T. (2009). Medicago N2-fixing symbiosomes adquirem o marcador de identidade endocítica Rab7, mas atrasam a aquisição da identidade vacuolar. Plant Cell 21, 2811-2828. doi: 10.1105/tpc.108.064410
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Login, F. H., Balmand, S., Vallier, A., Vincent-Monégat, C., Vigneron, A., Weiss-Gayet, M., et al. (2011). Os peptídeos antimicrobianos mantêm os endossimbiontes dos insectos sob controlo. Science 334, 362-365. doi: 10.1126 / science.1209728
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
MacLean, A. M., Finan, T. M., and Sadowsky, M. J. (2007). Genomas das bactérias simbióticas fixadoras de nitrogénio de leguminosas. Plant Physiol. 144, 615–622. doi: 10.1104/pp. 107.101634
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Maunoury, N., Redondo-Neto, M., Bourcy, M., Van de Velde, W., Alunni, B., Laporte, P., et al. (2010). A diferenciação de células simbióticas e endossimbiontes são acoplados a dois interruptores de transcriptoma na nodulação de Medicago truncatula. PLoS ONE 5: e9519. doi: 10.1371 / journal.pone.0009519
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Mergaert, P., Nikovics, K., Kelemen, Z., Maunoury, N., Vaubert, D., Kondorosi, A.,et al. (2003). Uma nova família em Medicago truncatula consistindo de mais de 300 genes específicos de nódulos codificando para pequenos polipeptídeos segregados com motivos de cisteína conservada. Plant Physiol. 132, 161–173. doi: 10.1104/pp.102.018192
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mergaert, P., Uchiumi, T., Alunni, B., Evanno, G., Cheron, A., Catrice, O.,et al. (2006). Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis. Proc. Natl. Acad. Sci. U.S.A. 103, 5230–5235. doi: 10.1073/pnas.0600912103
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Moran, N. A. (1996). Evolução acelerada e ratchet de Muller em bactérias endossimbióticas. Procedimento. Natl. Acad. Ciência. U. S. A. 93, 2873-2878. doi: 10.1073 / pnas.93.7.2873
CrossRef Texto Completo
Moran, N. A., McCutcheon, J. P., e Nakabachi, A. (2008). Genómica e evolução de simbiontes bacterianos hereditários. Annu. Rev. Genet. 42, 165–690. doi: 10.1146 / annurev.genet.41.110306.130119
CrossRef Texto Completo
Nakabachi, A., Koshikawa, S., Miura, T., e Miyagishima, S. (2010). Tamanho do genoma da Pachypsylla venusta (Hemiptera: Psyllidae) e a ploidia do seu bacteriócito, a célula hospedeira simbiótica que alberga bactérias mutualistas intracelulares com o menor genoma celular. Touro. Entomol. Res. 100, 27-33. doi: 10.1017 / S0007485309006737 Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Nagl, W. (1976). Endorreduplicação de DNA e politenia entendida como estratégias evolucionárias. Nature 261, 614-615. doi: 10.1038/261614a0
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Nallu, S., Silverstein, K. A. A língua oficial nesta comuna é o alemão. Padrões de divergência de uma grande família de peptídeos ricos em nódulos nas adesões de Medicago truncatula. Plant J. 78, 697-705. doi: 10.1111 / tpj.12506
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Oldroyd, G. E. (2013). Fale, amigo, e entre: sistemas de sinalização que promovem associações simbióticas benéficas em plantas. Conversao. Rev. Microbiol. 11, 252–263. doi: 10.1038/nrmicro2990
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Oono, R., Schmitt, I., Sprent, J. I., and Denison, R. F. (2010). Multiple evolutionary origins of legume traits leading to extreme rhizobial differentiation. New Phytol. 187, 508–520. doi: 10.1111/j.1469-8137.2010.03261.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Penterman, J., Abo, R. P., De Nisco, N. J., Arnold, M. F., Longhi, R., Zanda, M.,et al. (2014). Os péptidos da planta hospedeira provocam uma resposta transcriccional para controlar o ciclo celular de Sinorhizobium meliloti durante a simbiose. Procedimento. Natl. Acad. Ciência. U. S. A. 111, 3561-3566. doi: 10.1073 / pnas.1400450111
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Price, D. R., Duncan, R. P., Shigenobu, S., and Wilson, A. C. (2011). Expansão do genoma e expressão diferencial dos transportadores de aminoácidos na interface simbiótica aphid/buchnera. Mol. Biol. Evol. 28, 3113–3126. doi: 10.1093/molbev/msr140
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roudier, F., Fedorova, E., Lebris, M., Lecomte, P., Györgyey, J., Abad, P.,et al. (2003). The Medicago species A2-type cyclin is auxin regulated and involved in meristem formation but dispensable for endoreduplication-associated developmental programs. Plant Physiol. 131, 1091–1103. doi: 10.1104/pp.102.011122
CrossRef Full Text
Roux, B., Rodde, N., Jardinaud, M. F., Timmers, T., Sauviac, L., Cottret, L.,et al. (2014). An integrated analysis of plant and bacterial gene expression in symbiotic root nódulos using laser-capture microdissection acoplado to RNA sequencing. Plant J. 77, 817-837. doi: 10.1111 / tpj.12442
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Shigenobu, S., and Stern, D. L. (2013). Os pulgões desenvolveram novas proteínas secretadas para simbiose com endossimbionte bacteriano. Procedimento. Biol. Ciência. 280, 20121952. doi: 10.1098 / rspb.2012.1952
Pubmed Resumo | Pubmed Texto Completo | CrossRef Texto Completo
Sinharoy, S., Torres-Jerez, I., Bandyopadhyay, K., Kereszt, A., Pislariu, C. I., Nakashima, J.,et al. (2013). O regulador do factor de transcrição C2H2 da diferenciação simbiossoma reprime a transcrição da via secreta gene VAMP721a e promove o desenvolvimento do simbiossoma na Medicago truncatula. Planta Cela 25, 3584-3601. doi: 10.1105/tpc.113.114017
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Terpolilli, J. J., Hood, G. A., and Poole, P. S. (2012). What determines the efficiency of N(2)-fixing Rhizobium-legume symbioses? Adv. Microb. Physiol. 60, 325–389. doi: 10.1016/B978-0-12-398264-3.00005-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiricz, H., Szûcs, A., Farkas, A., Pap, B., Lima, R. M., Maróti, G.,et al. (2013). Antimicrobial nodule-specific cysteine-rich peptides induce membrane depolarization associated changes in Sinorhizobium meliloti. Appl. Env. Microbiol. 79, 6737–6746. doi: 10.1128/AEM.01791-13
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Van de Velde, W., Zehirov, G., Szatmari, A., Debreczeny, M., Ishihara, H., Kevei, Z.,et al. (2010). Plant peptides govern terminal differentiation of bacteria in symbiosis. Science 327, 1122–1126. doi: 10.1126/science.1184057
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vinardell, J. M., Fedorova, E., Cebolla, A., Kevei, Z., Horvath, G., Kelemen, Z.,et al. (2003). A endoreduplicação mediada pelo activador complexo de promoção da anáfase CCS52A é necessária para a diferenciação simbiótica das células nos nódulos de Medicago truncatula. Plant Cell 15, 2093-2105. doi: 10.1105/tpc.014373
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Walker, S. A., and Downie, J. A. (2000). Entrada de Rhizobium leguminosarum bv. viciae Em pelos raiz requer uma especificidade mínima do fator Nod, mas subsequente crescimento do fio de infecção requer nodO ou nó. Mol. Planta-Micróbio Interagem.13, 54–62. doi: 10.1094 / MPMI.2000.13.7.754
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text