- Introdução
- Análise de deslocamento electrocrómico
- análise estatística
- resultados
- discussão
- o papel da estimulação da CEF a uma luz baixa
- a alteração na razão de oxidação P700 a baixa luz não está relacionada com pmf
- ETRII controla a razão de oxidação P700 a baixa luz
- Conclusion
- contribuições do autor
- Declaração de conflito de interesses
Introdução
Embora a luz é a força motriz da fotossíntese, a luz alta pode causar significativo photoinhibition de photosystem II (PSII) para folhas de sombra-o estabelecimento de plantas (Kitao et al., 2000; Barth et al., 2001; Krause et al., 2004; Huang et al., 2015b, 2016b, c). No entanto, PSII photoinibited recupera rapidamente em baixa luz (He e Chow, 2003).; Zhang and Scheller, 2004, Allakhverdiev et al., 2005), devido à rápida taxa de rotação da proteína D1 (Aro et al., 1993; Zhang and Scheller, 2004; Allakhverdiev et al., 2005). A taxa de reparação do PSII foi reduzida após a inibição da síntese do ATP quer via PSI quer PSII (Alakhverdiev et al., 2005), indicando que a reparação rápida de complexos PSII fotodamaged precisa de uma grande quantidade de ATP em um curto período de tempo. Um estudo anterior indicou que após a fotoinibição induzida pela refrigeração do PSII, o fluxo de elétrons cíclicos (CEF) foi significativamente estimulado durante a recuperação a baixa luz (Huang et al., 2010). It was proposed that this stimulation of CEF at low light enhanced the synthesis of ATP for the fast repair of PSII (Huang et al., 2010). No entanto, mais evidências são necessárias para clarificar o papel específico da estimulação da CEF a baixa luz após a fotoinibição da PSII.durante o CEF, os electrões da NADPH ou da ferredoxina são ciclados em torno da PSI para o pool de plastoquinona. Esta transferência de elétrons é acoplada à translocação de prótons e gera um gradiente de prótons através das membranas thylakoid (ΔpH) (Shikanai e Yamamoto, 2017). Além de contribuir com a síntese de ATP, outra função do ΔpH é a Down-regulation do transporte de elétrons fotossintéticos acidificando o lúmen tilacóide (Shikanai, 2014, 2016). Este Regulamento envolve dois mecanismos diferentes: um Está ligado à dissipação de energia térmica e dissipa o excesso de energia absorvida como o calor de antenas PSII (Takahashi et al., 2009), e o outro é down-regulation da atividade complexa Cyt b6/f e controla a taxa de transferência de elétrons para PSI (Suorsa et al., 2012, 2016; Tikkanen e Aro, 2014). Em angiospérmicas, incluindo Arabidopsis thaliana, duas vias de Transporte Eletrônico PSI Cíclico estão operando (Shikanai, 2007). A primeira via CEF é a via dependente da PGR5-/PGRL1 sensível à antimicina a (Munekage et al., 2002; Sugimoto et al., 2013), e o outro é dependente do complexo chloroplast NADH desidrogenase (NDH) (Burrows et al., 1998; Shikanai et al., 1998). A contribuição da via dependente do PGR5 – /PGRL1 é mais significativa nas plantas C3. Sob alta luz, a ativação do CEF dependente do PGR5 – /PGRL1 induz a acidificação do lúmen tilacóide e, assim, leva aos altos níveis da razão de oxidação P700 (Suorsa et al., 2012, 2016; Kono et al., 2014; Yamori et al., 2016). Por comparação, a razão de oxidação P700 a baixa luz foi pouco afetada pela deficiência em CEF dependente de PGR5-/PGRL1 (Munekage et al., 2002, 2004; Kono et al., 2014). Após a fotoinibição moderada da PSII, a estimulação da CEF a baixa luz foi acompanhada com um aumento na ração de oxidação P700 (Huang et al., 2010). No entanto, não é claro se este aumento da razão de oxidação P700 é causado pela estimulação da CEF.
além do CEF, a transferência de elétrons de PSII (ETRII) desempenha um papel importante na afetação do estado redox de PSI (Tikkanen et al., 2014; Huang et al., 2016a, c; Suorsa et al., 2016). Em plantas da Pgr5 de A. thaliana, é provável que a fotoinibição severa de PSII funcione como o controle final da transferência de elétrons fotossintéticos, permitindo a manutenção de P700 oxidado otimicamente sob excesso de luz (Tikkanen et al., 2014). Recentemente, Suorsa et al. (2016) indicou que as plantas pgr5 apresentavam alta razão de oxidação P700 sob alta luz quando o ETRII foi reduzido combinando mutações knockouts em PsbO1, PsbP2, PsbQ1, PsbQ2 e PsbR loci. Em folhas refrigeradas de tabaco, a fotoinibição moderada de PSII reduziu o fluxo de elétrons para PSI e, em seguida, aumentou a razão de oxidação de P700 durante outros tratamentos de refrigeração (Huang et al., 2016a). Além disso, a fotoinibição de PSII induzida por refrigeração levou a uma depressão de ETRII, que foi acompanhada com um aumento na razão de oxidação P700 a baixa luz (Huang et al., 2010). Nós imaginamos que a razão de oxidação P700 a baixa luz é controlada principalmente pelo fluxo de elétrons de PSII.no nosso relatório anterior, observámos que a planta de criação de sombra Panax notoginseng mostrou uma fotoinibição selectiva de PSII sob forte pressão da luz. Após a exposição a curto prazo ao stress de alta luz, ETRII a baixa luz diminuiu significativamente, mas a CEF foi significativamente estimulada. Concomitantemente, a razão de oxidação P700 aumentou em grande parte. Nossos objetivos específicos foram (1) investigar se a estimulação do CEF a baixa luz principalmente facilita a síntese de ATP; and (2) determine whether the increase in P700 oxidation ratio upon moderate PSII photoinhibition is more related to ETRII rather than the CEF stimulation or the change in pmf. Para responder a estas questões, as folhas intactas de Panax notoginseng foram tratadas a 2258 µmol fótons m-2 s-1 durante 30 minutos. Antes e depois do tratamento com alta luz, foi determinada a distribuição de energia em PSII, o estado redox da força motriz de PSI e protões (pmf) a uma luz baixa de 54 µmol fótons m-2 s-1.no presente estudo, foram utilizadas plantas com 2 anos de idade com Panax notoginseng (Burkill) F. H. Chen ex C. Chow e W. G. Huang para experiências. Estas plantas foram cultivadas em condições de luz solar de 10% (com intensidade de luz média máxima de aproximadamente 200 µmol fótons m-2 s-1). Nenhuma pressão de água e nutrição foi experimentada para estas plantas. As folhas totalmente expandidas com 9 semanas de idade foram usadas para as medições fotossintéticas.as medições do fotossistema I e do PSII foram registadas simultaneamente a 25°C utilizando um sistema de medição duplo PAM-100 (Heinz Walz GmbH, Effeltrich, Alemanha). Os parâmetros de fluorescência da clorofila foram calculados do seguinte modo: Fv/Fm = (Fm – Fo)/Fm, Y(II) = (Fm’ – Fs)/Fm’ (Genty et al., 1989), NPQ = (Fm – Fm’)/Fm’. Fo e Fm são a fluorescência mínima e máxima após aclimatação a escuro, respectivamente. Fs é a fluorescência em estado estacionário adaptada à luz. Os Fo e Fm foram determinados após aclimatação escura durante 30 minutos antes e depois do tratamento com alta luz. Os parâmetros fotossintéticos da PSI foram medidos por dupla PAM-100 com base no sinal P700 (diferença de intensidades de 830 e 875 nm de luz de medição modulada por impulsos atingindo o fotodetector) (Klughammer e Schreiber, 2008). Os sinais P700+ (P) podem variar entre um mínimo (P700 totalmente reduzido) e um nível máximo (P700 totalmente oxidado). O nível máximo (Pm) foi determinado com a aplicação de um pulso de saturação (600 ms e 10000 µmol fótons m-2 s-1) após a pré-iluminação com luz muito vermelha, e as Pm foram utilizadas para estimar a atividade PSI. Pm ‘ foi determinado semelhante à Pm, mas com luz actínica em vez de luz muito vermelha. The quantum yield of PSI was calculated as Y (I) = (Pm’- P)/Pm. A razão de oxidação P700 numa dada Luz actínica foi calculada como Y (ND) = p/Pm. O rendimento quântico da dissipação de energia não fotoquímica PSI devido à limitação do lado do aceitador foi calculado como Y (NA) = (Pm-Pm’)/Pm. Os valores em estado estacionário para Y(II), NPQ, Y(I) e Y(ND) foram medidos após aclimatação da luz a uma luz baixa durante 20 minutos.
fluxo de elétrons fotossintéticos através de PSI e PSII foram calculados como: ETRII = Y (II) ×PPFD ×0,84 ×0,5 (Krall e Edwards, 1992), ETRI = Y (I) ×PPFD×0,84 ×0,5 (Yamori et al., 2011), onde 0,5 é assumido como sendo a proporção de luz absorvida alcançando PSI ou PSII, e 0,84 como sendo a absorvância (a fração da luz incidente absorvida pelas folhas). A extensão da activação do CEF foi estimada como razão ETRI/ETRII (Yamori et al., 2011, 2015). Note-se que o particionamento de excitação 1:1 entre PSI e PSII pode não ser real, porque as plantas de sombra tendem a aumentar a razão PSII/PSI (Lunde et al., 2003; Tikkanen et al., 2006; Grieco et al., 2012). Além disso, neste estudo, os parâmetros PSI e PSII foram medidos utilizando a luz actínica vermelha (635 nm) fornecida pela Dual-PAM 100 (Walz, Alemanha). Como a luz actínica vermelha favorece a excitação de PSII sobre a de PSI, a distribuição de energia de excitação de LHCII a PSII e PSI pode ser afetada pela luz actínica vermelha (Tikkanen et al., 2017).
Análise de deslocamento electrocrómico
o sinal ECS foi monitorizado à medida que a mudança de absorvância a 515 nm, utilizando um duplo PAM-100 (Walz, Effeltrich, Alemanha) equipado com um módulo P515/535 detector de emissores (Walz). O sinal ECS foi obtido após 20 minutos de iluminação a 54 µmol fótons m-2 s-1, depois o decaimento ECS foi medido desligando a luz actínica durante 30 s. a análise da cinética de relaxamento do intervalo ECS escuro (DIRKECS) foi feita pelo método de Sacksteder et al. (2001) and Takizawa et al. (2008). O total de pmf foi estimado a partir da amplitude total do decaimento rápido do sinal ECS durante o intervalo escuro de 300 ms. O relaxamento lento do sinal ECS permitiu reconhecer a contribuição do gradiente de protões através das membranas tilacóides (ΔpH). A constante de tempo do relaxamento ECS de primeira ordem (tECS) é inversamente proporcional à condutividade de prótons (gH+) da membrana tilacóide através da ATP sintase (Sacksteder e Kramer, 2000; Cruz et al., 2005). Como resultado, GH+ foi estimado como o inverso da constante de tempo de decaimento .os tratamentos Fotoinibitórios após aclimatação escura durante 30 minutos, FV/Fm e Pm foram medidos em folhas intactas. Posteriormente, estas folhas intactas foram adaptadas à luz a 59 µmol fótons m-2 s – 1 durante 20 minutos e foram registados parâmetros de fluorescência Clorofila, sinal P700 e sinal ECS. Em seguida, a luz actínica foi alterada para 2258 µmol fótons m-2 s-1. Após a exposição a esta luz elevada durante 30 minutos, a luz actínica foi alterada para 59 µmol fotões m-2 s-1 imediatamente e os parâmetros fotossintéticos foram registados após a aclimatação da luz durante 20 minutos. Finalmente, FV / Fm e Pm foram medidos após aclimatação escura durante 30 minutos.
análise estatística
os resultados foram apresentados como valores médios de cinco experiências independentes. O teste t independente foi utilizado a um nível de significância α = 0, 05 para determinar se existiam diferenças significativas entre os diferentes tratamentos. Todas as análises estatísticas foram realizadas utilizando SPSS 16.0.resultados
resultados
durante a indução fotossintética a 59 µmol fótons m-2 s-1, ETRII aumentou gradualmente e atingiu um estado estacionário em cerca de 18 minutos (figura 1A). Por comparação, o ETRI foi constante durante esta fase de indução (figura 1A). Após o início desta luz baixa, ETRI foi muito maior do que ETRII. No entanto, após uma indução fotossintética de 20 minutos, o ETRI foi inferior ao ETRII. Estes resultados sugeriram a ativação do CEF durante a fase inicial de indução, de acordo com estudos anteriores (Joliot e Joliot, 2002, 2005; Makino et al., 2002). Após esta indução fotossintética a baixa luz, as folhas foram iluminadas a uma alta luz de 2258 µmol fótons m-2 s-1 durante 30 minutos. Curiosamente, ETRII diminuiu gradualmente durante o tratamento com luz elevada (figura 1B). Entretanto, o valor do ETRI foi superior ao do ETRII (figura 1B), indicando a ativação do CEF sob luz alta. Após este tratamento de alta luz, o P700 (Pm) fotooxidável máximo foi mantido estável (figura 2A). Em comparação,a intensidade máxima de fluorescência (Fm) diminuiu 40% e o rendimento quântico máximo de PSII (Fv/Fm) diminuiu de 0,80 para 0,65 (figuras 2B, C). Estes resultados indicaram a fotoinibição seletiva de PSII em folhas de Panax notoginseng sob tensão de alta luz.
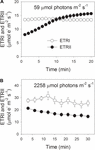
a FIGURA 1. Fluxo fotossintético de elétrons a baixa luz (A) e alta luz (B). A) as folhas de aclimatação escura foram expostas a uma luz baixa de 59 µmol fotões m-2 s-1 durante 20 minutos. B) Após a iluminação a 59 µmol fótons m-2 s-1 durante 20 minutos para activar o dissipador de electrões na fotossíntese, as folhas foram expostas a uma luz elevada de 2258 µmol fótons m-2 s-1 durante 30 minutos. Os valores são médias ± SE (n = 5).
Antes da alta-luz de tratamento, folhas maduras foram iluminados em uma luz fraca das 59 µmol fótons m-2 s-1 por 20 min para ativar a fotossíntese e, em seguida, os valores para ETRI, ETRII, Y(ND), e NPQ foram registrados. Após tratamento com alta luz durante 30 minutos, foram registados valores para ETRI, ETRII, Y(ND) e NPQ após uma nova fase de aclimatação de 20 minutos a baixa luz. Antes do tratamento com alta luz, os valores para ETRI e ETRII a 59 µmol fótons m-2 s-1 eram 13,4 e 15,7 µmol electrões m-2 s-1, respectivamente (figuras 3A,B). Após tratamento de alta luz, ETRI e ETRII a baixa luz foram 12,8 e 11,2 µmol elétrons m-2 s-1,respectivamente (figuras 3A, B). O valor de ETRII a 59 µmol fótons m-2 s-1 diminuiu cerca de 30% após o tratamento fotoinibitório, indicando a depressão de ETRII sobre a fotoinibição moderada de PSII. Antes do tratamento com alta luz, o valor da razão ETRI/ETRII a 59 µmol fótons m-2 s-1 era de 0, 85 (figura 3C). Após o tratamento fotoinibitório, a razão ETRI/ETRII aumentou significativamente para 1, 14 (figura 3C). Estes resultados sugeriram a estimulação da CEF a baixa luz sobre a fotoinibição de PSII (Yamori et al., 2011, 2015).
após o tratamento com luz elevada, o valor em estado estacionário de Y (I) a 59 µmol fótons m-2 s-1 não se alterou (figura 4A). Curiosamente, Y(AN), diminuiu significativamente a partir de 0,36 para 0.23 (Figura 4B), e Y(ND) aumentou significativamente a partir de 0,1 a 0,25 (Figura 4C). Estes resultados indicaram a alteração do estado redox da PSI com luz baixa após o tratamento fotoinibitório. Entretanto, o valor da NPQ mudou ligeiramente (figura 4D). Como resultado, a fotoinibição moderada de PSII teve efeitos diferentes na razão de oxidação P700 e NPQ a luz baixa.
No fim de esclarecer se o aumento em Y(ND) é causado por um aumento na pmf, o eletrocrômico shift sinais 54 µmol fótons m-2 s-1 foram determinados de luz após a aclimatação durante 20 min antes e após a alta-luz de tratamento. Curiosamente, o total de pmf diminuiu significativamente 18% após tratamento de luz elevada (figura 5A), mas o nível ΔpH mudou insignificantemente (figura 5B). Como a formação de pmf pode ser afetada pela condutividade do próton tilacóide, a condutividade do próton (gH+) da membrana tilacóide a esta luz baixa também foi examinada antes e depois do tratamento com alta luz. O resultado mostrou que o gH+ não mudou com o tratamento de alta luz (figura 5C), sugerindo que o tratamento de alta luz dificilmente afetou a atividade do cloroplasto ATP sintase a baixa luz. Uma vez que a diminuição de 30% em ETRII foi acompanhada por uma diminuição de 18% em pmf, a estimulação de CEF a luz baixa compensou parcialmente a formação de pmf e ΔpH.

FIGURA 5. Valores para a força motriz total de protões (pmf) (a), o gradiente de protões (ΔpH) através das membranas tilacóides (B), e a condutividade de protões (gH+) da membrana tilacóide (C) à luz baixa. Todos os parâmetros foram medidos após adaptação a 54 µmol fotões m-2 s – 1 durante 20 minutos. Os valores são médias ± SE (n = 5). O asterisco indica uma alteração significativa (p < 0, 05) após o tratamento com alta luz.
discussão
o papel da estimulação da CEF a uma luz baixa
tem sido indicado que a CEF desempenha papéis importantes na sustentação da fotossíntese e do crescimento das plantas (Yamori e Shikanai, 2016). Sob a luz alta, o CEF é agora considerado essencial para equilibrar o orçamento de energia ATP/NADPH, bem como para proteger PSI e PSII de danos (Munekage et al., 2002, 2004; Takahashi et al., 2009; Suorsa et al., 2012, 2016; Walker et al., 2014; Huang et al., 2015a, 2017b). Em baixa intensidade de luz, CEF desempenha um papel importante na otimização da assimilação de CO2 fotossintética, provavelmente através do fornecimento de ATP extra (Yamori et al., 2011, 2015; Nishikawa et al., 2012; Huang et al., 2015a). O papel principal do MIE é modulado de forma flexível em resposta à intensidade da luz. Em particular, o CEF contribui principalmente para equilibrar o orçamento de energia ATP/NADPH sob intensidades de luz sub-saturadas, mas protege principalmente os aparelhos fotossintéticos contra a fotoinibição quando expostos a intensidades de luz saturadas através da acidificação do lúmen tilacóide (Huang et al., 2015a). Curiosamente, Huang et al. (2010) found that CEF was significantly stimulated at low light after chilling-induced photoinhibition of PSII and hypothesized that this CEF stimulation mainly enhanced the synthesis of ATP for the fast repair of PSII. No entanto, mais evidências foram necessárias para apoiar esta hipótese. No presente estudo, observou-se que o valor de ETRI/ETRII a uma luz baixa aumentou significativamente (figura 3C), indicando a estimulação da CEF em torno da PSI (Huang et al., 2011, 2012,2017a, b; Yamori et al., 2011, 2015). Concomitantemente, a amplitude da pmf diminuiu significativamente e a ΔpH diminuiu ligeiramente. Estes resultados indicaram que a estimulação do CEF não desencadeou a regulação descendente ΔpH-dependente do transporte fotossintético de electrões. Em outras palavras, esta estimulação de CEF a baixa luz facilitou principalmente a síntese de ATP.
embora a condutividade de protões da ATP sintase do cloroplasto não tenha sido afectada pelo tratamento de alta luz, o tamanho menor da pmf resultou numa diminuição na taxa real de síntese de ATP. As taxas de reparo PSII e assimilação fotossintética de CO2 a baixa luz são limitadas principalmente pela taxa de síntese ATP (Allakhverdiev et al., 2005; Yamori et al., 2011, 2015; Nishikawa et al., 2012). Como o ETRII diminuiu significativamente com a fotoinibição de PSII, a taxa de síntese de ATP via ETRII foi notavelmente reduzida. A fim de equilibrar a razão ATP / NADPH necessária pelo metabolismo primário e a rápida reparação do PSII, é necessário um mecanismo flexível para fornecer ATP extra. Nesta condição, ETRII diminuiu 30%, mas o total de pmf diminuiu apenas 18%. Estes resultados indicam que a estimulação do CEF compensou a redução na formação ETRII-dependente de pmf, aumentando a síntese de ATP. A reparação rápida de PSII fotodamaged é dependente da síntese de ATP (Allakhverdiev et al., 2005). A aceleração da CEF em torno da PSI aumentou a concentração intracelular de ATP, acelerando assim a taxa de reparo da PSII em Sinechocistis (Allakhverdiev et al., 2005). Em conjunto, propomos que a estimulação do CEF a baixa luz desempenha um papel importante na rápida reparação da actividade do PSII através de uma síntese adicional de ATP.
a alteração na razão de oxidação P700 a baixa luz não está relacionada com pmf
um fenómeno interessante é que a razão de oxidação P700 a baixa luz aumentou significativamente com a fotoinibição moderada de PSII (Huang et al., 2010), que também é mostrado no presente estudo. Em condições em que a luz absorvida excede os requisitos para a fotossíntese, a geração dependente do CEF de ΔpH para baixo-regula a actividade do complexo Cyt b6/f e controla o fluxo de electrões de PSII para PSI (Suorsa et al., 2012, 2016; Shikanai, 2014, 2016), otimizando o estado redox de P700 em PSI e minimizando a produção de ROS em PSI durante a fotossíntese. Em pgr5-plantas de A. thaliana, P700 é reduzido por elétrons na luz devido à perda de geração de pmf. No entanto, no pgr5 mutante acumulando proteína flavodiron, o nível de pmf também foi restaurado para o nível de tipo selvagem, e assim P700 foi oxidado como no tipo selvagem (Yamamoto et al., 2016). Em linhas mutantes de trigo com deficiência em clorofila b, um gradiente insuficiente de protões tilacóides leva a uma redução excessiva do lado aceitador de PSI e, portanto, fotoinibição PSI sob alta luz ou alta temperatura (Brestic et al., 2015, 2016). Recentemente, alguns estudos relataram que o aumento da atividade da chloroplast ATP sintase prejudicada a formação de pmf e causou a mais-redução da fotossíntese cadeia de transporte de elétrons, resultando em photodamage de PSI sob a luz alta e as variações de luz (Kanazawa et al., 2017; Takagi et al., 2017). Estes relatórios suportam o papel crítico de pmf na manutenção de P700 oxidado otimicamente sob excesso de energia luminosa.
os nossos resultados actuais indicaram que, após o tratamento de luz elevada durante 30 minutos,o total de pmf formado a esta luz baixa diminuiu significativamente e a formação de ΔpH mudou ligeiramente (figuras 5A, B). Entretanto, a razão de oxidação P700 aumentou significativamente de 0, 1 (antes do tratamento) para 0, 25 (após o tratamento) (figura 4C). Estes resultados indicam fortemente que este aumento na razão de oxidação P700 não pode ser explicado pela mudança na pmf, que é amplamente diferente da correlação entre Y(ND) e pmf sob alta luz (Yamamoto et al., 2016; Takagi et al., 2017). Portanto, o efeito regulador de pmf na razão de oxidação P700 é mínimo a luz baixa, mas torna-se particularmente crucial sob luz alta ou flutuante. Sob alta luz, um alto valor de Y(ND) é geralmente acompanhado com um alto valor de NPQ (Munekage et al., 2002, 2004; Kono et al., 2014; Zivcak et al., 2015), devido ao aumento de pmf. A diminuição da formação ΔpH conduz a níveis reduzidos de Y(ND) e NPQ sob luz elevada (Suorsa et al., 2012; Kono et al., 2014; Yamamoto et al., 2016; Kanazawa et al., 2017). A indução do NPQ a uma luz baixa é determinada principalmente pelo nível de acidificação do lúmen. Após tratamento com luz elevada, a extensão da acidificação do lúmen não se alterou (figura 5B) e o NPQ manteve-se estável (figura 4D). Em comparação, Y (ND) aumentou significativamente. Estes resultados indicam que a luz baixa, Y(ND) e NPQ foram controlados por diferentes mecanismos regulatórios.
ETRII controla a razão de oxidação P700 a baixa luz
PSI torna-se excessivamente reduzida apenas quando o fluxo de elétrons de PSII excede a capacidade de aceitadores de elétrons de PSI para lidar com os elétrons. Quando o fluxo de elétrons para PSI é limitado, PSI é extremamente tolerante contra o estresse de luz nas plantas pgr5 de A. thaliana (Suorsa et al., 2012, 2016; Tikkanen et al., 2014). Para a planta de criação de sombra Psychotria rubra, a atividade PSI foi insusceptível a estresse de alta luz na presença de DCMU (Huang et al., 2016c). Em folhas refrigeradas de tabaco, a fotoinibição moderada de PSII permitiu a manutenção de P700 oxidado de forma ótima e, em seguida, protegida a atividade PSI contra a fotodamagem adicional (Huang et al., 2016a). Estes resultados indicaram o importante papel do ETRII no controlo do estado redox da PSI sob tensões de luz alta ou de refrigeração-luz. Nossos resultados atuais mostraram que a fotoinibição moderada de PSII levou a uma depressão significativa de ETRII a baixa luz. Enquanto isso, a atividade PSI e a atividade do cloroplasto ATP sintase mudaram ligeiramente, e o total de pmf e ΔpH não aumentou. Como resultado, a redução do ETRII não foi causada pelo controlo fotossintético dependente do ΔpH através do complexo Cyt b6/f, Mas foi provavelmente induzida pela diminuição da actividade PSII (Tikkanen et al., 2014). A diminuição do fornecimento de elétrons de PSII a PSI levou ao aumento do nível de oxidação de P700. Assim, a razão de oxidação P700 a baixa luz foi controlada em grande parte por ETRII.
Conclusion
We found that the selective photoinhibition of PSII induced a stimulation of CEF and an increase in P700 oxidation ratio at low light. A estimulação do CEF não desencadeou a regulação do transporte fotossintético de elétrons dependente do ΔpH. Como resultado, esta estimulação de CEF a baixa luz facilitou principalmente a síntese de ATP, que é essencial para a rápida reparação de PSII fotodamaged. O aumento da razão de oxidação P700 não pôde ser explicado pela mudança no controle fotossintético dependente de ΔpH no complexo Cyt b6/f, Mas foi causado principalmente pela diminuição do fornecimento de elétrons de PSII para PSI.
contribuições do autor
WH, S-BZ, E TL concebeu e projetou a pesquisa. O WH e o Y-JY conduziram as experiências. WH, Y-JY, S-BZ, E TL analisaram os dados. WH escreveu o primeiro rascunho do manuscrito, que foi intensamente editado por todos os autores.este estudo foi apoiado pela National Natural Science Foundation of China (31670343), Youth Innovation Promotion Association of the Chinese Academy of Sciences (2016347), and the Major Science and Technique Programs in Yunnan Province (2016ZF001).
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
Kono, M., Noguchi, K., and Terashima, I. (2014). Roles of the cyclic electron flow around PSI (CEF-PSI) and O2-dependent alternative pathways in regulation of the photosynthetic electron flow in short-term Floating light in Arabidopsis thaliana. Physiol Das Células Da Planta. 55, 990–1004. doi: 10.1093/pcp / pcu033
PubMed Abstract | CrossRef Full Text/Google Scholar
Shikanai, T. (2016). Regulatory network of proton motive force: contribution of cyclic electron transport around phosystem I. Photosynth. Res. 129, 253-260. doi: 10.1007/s11120-016-0227-0
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Yamori, W., Makino, A., e Shikanai, T. (2016). A physiological role of cyclic electron transport around photosystem I in sustaining photosynthesis under Floating light in rice. Ciência. Rep. 6:20147. doi: 10.1038/srep20147
PubMed Abstract | CrossRef Full Text/Google Scholar
Yamori, W., and Shikanai, T. (2016). Funções fisiológicas do transporte cíclico de electrões em torno do fotossistema I, sustentando a fotossíntese e o crescimento das plantas. Annu. Rev. Plant Biol. 67, 81–106. doi: 10.1146/annurev-arplant-043015-112002
PubMed Resumo | CrossRef Texto Completo | Google Scholar
Yamori, W., Shikanai, T., e Makino, A. (2015). O fluxo de elétrons cíclicos do sistema fotossistema I através do complexo tipo NADH desidrogenase-cloroplastasto desempenha um papel fisiológico para a fotossíntese a baixa luz. Ciência. Rep. 5:13908. doi: 10.1038/srep13908
PubMed Abstract | CrossRef Full Text/Google Scholar
Zhang, S. P., and Scheller, H. V. (2004). Photoinibition of phosystem I at chilling temperature and subsequent recovery in Arabidopsis thaliana. Physiol Das Células Da Planta. 45, 1595–1602. doi: 10.1093/pcp/pch180
PubMed Abstract / CrossRef Full Text | Google Scholar