Se você desenvolver produtos — dispositivos médicos, particularmente — então você ouviu os Termos validação do projeto e verificação do projeto (também chamado V&V). Aqui vamos explicar quais são as duas atividades, a diferença entre elas, além de compartilhar dicas para tirar o máximo proveito de seus esforços.Nota: Para validar que este conteúdo possa ser útil para você, estamos conectados com Megan Martin, um dispositivo médico V&V Consultor com mais de 30 anos de experiência no dispositivo médico V&V, dispositivo médico, software, produto e a qualidade do software e dos EUA e internacionais dispositivo submissões regulatórias. Você vai encontrar suas idéias e exemplos durante todo o processo!
seguir ou saltar para a secção que procura:
- validação do projecto vs. verificação do projecto
- Qual é exactamente a validação do projecto?o que é a verificação de Design para a FDA?
- Validação vs Resumo de Verificação
- conceitos Básicos de Design Processo de Validação
- conceitos Básicos de Design de Processo de Verificação
- 6 Dicas para Melhor Validação & Verificação
- Vídeo: Simplificar V & V
- V&V: Glossário de Termos
- Validação de Projeto versus Verificação do Projeto: Qual a Diferença?
- o que é exactamente a validação do projecto?
- Design Validation Example
- Necessidade do Usuário
- o que é a verificação do Design para a FDA?
- exemplo de verificação do projeto
- Requisitos de Produto
- Especificações de Design
- validação vs Resumo de verificação
- conceitos Básicos de Design Processo de Validação
- os princípios básicos do processo de verificação do projeto
- o planeamento
- 6 Dicas para Melhor Validação & Verificação
- Plan Ahead (and Test Early)
- Use Shared Nomenclature
- Use ferramentas com rastreabilidade final-a-final
- a Construir o Seu Rastreamento Matriz Como Você Ir
- integrar requisitos rastreabilidade & Testing With Anomaly Tracking
- Escolher Ferramentas que Você Pode Personalizar o Seu Método
- juntando Tudo Isso
- Simplificar V&V Com Hélice ALM
- V&V: Glossary of Terms
- Comuns de Validação de Projeto Siglas
Validação de Projeto versus Verificação do Projeto: Qual a Diferença?
Qual é a diferença entre validação e verificação? Simplificando, a validação do design determina se você está construindo o produto certo. O dispositivo funciona como previsto para os utilizadores finais? A verificação de Design determina se você está construindo o produto direito. As saídas de projecto correspondem às entradas de projecto?
essa é a diferença simples como claramente representada no gráfico abaixo.
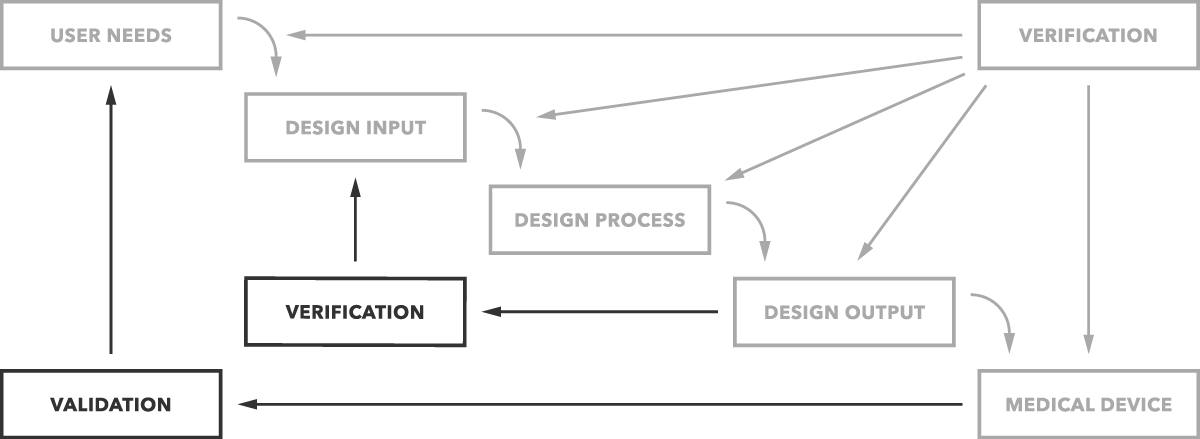
Mas você quer mais detalhes e exemplos, é claro. Vamos começar com a validação.
o que é exactamente a validação do projecto?
validação do desenho é um processo de teste pelo qual você prova (“validar”) que o dispositivo que você construiu funciona para o usuário final como pretendido.
a palavra oficial da FDA(21 CFR 820.3) afirma que a validação do projeto é “estabelecer por evidência objetiva que as especificações do dispositivo estão em conformidade com as necessidades do Usuário e a (s) utilização (ões) pretendida (s).”
Design Validation Example
let’s imagine we’re building a ventilator that keeps a patient breathing, and that the user wants it to work during patient transport.
primeiro, temos de definir as nossas necessidades do utilizador. O usuário quer mover os pacientes enquanto eles estão no ventilador. Mas o que é que eles estão realmente a tentar fazer? “Transporte” pode incluir mover o paciente dentro do hospital. Ou pode incluir o transporte via ambulância ou por via aérea. Um usuário precisa, por exemplo, pode parecer com o seguinte.
Necessidade do Usuário
| UsNe-0001 | O ventilador é adequado para uso durante a internação, de transporte de doentes. |
Este utilizador terá de ser discriminado em requisitos de produto e especificações de projecto, a fim de conceber e construir o produto. (Vamos ver isso em um momento sob verificação de design.)
antes disso, vamos examinar a necessidade do nosso Usuário e ver quais os casos de teste de validação de design podem ser necessários. O teste de validação da necessidade do nosso Utilizador pode parecer-se com isto.
| Usuário Precisa |
Validação Teste |
||
|---|---|---|---|
| UsNe-0001 | O ventilador é adequado para uso durante a internação, de transporte de doentes.conjunto de ensaios de validação: teste de que o ventilador pode ser facilmente rolado por 15 membros do pessoal dos transportes hospitalares.conjunto de ensaios de validação: Teste que o ventilador funciona dentro das suas especificações enquanto é rolado para baixo corredores, sobre engarrafamentos de portas, e sobre os limiares do elevador.conjunto de ensaios de validação: ensaio de que o ventilador funciona de acordo com as suas especificações, durante a transição entre a energia de CORRENTE ALTERNADA e o funcionamento da bateria. | ||
O teste de validação incluiria casos de teste, suites de teste, ou mesmo ensaios clínicos concebidos para provar que o produto, tal como construído, funciona de acordo com as expectativas do utilizador nas condições em que pretendem usá-lo. Uma vez que estes testes devem ser realizados em unidades de produção ou equivalentes, os testes de validação do projeto são frequentemente os últimos testes realizados. basicamente, na validação do design, precisamos demonstrar que o produto satisfaz as necessidades do Usuário. a propósito, a tabela acima também mostra a rastreabilidade entre as necessidades do Usuário e os casos de teste. This trace matrix provides part of the V&V evidence that the FDA requires.
o que é a verificação do Design para a FDA?
verificação do projeto é onde você testa (“verificar”) que as suas saídas de projeto correspondem às suas entradas de projeto.mais uma vez, de acordo com a FDA, a verificação do projeto é “confirmação por exame e fornecimento de evidências objetivas de que os requisitos especificados foram cumpridos.”
tenha em mente que, embora envolva testes, existem outras atividades de verificação aceitáveis.
podem incluir testes, inspeções e análises (para mais informações, consulte a orientação de controle de projeto da FDA).
exemplo de verificação do projeto
vamos voltar ao nosso exemplo do ventilador. Identificamos nossas necessidades de usuário; agora vamos identificar o que o dispositivo tem que fazer e como ele tem que fazer.para isso, precisamos definir requisitos específicos do produto. Por exemplo:
- Qual é a carga máxima para um paciente? (Quanto ar o ventilador precisa se mover?)
- Quanto tempo a bateria precisa durar? (Quanto tempo demora o transporte?que Condições irão encontrar durante o transporte? (Porta bloqueia? Elevadores?existem normas regulamentares que precisam de ser cumpridas? (Normas de segurança?)
“requisitos claros, completos, inequívocos e testáveis são um componente chave de um projeto de desenvolvimento bem sucedido. Requisitos inadequados levam a perda de tempo, Erros de design, grande retrabalho e produtos frágeis ou propensos a erros.”- Megan Martin, V &V Consultant
esta é a parte” o que ” da definição das características do dispositivo. O que exatamente o dispositivo precisa fazer? Os requisitos de produto (muitas vezes incluídos em um documento de requisitos de produto) para a nossa necessidade de usuário pode parecer abaixo.
Requisitos de Produto
|
PrRq-0001 |
O ventilador deve ter uma configuração máxima de 2 litros de volume-controlado respirações às 20 respirações por minuto. |
|
PrRq-0002 |
Finalmente, precisamos de especificação de projeto. “Já definimos o que vamos alcançar, e agora precisamos definir como vamos fazê-lo”, diz Megan. Isto pode ser realizado de uma variedade de maneiras, incluindo especificações escritas, Desenhos elétricos ou mecânicos, especificações de compra de componentes, ou outros métodos.
Por exemplo, as especificações de projeto e desenhos podem mostrar o seguinte.
Especificações de Design
|
DSpec-0001 |
Uma turbina que pode gerar até 40 litros de ar por minuto. |
|
DSpec-0002 |
|
|
DSpec-0003 |
|
|
DSpec-0004 |
|
|
DSpec-0005 |
a verificação do projecto fornece provas (resultados do ensaio) de que as saídas do projecto (produto real) satisfazem as entradas do projecto (requisitos do produto e especificações do projecto). Dependendo do item a ser verificado, um caso de teste ou conjunto de teste seria executado, ou uma inspeção ou análise feita para fornecer as provas necessárias. as tabelas abaixo ilustram como isso pode parecer. Eles também mostram a rastreabilidade que a FDA espera.
| requisitos do Produto | Teste de Verificação | ||
|---|---|---|---|
| PrRq-0001 | O ventilador deve ter uma configuração máxima de 2 litros de volume controlada respirações às 20 respirações por minuto.caso de ensaio: verificar as condições máximas de respiração ou combinações das condições de respiração. | ||
| PrRq-0002 | O ventilador deve funcionar com a potência da bateria em parâmetros máximos durante um mínimo de 90 minutos.conjunto de ensaios: Verificar o tempo de execução em configurações máximas com uma bateria nova totalmente carregada.conjunto de ensaios: verificar o tempo de execução em configurações máximas com uma bateria que passou por 50 ciclos de carga.o ventilador deve poder ser montado num suporte de rolamento.ensaio de demonstração: demonstrar que o ventilador pode ser ligado e destacado do suporte de rolamento.o ventilador e o descanso devem ser capazes de atravessar os limites típicos das portas hospitalares e dos elevadores.ensaio externo: ensaio executado por um serviço de ensaio para verificar o ventilador e o descanso pode ser rolado sobre um limiar sem inclinação de acordo com a norma Eléctrica médica IEC 60601-1. | ||
a Verificação dos requisitos do produto, acima, mostra que o produto faz o que disse que faria.
A Verificação das especificações de design, que vamos mostrar a seguir, mostra que o produto o faz da maneira que dissemos que o faria.
| Especificação de Design | Teste de Verificação | ||
|---|---|---|---|
| DSpec-0001 | Uma turbina que pode gerar de 40 litros de ar por minuto.conjunto de ensaios: verificar a produção de ar por turbina a 40 lpm, quer com a energia de CORRENTE ALTERNADA, quer com a energia da bateria. | ||
| DSpec-0002 | a lithium ion battery pack rated for 100 Amp Hours.teste de inspecção: verificar a aquisição da bateria o tipo é de ião de lítio.ensaio de análise: recolher dados de ensaio e efectuar análises de dados para demonstrar que o desempenho da bateria durante a vida da bateria irá cumprir ou exceder 100 horas de Amp. | ||
| DSpec-0003 | a montagem para o Suporte de rolamento usa um grampo de alavanca de aço classificado para 22 lbs.ensaio de inspecção: a especificação da parte de verificação é para uma pinça de acção da alavanca de aço com uma tensão igual ou superior a 22 lbs. | ||
| DSpec-0004 | a base do suporte tem 22″ de largura com 5 rodas. |
TCase-0013 |
um Caso de Teste: Medir o diâmetro da base; contagem de rodas; medida diâmetro da roda |
| DSpec-0005 | stand rodas de 4″ de diâmetro. | ||
, Essencialmente, na verificação do projeto, precisamos demonstrar que o produto que criamos é o produto que disse que iria construir.
Quando recolhida em conjunto num relatório V & V, A combinação de resultados de testes de verificação e validação, juntamente com a rastreabilidade de volta às necessidades do utilizador, requisitos de produto e especificações de design, fornece parte da evidência que a FDA requer ao apresentar um dispositivo médico para eliminação.
validação vs Resumo de verificação
Aqui está um breve, se ligeiramente simplificado, resumo das diferenças-chave.
|
Design Verification |
Design Validation |
|
Design output is as expected. |
Final design meets user’s needs. |
|
System, subsystem and unit testing. |
System testing. |
|
During development. |
After development. |
|
Test individual module or completed system under any conditions. |
Test conditions per user needs. |
|
inclui Inspecções do sistema, análises e ensaios. |
inclui ensaios de unidades equivalentes de produção em condições de Utilização real. |
|
inclui relatórios de testes realizados, resultados de testes e rastreabilidade. Os relatórios são revistos, aprovados e assinados. |
inclui o relatório final, com resultados de ensaio e rastreabilidade, pronto para revisão regulamentar. Os relatórios são revistos, aprovados e assinados. |
conceitos Básicos de Design Processo de Validação
O design do processo de avaliação em grande parte consiste em testar o dispositivo. Você pode conduzir isso de algumas maneiras, dependendo das circunstâncias. As atividades podem incluir:
- comparando com equipamentos similares que executam para fins semelhantes.
- simulando funcionalidade através de modelagem matemática.testando o projeto final para provar que o sistema funciona conforme definido nas necessidades do Usuário.o plano de ensaio, os casos de ensaio, os registos de execução dos ensaios e os resultados dos ensaios devem ser documentados e mantidos como parte dos registos de projecto. A validação, na sua totalidade, não é o resultado de uma única actividade, mas a recolha de resultados de todas as actividades de validação.
os princípios básicos do processo de verificação do projeto
a verificação pode ser reduzida a um simples processo de cinco etapas. identificar e preparar a melhor abordagem para a realização da verificação. Defina o que você vai medir e como você vai medi-lo. Você também vai querer considerar os recursos necessários, mão de obra e ferramentas para verificação bem sucedida.
o planeamento
o planeamento para verificação ocorre ao longo do ciclo de vida do projecto. Você vai desenvolver o plano de teste, que captura Marcos críticos. O plano deve ser atualizado sempre que sejam feitas alterações para projetar entradas.começa o desenvolvimento do produto! É conduzido usando a metodologia de escolha (Scrum, Cachoeira, híbrido, etc.). Esta parte do processo também inclui a escrita, condução de testes, e aprovação dos casos de teste que serão utilizados para verificação.os procedimentos de ensaio são executados conforme planeado. Quaisquer resultados inválidos são documentados e revisados, e são aceitos ou registrados como defeitos. Os defeitos no produto são resolvidos e liberados, e o teste de regressão é realizado. É criada uma matriz de rastreabilidade para verificar se as entradas de projeto identificadas no plano de teste de verificação foram testadas e aprovadas.O Relatório é efectuado no final de cada fase de verificação. Relatórios detalhados incluem relatórios de gerenciamento de configuração e lançamento, resultados de testes por tipo de teste ou versão do produto, e problemas encontrados durante a atividade de verificação. Um relatório de rastreabilidade da verificação da concepção mostra os resultados dos ensaios e a cobertura dos Requisitos. Por último, as revisões são completadas e aprovadas após cada atividade de verificação do projeto.
6 Dicas para Melhor Validação & Verificação
Aqui estão algumas dicas para garantir que você obtenha o máximo de sua validação & actividades de verificação.
Plan Ahead (and Test Early)
Have a solid plan upfront and loop everyone in. Incluir engenheiros de teste no início do planejamento de desenvolvimento para garantir que os requisitos e design são claros, completos e testáveis. Diz Megan, ” o desenvolvimento precoce de métodos de teste pode lançar luz sobre os problemas tecnológicos antes que eles se tornem grandes obstáculos.”O desenvolvimento precoce de testes também pode fornecer ferramentas de teste. Estes podem então ser usados para acelerar o processo de desenvolvimento do produto, bem como fornecer provas de teste durante os testes formais.
Getting your team on the same page is critical to successful design validation & verification. Parte de entrar na mesma página significa usar uma terminologia compartilhada. O uso dos mesmos termos elimina a confusão para os membros da equipe (não apenas para os novos membros — veteranos, também). Veja abaixo o glossário de termos e acrónimos comuns para ajudar a desenvolver a sua base de terminologia.
Use ferramentas com rastreabilidade final-a-final
na sua forma mais simples, a rastreabilidade pode ser alcançada com documentos do word e folhas de cálculo, mas geram tanto trabalho manual (e são tão propensos a erros) que você vai desejar começar com uma ferramenta dedicada.
“uma matriz de traço precisa é inestimável quando se faz a análise de regressão para determinar o que deve ser re-testado após uma mudança de produto ou uma correção de bug.”–Megan Martin, V&V Consultor
Usando uma ferramenta com forte requisitos-para-teste-para-resultados do rastreio recurso vai ajudar você a identificar furos na cobertura e dar avisos antecipados sobre frágil ou não testados áreas no produto.
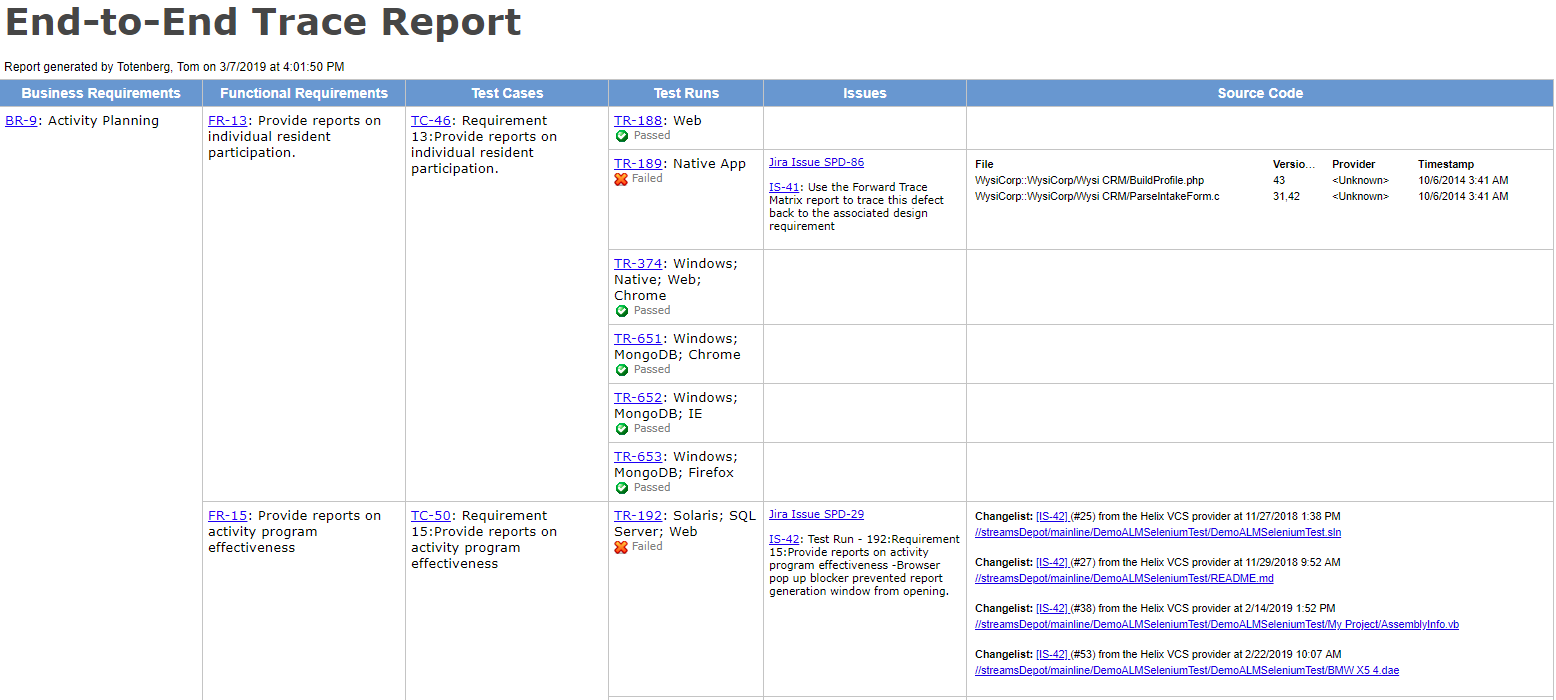
Ferramentas com ponta-a-ponta rastreabilidade simplificar o desenvolvimento de dispositivos. Relatório de rastreio mostrado na Helix ALM. end-to-end de rastreabilidade agora
a Construir o Seu Rastreamento Matriz Como Você Ir
“pode ser tentador para colocá-lo fora, mas não espere para construir seu traço da matriz!”diz Megan. Construir a sua rastreabilidade à medida que você vai vai manter os buracos de se desenvolver despercebido. Poucas coisas são mais difíceis de recuperar do que descobrir que você perdeu requisitos críticos, características de mitigação de risco, ou testes essenciais apenas quando você acha que seu trabalho de desenvolvimento está completo.é preciso muito menos esforço de manutenção para manter a rastreabilidade à medida que os seus requisitos, projetos e testes evoluem do que para remendar buracos críticos no design e desenvolvimento à 11ª hora. Este esforço também pode ajudá-lo a identificar quanto trabalho resta, onde você pode precisar adicionar desenvolvimento ou equipe de teste, ou quando você deve reavaliar os horários de entrega.
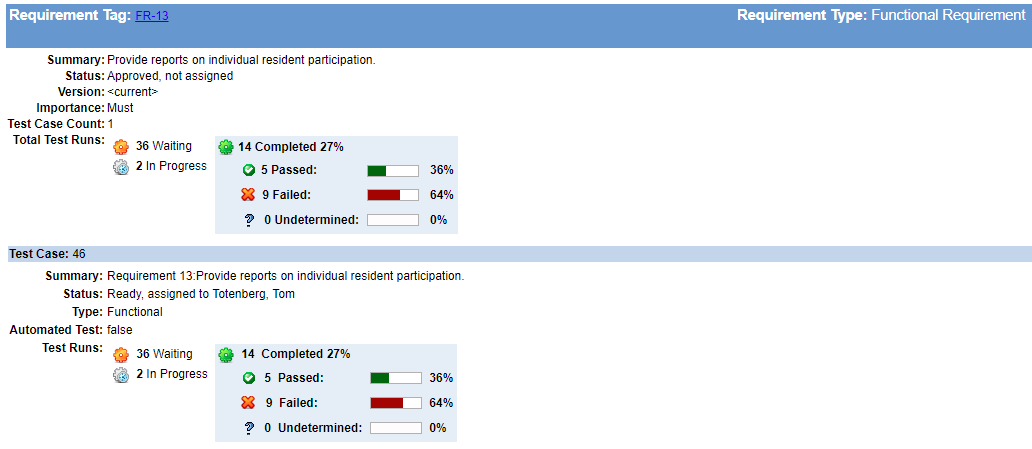
evite emergências da 11ª hora! Aqui, o estado é rastreado entre os requisitos & testes completos em Helix ALM. integrar requisitos rastreabilidade & Testing With Anomaly Tracking
ser capaz de ligar anomalias diretamente a um requisito melhora a comunicação entre testadores e desenvolvedores. É extremamente útil. Gerar anomalias diretamente a partir de uma falha do protocolo de teste significa que mais detalhes sobre o problema é capturado. Como resultado, os problemas podem ser mais facilmente documentados, reproduzidos, corrigidos e re-testados.
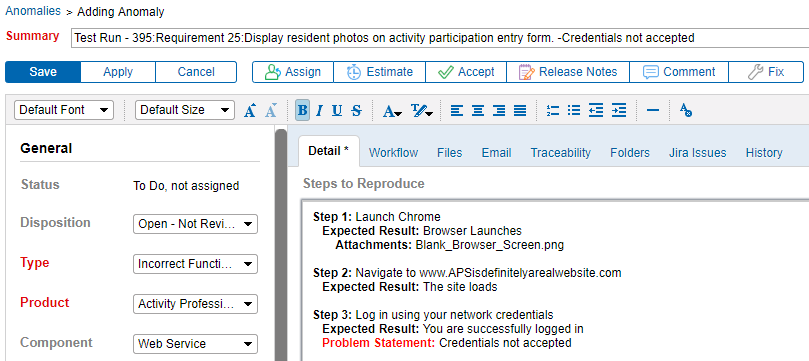
Uma anomalia criada a partir de uma falha de teste, como mostrado na Hélice de ALM. Escolher Ferramentas que Você Pode Personalizar o Seu Método
“Qualquer que seja o modelo de desenvolvimento que você selecionou — Ágil, iterativo, modificado Cachoeira — você quer escolher V&V ferramentas que servir, adaptando-se ao seu processo, ao invés de forçá-lo a adaptar o processo para servir a ferramenta”, aconselha Márcia.
As ferramentas de desenvolvimento de dispositivos médicos que você escolher devem adicionar à precisão e eficácia do trabalho que sua equipe está fazendo, e não adicionar sobrecarga desnecessária para suas tarefas diárias. Uma boa ferramenta fornece carris de guarda para garantir que as coisas importantes são sempre feitas. Ele dá flexibilidade à sua equipe para produzir visualizações e relatórios ad hoc para melhor usar (e explorar) os dados que você capturou. Ele fornece V&V captura e reporte de dados direcionados para tornar a produção de relatórios simples e repetível.
demore o seu tempo para definir como deseja que as ferramentas apoiem a sua equipa antes de escolher. Em seguida, configure suas ferramentas para as necessidades de sua equipe.
Ágil, Cachoeira, híbrido? Escolha ferramentas que se encaixem no seu processo. Aqui, placas de sprint opcionais em Helix ALM. juntando Tudo Isso
validação e verificação de projetos são componentes essenciais de um bem-sucedido desenvolvimento de dispositivos. Com a compreensão compartilhada entre a equipe, bem como as ferramentas certas, você tem uma estrutura sólida para colocar seu dispositivo no mercado.
ASSISTIR a TODO O DEMO AGORA >>Simplificar V&V Com Hélice ALM
Veja como Helix ALM pode acelerar o desenvolvimento de equipamento médico.
Explore Helix ALM
*novamente, graças a V & V expert Megan Martin que forneceu uma visão inestimável para este blog!
V&V: Glossary of Terms
real Result – What a system actually does when an action is performed. anomalia-quando um sistema não actua como esperado. Por exemplo, um erro, Erro ou falha de teste.entrega-um objeto obrigatório produzido como resultado da execução do projeto, geralmente documentos em esforços de validação.desvio-quando um processo ou procedimento não pode ser executado como definido, e é utilizado um método ou material alternativo. resultado esperado-o que um sistema deve fazer quando uma ação é realizada.ensaio de integração realizado utilizando dois ou mais subsistemas para verificar a interacção e as interdependências dos subsistemas.Protocolo
protocolo-uma colecção de casos de ensaio utilizados para documentar os ensaios do sistema.Qualificação-um protocolo de ensaio que designa que um sistema cumpre um conjunto definido de requisitos. garantia de qualidade – membros da equipa incumbidos de assegurar a qualidade do produto ou a integridade do processo.requisito de
– algo que um sistema deve ser capaz de fazer. validação retrospectiva-validação de um sistema que já existe.Especificação
– um documento que define os requisitos para um sistema ou componente.ensaio do subsistema realizado num subsistema principal ou num grupo de componentes.
sistema-a coisa em processo de validação. proprietário do sistema-o indivíduo que é, em última análise, responsável por um sistema.ensaio do sistema efectuado utilizando o sistema no seu conjunto.caso de ensaio-um procedimento documentado, utilizado para testar se um sistema cumpre um requisito ou uma recolha de requisitos.plano de ensaio-uma metodologia de ensaio estabelecida para garantir que um sistema cumpre os requisitos. etapa de ensaio-uma linha individual de um estojo de ensaio. Deve incluir instruções, resultados esperados e resultados reais.rastreabilidade-a capacidade de garantir que os requisitos descritos nas especificações foram testados. Muitas vezes capturado em uma matriz de rastreabilidade requisitos. ensaio unitário realizado numa unidade de software ou hardware ou num módulo de baixo nível.validação-estabelecimento, através de provas objectivas, de que as especificações do dispositivo estão em conformidade com as necessidades do utilizador e com a(s) utilização (ões) prevista (s).pacote de Validação-uma colecção de documentos produzidos durante um projecto de validação.verificação-confirmação por exame e apresentação de provas objectivas de que foram cumpridos os requisitos especificados.
V&V Plano – Um plano de definir os requisitos a serem verificados e validados, e a mão-de-obra, responsável indivíduos, ferramentas, métodos, recursos e calendário para o V&V esforço.
Comuns de Validação de Projeto Siglas
CC – Controle de Mudanças
CCB – Alterar a Placa de Controle (um grupo de indivíduos que controlam as alterações que devem ser feitas e quando)
DS – Especificação de Design
GORDURA – Teste de Aceitação de Fábrica
FS – Especificação Funcional
FRS, file replication service – Funcional Especificação de requisitos (Ver Especificação Funcional)
BPC – Boas Práticas Clínicas (diretrizes de qualidade para operações clínicas)
BPL – Boas Práticas de Laboratório (diretrizes de qualidade para laboratório farmacêutico operações)
GMP – Good Manufacturing Prática (diretrizes de qualidade para a fabricação de dispositivos ou medicamentos)
RTM – Requisito Matriz de Rastreabilidade
TRISTE – Arquitetura de Software ou Documento de Arquitetura do Sistema Documento
SÁB – Site de Testes de Aceitação
SCCB – Alteração do Software da Placa de Controle (mesmo que a CCB, mas por software)
SDD – Software de Design de Detalhe do Documento
ficha de dados de segurança de Software e Especificação de Design
Especificação – Especificação
SRS – Especificação de Requisitos de Software
TM – Matriz de Rastreabilidade
UAT – Testes de Aceitação do Usuário
URS – Requisito de Usuário Specification
UUT – Unit Under Test
VMP – Validation Master Plan
VP – Validation Plan
V&V – Verification and Validation