uleiurile biologice sunt diferite de uleiurile petroliere (motorina”obișnuită”) în structura și proprietățile moleculare.

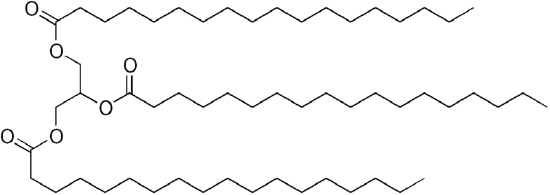
combustibilul diesel din petrol comun este un amestec de hidrocarburi simple, cu formula chimică medie C12H23 (prezentată mai jos), dar componentele pot varia aproximativ de la c10h20 (dodecan) la c15h28(pentadecan). În schimb, uleiurile biologice sunt ” trigliceride „(clasificate ca „esteri”), cum ar fi trilinoleatul de gliceril prezentat mai jos:
| c12h23, dodecan | o trigliceridă: trilinoleat de gliceril |
datorită dimensiunii lor mari și a atracțiilor intermoleculare mari, vâscozitatea uleiurilor biologice este, în general, prea mare pentru utilizarea în motoarele diesel convenționale. Uleiurile biologice ard, de asemenea, puțin mai ușor și cu o flacără mai murdară decât motorina petrolieră. Uleiurile biologice pot fi utilizate în motoarele diesel convenționale dacă sunt preîncălzite pentru a-și reduce vâscozitatea, dar acest lucru necesită un încălzitor electric auxiliar până când motorul se încălzește. Pentru aceste rezonanțe, uleiurile bilogice necesită prelucrare pentru utilizare ca biodiesel.
un ulei biologic este un ester, care este un tip de compus organic având legătura atomică prezentată mai jos.
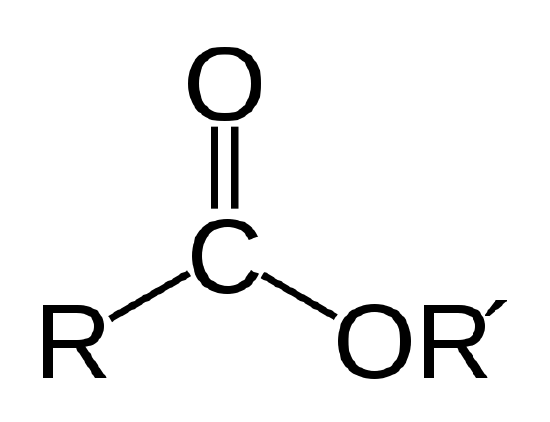
legătura esterului. R și R’ reprezintă lanțuri de atomi de carbon și hidrogen. R = -CH3 și R’ = -C18H35O2 pentru stearatul de metil din exemplul 1 |
glicerol |
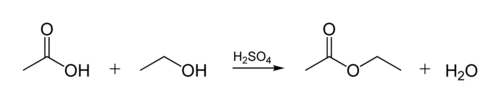
legătura ester în uleiurile biologice este creată atunci când un molecula de glicerol reacționează cu acizii organici. Molecula de glicerol are un lanț de 3 atomi de carbon, fiecare cu o grupare an-OH (alcool) pe ea. Figura de mai jos arată modul în care un alcool organic reacționează cu un acid organic. Chimiștii organici abreviază structurile moleculare-liniile ” zig-zag „din figură reprezintă lanțuri de carbon cu un atom de C la fiecare” zig „sau”zag”. Fiecare carbon are 4 legături și, dacă sunt arătate mai puțin de 4, se presupune că acestea merg la atomii de H. Deci, alcoolul este C2H5OH (etanol), iar acidul este acid acetic (sau acid etanoic, CH3COOH) în figura:
deoarece glicerolul are grupări 3-Oh, 3 „acizi grași” organici cu lanț lung se atașează pentru a face „trigliceridele”voluminoase.
dar la fel de ușor ca esteri pot fi făcute din alcooli și acizi, ei pot comuta alcooli sau acizi. În prezența unui catalizator de bază puternic, cum ar fi NaOH, o trigliceridă poate reacționa cu 3 molecule mici de alcool, cum ar fi metanolul (CH3OH), care înlocuiesc „coloana vertebrală” a glicerolului, făcând 3 esteri separați cu greutate moleculară mai mică
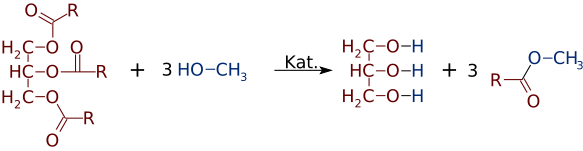
destul de des se formează un amestec de două sau mai multe produse. De exemplu, atunci când un ulei vegetal reacționează cu metanolul, numai unul sau doi dintre acizi pot fi deplasați din glicerină, producând doar 1 sau 2 Fame.
C3H5(C18H35O2)3 + NaOH + 2 CH3OH C3H5(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH C3H5(C18H35O2) 2 + 1 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 3 CH3OH C3H5(Oh)3 + 3 C17H35COOCH3
de obicei, se adaugă un exces mare de metanol și hidroxid de sodiu, astfel încât reacția produce cantitatea maximă de faimă.
dar în cazul unei transesterificări, chiar dacă niciunul dintre reactanți nu este consumat complet, nu se produce o creștere suplimentară a cantităților produselor. Spunem că o astfel de reacție nu merge la finalizare. Atunci când se produce un amestec de produse sau o reacție nu se finalizează, eficacitatea reacției este de obicei evaluată în termeni de randament procentual al produsului dorit. Un randament teoretic se calculează presupunând că tot reactivul limitativ este convertit în produs. Masa determinată experimental a produsului este apoi comparată cu randamentul teoretic și exprimată ca procent:

Exemplul 1 atunci când 100,0 g c3h5(C18H35O2)3 gaz și 15,0 g CH3OH sunt amestecate la 55 CTC cu catalizator NaOH, reacționează pentru a forma 90,96 g c17h35cooch3 stearat de metil biodiesel. Calculați randamentul procentual.
soluție trebuie să calculăm randamentul teoretic al NH3 și, pentru a face acest lucru, trebuie mai întâi să descoperim dacă N2 sau H2 este reactivul limitator. Pentru ecuația echilibrată
c3h5(C18H35O2)3 + NaOH + 3 CH3OH C3H5(Oh)3 + 3 C17H35COOCH3 stearină + hidroxid de sodiu + 3 ch3oh glicerol + 3 stearat de metil
raportul stoichiometric al reactanților este
 acum, cantitățile inițiale ale celor doi reactivi sunt și
acum, cantitățile inițiale ale celor doi reactivi sunt și raportul dintre sumele inițiale este astfel
raportul dintre sumele inițiale este astfel deoarece acest raport este mai mic decât
deoarece acest raport este mai mic decât , există un exces de ch3oh. Stearina este reactivul limitativ. În consecință, trebuie să folosim 0,1122 mol stearină și 0,3366 MOL CH3OH (mai degrabă decât 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, există un exces de ch3oh. Stearina este reactivul limitativ. În consecință, trebuie să folosim 0,1122 mol stearină și 0,3366 MOL CH3OH (mai degrabă decât 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.