- Introducere
- materiale și metode
- materiale vegetale și Condiții de creștere
- măsurători PSI și PSII
- electrochromic Shift Analysis
- tratamente Fotoinhibitorii
- analiza statistică
- rezultate
- discuție
- rolul stimulării CEF la lumină scăzută
- schimbarea raportului de oxidare P700 la lumină scăzută nu este legată de pmf
- ETRII controlează raportul de oxidare P700 la lumină scăzută
- concluzie
- contribuțiile autorului
- finanțare
- Declarație privind conflictul de interese
Introducere
deși lumina este forța motrice a fotosintezei, lumina ridicată poate provoca fotoinhibarea semnificativă a fotosistemului II (PSII) pentru frunzele plantelor care stabilesc umbra (Kitao și colab., 2000; Barth și colab., 2001; Krause și colab., 2004; Huang și colab., 2015b, 2016b,c). Cu toate acestea, psii fotoinhibat se recuperează rapid la lumină scăzută (He și Chow, 2003; Zhang și Scheller, 2004, Allakhverdiev și colab., 2005), datorită ratei rapide de rotație a proteinei D1 (Aro și colab., 1993; Zhang și Scheller, 2004; Allakhverdiev și colab., 2005). Rata de reparare PSII a fost redusă la inhibarea sintezei ATP fie prin PSI, fie prin PSII (Allakhverdiev și colab., 2005), indicând faptul că repararea rapidă a complexelor PSII deteriorate necesită o cantitate mare de ATP într-un timp scurt. Un studiu anterior a indicat că, după fotoinhibarea indusă de răcire a PSII, fluxul de electroni ciclici (CEF) a fost stimulat semnificativ în timpul recuperării la lumină scăzută (Huang și colab., 2010). S-a propus ca această stimulare a CEF la lumină scăzută să sporească sinteza ATP pentru repararea rapidă a PSII (Huang și colab., 2010). Cu toate acestea, sunt necesare mai multe dovezi pentru a clarifica rolul specific al stimulării CEF la lumină scăzută după fotoinhibarea PSII.
în timpul CEF, electronii de la NADPH sau ferredoxină sunt ciclați în jurul PSI în bazinul de plastochinonă. Acest transfer de electroni este cuplat la translocarea protonilor și generează un gradient de protoni peste membranele tilacoide (Inktyph) (Shikanai și Yamamoto, 2017). În plus față de contribuția la sinteza ATP, o altă funcție a lui Xvph este reglarea în jos a transportului de electroni fotosintetici prin acidificarea lumenului tilacoid (Shikanai, 2014, 2016). Această reglementare implică două mecanisme diferite: unul este legat de disiparea energiei termice și disipează excesul de energie luminoasă absorbită ca căldură de la antenele PSII (Takahashi și colab., 2009), iar celălalt este reglarea în jos a activității complexe Cyt B6/f și controlează rata transferului de electroni către PSI (Suorsa și colab., 2012, 2016; Tikkanen și Aro, 2014). În angiosperme, inclusiv Arabidopsis thaliana, funcționează două căi de transport ciclic de electroni PSI (Shikanai, 2007). Prima cale CEF este calea dependentă de PGR5- / PGRL1 sensibilă la antimicina A (Munekage și colab., 2002; Sugimoto și colab., 2013), iar celălalt este dependent de complexul de tip cloroplast NADH dehidrogenază (NDH) (Burrows și colab., 1998; Shikanai și colab., 1998). Contribuția căii dependente de PGR5- / PGRL1 este mai semnificativă în plantele C3. În condiții de lumină ridicată, activarea CEF dependentă de PGR5- / PGRL1 induce acidificarea lumenului tilacoid și duce astfel la niveluri ridicate ale raportului de oxidare P700 (Suorsa și colab., 2012, 2016; Kono și colab., 2014; Yamori și colab., 2016). Prin comparație, raportul de oxidare P700 la lumină scăzută a fost puțin afectat de deficiența CEF dependentă de PGR5-/PGRL1 (Munekage și colab., 2002, 2004; Kono și colab., 2014). La fotoinhibiția moderată PSII, stimularea CEF la lumină scăzută a fost însoțită de o creștere a rației de oxidare P700 (Huang și colab., 2010). Cu toate acestea, nu este clar dacă acest raport crescut de oxidare P700 este cauzat de stimularea CEF.
în plus față de CEF, transferul de electroni de la PSII (ETRII) joacă un rol important în afectarea stării redox a PSI (Tikkanen și colab., 2014; Huang și colab., 2016a, c; Suorsa și colab., 2016). În plantele pgr5 din A. thaliana, fotoinhibarea severă a PSII este probabil să funcționeze ca un control final al transferului de electroni fotosintetici care să permită menținerea P700 oxidat optim sub excesul de lumină (Tikkanen și colab., 2014). Recent, Suorsa și colab. (2016) a indicat că plantele pgr5 au prezentat un raport ridicat de oxidare P700 sub lumină ridicată atunci când ETRII a fost redus prin combinarea mutațiilor knockout în psbo1, PsbP2, PsbQ1, PsbQ2 și psbr loci. În frunzele răcite de tutun, fotoinhibiția moderată PSII a deprimat fluxul de electroni către PSI și apoi a crescut raportul de oxidare P700 în timpul tratamentelor ulterioare de răcire (Huang și colab., 2016a). Mai mult, fotoinhibarea indusă de răcire a PSII a dus la o depresie a ETRII, care a fost însoțită de o creștere a raportului de oxidare P700 la lumină scăzută (Huang și colab., 2010). Presupunem că raportul de oxidare P700 la lumină scăzută este controlat în principal de fluxul de electroni din PSII.
în raportul nostru anterior, am observat că planta de stabilire a umbrelor Panax notoginseng a arătat fotoinhibiție selectivă a PSII sub stres de lumină ridicată. După expunerea pe termen scurt la stres la lumină ridicată, ETRII la lumină scăzută a scăzut semnificativ, dar CEF a fost stimulat semnificativ. Concomitent, raportul de oxidare P700 a crescut în mare măsură. Obiectivele noastre specifice au fost de a (1) investiga dacă stimularea CEF la lumină scăzută facilitează în principal sinteza ATP; și (2) determină dacă creșterea raportului de oxidare P700 la fotoinhibiția moderată PSII este mai mult legată de ETRII decât de stimularea CEF sau de modificarea pmf. Pentru a răspunde acestor întrebări, frunzele intacte de Panax notoginseng au fost tratate la 2258 fotoni m-2 s-1 pentru 30 min. Înainte și după tratamentul cu lumină ridicată, s-au determinat distribuția energiei în PSII, starea redox a PSI și forța motrică a protonilor (pmf) la o lumină scăzută de 54 fotoni m-2 s-1.
materiale și metode
materiale vegetale și Condiții de creștere
în studiul de față, plantele vechi de 2 ani ale unei plante care stabilește umbra Panax notoginseng (Burkill) F. H. Chen ex C. Chow și W. G. Huang au fost utilizate pentru experimente. Aceste plante au fost cultivate în condiții de lumină de 10% lumină solară (cu o intensitate maximă a luminii la mijlocul zilei de aproximativ 200 fotoni m-2 s-1). Nu s-au experimentat stresuri de apă și nutriție pentru aceste plante. Pentru măsurătorile fotosintetice au fost utilizate frunze complet extinse de 9 săptămâni.
măsurători PSI și PSII
parametrii Fotosistemului I și PSII au fost măsurați la 25 CTC prin înregistrarea simultană cu ajutorul unui sistem dual de măsurare PAM-100 (Heinz Walz GmbH, Effeltrich, Germania). Parametrii fluorescenței clorofilei au fost calculați după cum urmează: Fv/Fm = (Fm – Fo)/Fm, Y(II) = (Fm’ – Fs)/Fm’ (Genty și colab., 1989), NPQ = (Fm – Fm’)/Fm’. Fo și Fm sunt fluorescența minimă și maximă după aclimatizarea întunecată. FS este fluorescența la starea de echilibru adaptată la lumină. Fo și Fm au fost determinate după aclimatizarea întunecată timp de 30 de minute înainte și după tratamentul cu lumină puternică. Parametrii fotosintetici PSI au fost măsurați prin dual PAM-100 pe baza semnalului P700 (diferența de intensități de 830 și 875 nm lumină de măsurare modulată prin impulsuri care ajunge la fotodetector) (Klughammer și Schreiber, 2008). Semnalele P700+ (P) pot varia între un nivel minim (P700 complet redus) și un nivel maxim (P700 complet oxidat). Nivelul maxim (Pm) a fost determinat cu aplicarea unui impuls de saturație (600 ms și 10000 fotoni de x-2 s-1) după pre-iluminare cu lumină roșie îndepărtată, iar Pm a fost utilizat pentru estimarea activității PSI. Pm ‘ a fost determinat similar cu Pm, dar cu lumină actinică în loc de lumină roșie îndepărtată. Randamentul cuantic al PSI a fost calculat ca Y (I) = (Pm’- P)/Pm. Raportul de oxidare P700 într-o lumină actinică dată a fost calculat ca Y (ND) = P/Pm. Randamentul cuantic al disipării energiei non-fotochimice PSI datorat limitării părții acceptorului a fost calculat ca Y (NA) = (Pm – Pm’)/Pm. Valorile la starea de echilibru pentru Y(II), NPQ, Y(I) și Y (ND) au fost măsurate după aclimatizarea luminii la lumină scăzută timp de 20 de minute.
Fotosintetice flux de electroni prin PSI și PSII-au calculat ca: ETRII = Y (II) ×PPFD ×0.84 ×0.5 (Krall și Edwards, 1992), ETRI = Y (I) ×PPFD×0.84 ×0.5 (Yamori et al., 2011), unde se presupune că 0,5 este proporția de lumină absorbită care atinge PSI sau PSII, iar 0,84 se presupune a fi absorbția (fracțiunea luminii incidente absorbită de frunze). Gradul de activare a CEF a fost estimat ca raport ETRI / ETRII (Yamori și colab., 2011, 2015). Trebuie remarcat faptul că partiționarea excitației 1:1 între PSI și PSII poate să nu fie reală, deoarece plantele de umbră tind să crească raportul PSII/PSI (Lunde și colab., 2003; Tikkanen și colab., 2006; Grieco și colab., 2012). Mai mult, în acest studiu, parametrii PSI și PSII au fost măsurați folosind lumina actinică roșie (635 nm) furnizată de Dual-PAM 100 (Walz, Germania). Deoarece lumina actinică roșie favorizează excitația PSII peste cea a PSI, distribuția energiei de excitație de la LHCII la PSII și PSI poate fi afectată de lumina actinică roșie (Tikkanen și colab., 2017).
electrochromic Shift Analysis
semnalul ECS a fost monitorizat ca schimbare de absorbanță la 515 nm folosind un dual-PAM-100 (Walz, Effeltrich, Germania) echipat cu un modul p515 / 535 emițător-detector (Walz). Semnalul ECS a fost obținut după 20 min de iluminare la 54 fotoni de 54 de centimoli m-2 s-1, după care, decăderea ECS a fost măsurată prin oprirea luminii actinice timp de 30 s. analiza cineticii de relaxare a intervalului întunecat ECS (DIRKECS) a fost realizată prin metoda lui sacksteder și colab. (2001) și Takizawa și colab. (2008). Pmf Total a fost estimat din amplitudinea totală a decăderii rapide a semnalului ECS în timpul intervalului întunecat de 300 ms. Relaxarea lentă a semnalului ECS a permis recunoașterea contribuției gradientului de protoni pe membranele tilacoide (Xvph). Constanta de timp a relaxării ECS de ordinul întâi (tec) este invers proporțională cu conductivitatea protonului (GH+) a membranei tilacoide prin sintaza ATP (Sacksteder și Kramer, 2000; Cruz și colab., 2005). Ca rezultat, gH+ a fost estimat ca inversul Constantei timpului de dezintegrare .
tratamente Fotoinhibitorii
după aclimatizarea întunecată timp de 30 min, Fv / Fm și Pm au fost măsurate în frunze intacte. Ulterior, aceste frunze intacte au fost adaptate la lumină la 59 fotoni m-2 s-1 pentru 20 min și s-au înregistrat parametrii fluorescenței clorofilei, semnalului P700 și semnalului ECS. Apoi, lumina actinică a fost schimbată la 2258 fotoni m-2 s-1. După expunerea la această lumină puternică timp de 30 de minute, lumina actinică a fost schimbată imediat la 59 fotoni m-2 s-1, iar parametrii fotosintetici au fost înregistrați după aclimatizarea luminii timp de 20 de minute. În cele din urmă, Fv/Fm și Pm au fost măsurate după aclimatizarea întunecată timp de 30 de minute.
analiza statistică
rezultatele au fost afișate ca valori medii ale cinci experimente independente. Testul T Independent a fost utilizat la nivelul de semnificație 0,05 pentru a determina dacă au existat diferențe semnificative între diferitele tratamente. Toate analizele statistice au fost efectuate folosind SPSS 16.0.
rezultate
în timpul inducției fotosintetice la 59 fotoni m-2 s-1, ETRII a crescut treptat și a atins o stare de echilibru la aproximativ 18 minute (figura 1a). Prin comparație, ETRI a fost constantă în această fază de inducție (figura 1A). După debutul acestei lumini scăzute, ETRI a fost mult mai mare decât ETRII. Cu toate acestea, după o inducție fotosintetică de 20 de minute, etri a fost mai mică decât ETRII. Aceste rezultate au sugerat activarea CEF în timpul fazei inițiale de inducție, în conformitate cu studiile anterioare (Joliot și Joliot, 2002, 2005; Makino și colab., 2002). După această inducție fotosintetică la lumină scăzută, frunzele au fost iluminate la o lumină ridicată de 2258 fotoni de x-2 s-1 timp de 30 min. Interesant este că ETRII a scăzut treptat în timpul tratamentului cu lumină ridicată (figura 1b). Între timp, valoarea ETRI a fost mai mare decât cea a ETRII (figura 1b), indicând activarea CEF în condiții de lumină ridicată. După acest tratament cu lumină ridicată, P700 fotooxidabil maxim (Pm) a fost menținut stabil (figura 2a). Prin comparație, intensitatea maximă a fluorescenței (Fm) a scăzut cu 40%, iar randamentul cuantic maxim al PSII (Fv/Fm) a scăzut de la 0,80 la 0,65 (figurile 2b, C). Aceste rezultate au indicat fotoinhibarea selectivă a PSII în frunzele de Panax notoginseng sub stres de lumină ridicată.
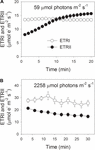
figura 1. Fluxul de electroni fotosintetici la lumină scăzută (a) și lumină ridicată (B). (A) frunzele aclimatizate la culoare închisă au fost expuse la o lumină scăzută de 59 fotoni m-2 s-1 pentru 20 min. (B) după iluminarea la 59 fotoni m-2 s-1 pentru 20 min pentru a activa chiuveta de electroni în fotosinteză, frunzele au fost expuse la o lumină ridicată de 2258 fotoni m-2 s-1 pentru 30 min. Valorile sunt mijloace se (n = 5).
înainte de tratamentul cu lumină înaltă, frunzele mature au fost iluminate la o lumină scăzută de 59 fotoni m-2 s-1 pentru 20 de minute pentru a activa fotosinteza și apoi s-au înregistrat valori pentru ETRI, ETRII, Y(ND) și NPQ. După tratamentul cu lumină puternică timp de 30 de minute, valorile pentru ETRI, ETRII, Y(ND) și NPQ au fost înregistrate după o nouă fază de aclimatizare de 20 de minute la lumină scăzută. Înainte de tratamentul cu lumină înaltă, valorile pentru ETRI și ETRII la 59 fotoni de 5-2 s-1 au fost de 13,4 și respectiv 15,7 electroni de 15-2 s-1 (figurile 3a, B). După tratamentul cu lumină ridicată, ETRI și etri la lumină scăzută au fost 12,8 și 11,2 electroni de m-2 s-1 (figurile 3a, B). Valoarea ETRII la 59 fotoni m-2 s-1 a scăzut cu aproximativ 30% după tratamentul fotoinhibitor, indicând depresia ETRII la fotoinhibiția moderată PSII. Înainte de tratamentul cu lumină ridicată, valoarea raportului ETRI / ETRII la 59 fotoni m-2 s-1 a fost de 0,85 (figura 3c). După tratamentul fotoinhibitor, raportul ETRI/ETRII a crescut semnificativ la 1,14 (figura 3c). Aceste rezultate au sugerat stimularea CEF la lumină scăzută la fotoinhibiția PSII (Yamori și colab., 2011, 2015).
după tratamentul cu lumină puternică, valoarea la starea de echilibru a lui Y(I) la 59 fotoni m-2 s-1 nu s-a modificat (figura 4a). Interesant este că Y (NA) a scăzut semnificativ de la 0,36 la 0,23(figura 4b), iar Y (ND) a crescut semnificativ de la 0,1 la 0,25 (figura 4c). Aceste rezultate au indicat modificarea stării redox a PSI la lumină scăzută după tratamentul fotoinhibitor. Între timp, valoarea NPQ sa schimbat ușor (figura 4D). Ca urmare, fotoinhibiția moderată PSII a avut efecte diferite asupra raportului de oxidare P700 și NPQ la lumină scăzută.
pentru a clarifica dacă creșterea Y(ND) este cauzată de o creștere a pmf, semnalele de schimbare electrochromică la 54 de fotoni m-2 s-1 au fost determinate după aclimatizarea luminii timp de 20 de minute înainte și după tratamentul cu lumină puternică. Interesant este faptul că pmf total a scăzut semnificativ cu 18% după tratamentul cu lumină înaltă (figura 5A), dar nivelul de la 7FF s-a modificat nesemnificativ (figura 5b). Deoarece formarea pmf poate fi afectată de conductivitatea protonului tilacoid, conductivitatea protonului (GH+) a membranei tilacoide la această lumină scăzută a fost, de asemenea, examinată înainte și după tratamentul cu lumină ridicată. Rezultatul a arătat că gH+ nu s-a schimbat odată cu tratamentul cu lumină ridicată (figura 5C), sugerând că tratamentul cu lumină ridicată a afectat cu greu activitatea cloroplastului ATP sintază la lumină scăzută. Deoarece scăderea de 30% în ETRII a fost însoțită de o scădere de 18% în pmf, stimularea CEF la lumină scăzută a compensat parțial formarea pmf și a lui Xvph.

Figura 5. Valori pentru forța motrică totală a protonului (pmf) (a), gradientul de protoni (Xvph) de-a lungul membranelor tilacoide (B) și conductivitatea protonului (GH+) a membranei tilacoide (C) la lumină scăzută. Toți parametrii au fost măsurați după adaptare la 54 de fotoni m-2 s-1 pentru 20 min. Valorile sunt mijloace se (n = 5). Asteriscul indică o schimbare semnificativă (P< 0,05) după tratamentul cu lumină puternică.
discuție
rolul stimulării CEF la lumină scăzută
s-a indicat că CEF joacă roluri importante în susținerea fotosintezei și a creșterii plantelor (Yamori și Shikanai, 2016). În condiții de lumină ridicată, CEF este acum considerat a fi esențial pentru echilibrarea bugetului energetic ATP/NADPH, precum și pentru protejarea PSI și PSII de daune (Munekage și colab., 2002, 2004; Takahashi și colab., 2009; Suorsa și colab., 2012, 2016; Walker și colab., 2014; Huang și colab., 2015a, 2017b). La intensitate scăzută a luminii, CEF joacă un rol important în optimizarea absorbției fotosintetice a CO2 probabil prin furnizarea de ATP suplimentar (Yamori și colab., 2011, 2015; Nishikawa și colab., 2012; Huang și colab., 2015a). Rolul principal al CEF este modulat flexibil ca răspuns la intensitatea luminii. În special, CEF contribuie în principal la echilibrarea bugetului energetic ATP/NADPH sub intensitățile luminii sub-saturate, dar protejează în principal aparatele fotosintetice împotriva fotoinhibării atunci când sunt expuse la intensitățile luminoase saturate prin acidificarea lumenului tilacoid (Huang și colab., 2015a). Interesant, Huang și colab. (2010) a constatat că CEF a fost stimulat semnificativ la lumină scăzută după fotoinhibarea indusă de răcire a PSII și a emis ipoteza că această stimulare CEF a îmbunătățit în principal sinteza ATP pentru repararea rapidă a PSII. Cu toate acestea, au fost necesare mai multe dovezi pentru a susține această ipoteză. În studiul de față, am observat că valoarea ETRI/ETRII la lumină scăzută a crescut semnificativ (figura 3C), indicând stimularea CEF în jurul PSI (Huang și colab., 2011, 2012, 2017a, b; Yamori și colab., 2011, 2015). Concomitent, amplitudinea pmf s-a diminuat semnificativ, iar a celei de-a doua, a celei de-a doua, a scăzut ușor. Aceste rezultate au indicat faptul că stimularea CEF nu a declanșat reglarea descendentă dependentă de Xvph a transportului fotosintetic de electroni. Cu alte cuvinte, această stimulare a CEF la lumină scăzută a facilitat în principal sinteza ATP.
deși conductivitatea protonică a cloroplastului ATP sintază nu a fost afectată de tratamentul cu lumină ridicată, dimensiunea mai mică a pmf a dus la o scădere a ratei reale de sinteză a ATP. Ratele de reparare PSII și asimilarea fotosintetică a CO2 la lumină scăzută sunt limitate în principal de rata sintezei ATP (Allakhverdiev și colab., 2005; Yamori și colab., 2011, 2015; Nishikawa și colab., 2012). Deoarece ETRII a scăzut semnificativ la fotoinhibiția PSII, rata sintezei ATP prin ETRII a fost remarcabil redusă. Pentru a echilibra raportul ATP / NADPH cerut de metabolismul primar și repararea rapidă a PSII, este necesar un mecanism flexibil pentru a oferi ATP suplimentar. În această condiție, ETRII a scăzut cu 30%, dar pmf total a scăzut cu doar 18%. Aceste rezultate indică faptul că stimularea CEF a compensat reducerea formării dependente de ETRII a pmf, sporind sinteza ATP. Repararea rapidă a PSII fotodamagiate depinde de sinteza ATP (Allakhverdiev și colab., 2005). Accelerarea CEF în jurul PSI a crescut concentrația intracelulară a ATP, accelerând astfel rata de reparare PSII în Synechocystis (Allakhverdiev și colab., 2005). Luate împreună, propunem ca stimularea CEF la lumină scăzută să joace un rol important în repararea rapidă a activității PSII printr-o sinteză suplimentară de ATP.
schimbarea raportului de oxidare P700 la lumină scăzută nu este legată de pmf
un fenomen interesant este că raportul de oxidare P700 la lumină scăzută a crescut semnificativ la fotoinhibiția moderată PSII (Huang și colab., 2010), care este prezentat și în studiul de față. În condițiile în care lumina absorbită depășește cerințele pentru fotosinteză, generarea dependentă de CEF a Xifph reglează activitatea activității complexe Cyt B6/f și controlează fluxul de electroni de la PSII la PSI (Suorsa și colab., 2012, 2016; Shikanai, 2014, 2016), optimizarea stării redox a P700 în PSI și minimizarea producției de ROS în PSI în timpul fotosintezei. În plantele pgr5 ale lui A. thaliana, P700 este redus de electroni în lumină datorită pierderii generării pmf. Cu toate acestea, în proteina flavodiiron care acumulează mutant pgr5, nivelul pmf a fost, de asemenea, restabilit la nivelul de tip sălbatic și, astfel, P700 a fost oxidat ca în tipul sălbatic (Yamamoto și colab., 2016). În liniile mutante de grâu cu deficit de clorofilă B, gradientul insuficient de protoni tilacoizi duce la supra-reducerea părții acceptorului PSI și, astfel, la fotoinhibarea PSI la lumină ridicată sau la temperatură ridicată (Brestic și colab., 2015, 2016). Recent, unele studii au raportat că activitatea crescută a cloroplastului ATP sintază a afectat formarea pmf și a provocat supra-reducerea lanțului de transport al electronilor fotosintetici, rezultând fotodamage de PSI sub lumină ridicată și lumină fluctuantă (Kanazawa și colab., 2017; Takagi și colab., 2017). Aceste rapoarte susțin rolul critic al pmf în menținerea P700 oxidat optim sub excesul de energie luminoasă.
rezultatele noastre actuale au indicat faptul că, după tratamentul cu lumină înaltă timp de 30 de minute,pmf total format la această lumină scăzută a scăzut semnificativ și formarea de Xvph s-a modificat ușor (figurile 5A, B). Între timp, raportul de oxidare P700 a crescut semnificativ de la 0,1 (înainte de tratament) la 0,25 (după tratament) (figura 4c). Aceste rezultate indică cu tărie că această creștere a raportului de oxidare P700 nu poate fi explicată prin modificarea pmf, care este în mare măsură diferită de corelația dintre Y(ND) și pmf sub lumină ridicată (Yamamoto și colab., 2016; Takagi și colab., 2017). Prin urmare, efectul de reglare al pmf asupra raportului de oxidare P700 este minim la lumină scăzută, dar devine deosebit de crucial în lumină ridicată sau lumină fluctuantă. În condiții de lumină ridicată, o valoare ridicată a Y (ND) este de obicei însoțită de o valoare ridicată a NPQ (Munekage și colab., 2002, 2004; Kono și colab., 2014; Zivcak și colab., 2015), datorită creșterii pmf. Deprecierea formării de Xfcf duce la scăderea nivelurilor de Y(ND) și NPQ sub lumină ridicată (Suorsa și colab., 2012; Kono și colab., 2014; Yamamoto și colab., 2016; Kanazawa și colab., 2017). Inducerea NPQ la lumină scăzută este determinată în principal de nivelul acidificării lumenului. După tratamentul cu lumină ridicată, gradul de acidificare a lumenului nu s-a modificat (figura 5B), iar NPQ a rămas stabil (figura 4D). Prin comparație, Y (ND) a crescut semnificativ. Aceste rezultate indică faptul că la lumină scăzută, Y(ND) și NPQ au fost controlate de diferite mecanisme de reglementare.
ETRII controlează raportul de oxidare P700 la lumină scăzută
PSI devine supra-redus numai atunci când fluxul de electroni din PSII depășește capacitatea acceptorilor de electroni PSI de a face față electronilor. Când fluxul de electroni către PSI este limitat, PSI este extrem de tolerant împotriva stresului ușor în plantele pgr5 ale lui A. thaliana (Suorsa și colab., 2012, 2016; Tikkanen și colab., 2014). Pentru planta care stabilește umbra Psychotria rubra, activitatea PSI a fost insusceptibilă la stresul la lumină ridicată în prezența DCMU (Huang și colab., 2016c). În frunzele răcite de tutun, fotoinhibiția moderată PSII a permis menținerea P700 oxidată optim și apoi protejată activitatea PSI împotriva fotodamagiei ulterioare (Huang și colab., 2016a). Aceste rezultate au indicat rolul important al ETRII în controlul stării redox a PSI în condiții de lumină ridicată sau de răcire. Rezultatele noastre actuale au arătat că fotoinhibiția moderată PSII a dus la o depresie semnificativă a ETRII la lumină scăzută. Între timp, activitatea PSI și activitatea cloroplastului ATP sintază s-au schimbat ușor, iar totalul pmf și Xvph nu au crescut. Ca urmare, reducerea ETRII nu a fost cauzată de controlul fotosintetic dependent de Xvph prin complexul Cyt B6/f, dar a fost probabil indusă de scăderea activității PSII (Tikkanen și colab., 2014). Scăderea ofertei de electroni de la PSII la PSI a dus la creșterea nivelului de oxidare P700. Astfel, raportul de oxidare P700 la lumină scăzută a fost în mare parte controlat de ETRII.
concluzie
am constatat că fotoinhibarea selectivă a PSII a indus o stimulare a CEF și o creștere a raportului de oxidare P700 la lumină scăzută. Stimularea CEF nu a declanșat reglarea descendentă a transportului fotosintetic al electronilor, dependentă de Ceff. Ca urmare, această stimulare a CEF la lumină scăzută a facilitat în principal sinteza ATP, care este esențială pentru repararea rapidă a PSII fotodamagiate. Creșterea raportului de oxidare P700 nu a putut fi explicată prin modificarea controlului fotosintetic dependent de Xvph la Complexul Cyt B6/f, dar a fost cauzată în primul rând de scăderea ofertei de electroni de la PSII la PSI.
contribuțiile autorului
WH, S-BZ și TL au conceput și proiectat cercetarea. WH și Y-JY au condus experimentele. WH, Y-JY, S-BZ și TL au analizat datele. WH a scris primul proiect al manuscrisului, care a fost editat intens de toți autorii.
finanțare
Acest studiu a fost susținut de Fundația Națională de științe Naturale din China (31670343), Asociația de promovare a inovării pentru tineret a Academiei Chineze de științe (2016347) și programele majore de știință și Tehnică din provincia Yunnan (2016zf001).
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Kono, M., Noguchi, K. și Terashima, I. (2014). Rolurile fluxului de electroni ciclici În jurul PSI (CEF-PSI) și O2-căi alternative dependente în reglarea fluxului de electroni fotosintetici în lumină fluctuantă pe termen scurt în Arabidopsis thaliana. Physiol De Celule Vegetale. 55, 990–1004. doi: 10.1093 / pcp / pcu033
PubMed Abstract | CrossRef Text Complet/Google Scholar
Shikanai, T. (2016). Rețeaua de reglementare a forței motrice a protonilor: contribuția transportului ciclic de electroni în jurul fotosistemului I. Photosynth. Res. 129, 253-260. doi: 10.1007 / s11120-016-0227-0
PubMed Abstract | CrossRef Full Text/Google Scholar
Yamori, W., Makino, A. și Shikanai, T. (2016). Un rol fiziologic al transportului ciclic de electroni în jurul fotosistemului I în susținerea fotosintezei sub lumină fluctuantă în orez. Sci. Rep. 6:20147. doi: 10.1038 / srep20147
PubMed Abstract | CrossRef Full Text/Google Scholar
Yamori, W., și Shikanai, T. (2016). Funcții fiziologice ale transportului ciclic de electroni în jurul fotosistemului I în susținerea fotosintezei și a creșterii plantelor. Anu. Rev. Plante Biol. 67, 81–106. doi: 10.1146 / annurev-arplant-043015-112002
PubMed Abstract | CrossRef Full Text/Google Scholar
Yamori, W., Shikanai, T. și Makino, A. (2015). Fotosistemul i fluxul ciclic de electroni prin complexul de tip cloroplast NADH dehidrogenază îndeplinește un rol fiziologic pentru fotosinteză la lumină scăzută. Sci. Rep. 5:13908. doi: 10.1038/srep13908
PubMed Abstract | CrossRef Full Text/Google Scholar
Zhang, S. P. și Scheller, H. V. (2004). Fotoinhibarea fotosistemului I la temperatura de răcire și recuperarea ulterioară în Arabidopsis thaliana. Physiol De Celule Vegetale. 45, 1595–1602. doi: 10.1093 / pcp / pch180
PubMed rezumat / CrossRef Full Text / Google Scholar