- interacțiune specifică gazdei între Rhizobium și partenerii de plante
- dezvoltarea nodulilor determinati si Nedeterminati
- creșterea celulelor simbiotice implică amplificarea genomului gazdă prin cicluri de Endoreduplicare
- diferite destine ale Bacteroidelor de fixare a azotului
- Peptidele gazdă guvernează diferențierea Bacteroidă
- NCR247: un exemplu pentru multi-țintă efector gazdă
- concluzie
- Declarație privind conflictul de interese
- mulțumiri
interacțiune specifică gazdei între Rhizobium și partenerii de plante
bacteriile care formează simbioza de fixare a azotului cu plantele de leguminoase aparținând diverselor grupuri de proteobacterii de la Centauri și de la Centauri sunt denumite colectiv rhizobia (Chen și colab., 2003; MacLean și colab., 2007). Multe proteobacterii de la XV sunt implicate în interacțiuni pe termen lung cu eucariote superioare. Aceste interacțiuni variază de la colonizarea suprafeței prin relații simbiotice facultative până la obligarea stilului de viață patogen intracelular sau endosimbiont. Genele simbiotice necesare pentru formarea nodulilor, infecția celulelor gazdă și fixarea azotului au fost dobândite prin transferul lateral de gene, care este sursa primară a diversității genetice a rizobiei. Prin urmare, rizobia ar putea fi mai strâns legată de agenții patogeni (cum ar fi Agrobacterium sau Brucella) decât unul de celălalt. Rhizobia tind să aibă genomi mari (până la 10.5 Mbp) care în rhizobia cu creștere rapidă sunt dispersate pe mai mulți repliconi (MacLean și colab., 2007). De exemplu, Sinorhizobium meliloti, endosimbiontul speciilor Medicago, are un genom tri-despărțit; un cromozom de 3,65 Mbp și două megaplasmide, pSymA și pSymB (1,35 și 1,68 Mbp) ambele sunt indispensabile și poartă majoritatea genelor simbiotice. Cu toate acestea, multe tulpini de S. meliloti conțin alte plasmide auxiliare de dimensiuni medii și, prin urmare, genomul S. meliloti poate conține până la 9.000 de gene (Barnett și colab., 2001; Capela și colab., 2001). Spre deosebire de rizobie, endosimbionții obligați ai insectelor posedă de obicei un genom puternic redus (160-450 Kbp), care asigură multiplicarea și codurile lor pentru câteva căi biosintetice specifice, inclusiv cele care satisfac nevoia gazdei (Moran și colab., 2008; Price și colab., 2011). Acești genomi incredibil de reduși sunt totuși amplificați compensând genomul diminuat cu un conținut de ADN poliploid.
partenerii de plante din rhizobia aparțin familiei Leguminosae / Fabaceae. Simbioza fixării azotului a evoluat în mai multe linii, dar nu toate leguminoasele formează simbioză. Până în prezent sunt cunoscute 12.000 de specii de leguminoase nodulate și fiecare are propriul partener Rhizobium. Simbioza este declanșată de înfometarea cu azot a plantei gazdă, care trebuie să-și selecteze partenerul Rhizobium din miliarde de bacterii din rizosferă. Acest lucru se realizează prin secreția moleculelor de semnal flavonoid din rădăcină care acționează ca chemo-atractanți, dar cel mai important ca inductori ai genelor de nodulare Rhizobium (Oldroyd, 2013). Aceste gene sunt necesare pentru producerea de molecule de semnal bacterian; factorii Nod (NFs) care declanșează programul de dezvoltare a nodulilor în planta gazdă (Walker și Downie, 2000). NFs sunt molecule lipochitooligozaharidice care poartă substituții specifice gazdei pe reziduurile de zahăr terminale și lanțurile lipidice caracteristice, care sunt recunoscute de receptorii gazdă de tip LysM și sunt necesare atât pentru dezvoltarea nodulilor, cât și pentru infecția bacteriană. Interesant este că simbioza antică a plantelor terestre cu ciuperci arbusculare micorizale (am) funcționează cu molecule de semnal lipochitooligozaharidice similare, factorii Myc care sunt percepuți de receptori de tip LysM similari, dar diferiți ca NFs (Abdel-Lateif și colab., 2012; Oldroyd, 2013). Factorii Myc și NFs activează o cale comună de semnalizare, dar după implicarea genelor simbiotice comune conservate în plante, căile deviază; una care duce la nodulare, cealaltă pentru simbioza AM.
infecția plantelor și formarea nodulilor sunt procese complicate; Factorii Nod joacă roluri distincte în organogeneza nodulilor și infecția părului rădăcinii. Mai mult, pe lângă factorii Nod, diverse polizaharide bacteriene de suprafață sunt cruciale pentru o infecție eficientă (Fraysse și colab., 2003). În majoritatea leguminoaselor, rhizobia intră în gazdă prin firele de păr ale rădăcinii, unde prin invaginarea membranei plasmatice se formează un fir de infecție (IT) care conține bacteriile care se înmulțesc și crește spre cortexul rădăcinii. Un mod mai puțin frecvent și vechi de infecție apare prin fisuri pe suprafața rădăcinii anumitor leguminoase.
dezvoltarea nodulilor determinati si Nedeterminati
dezvoltarea nodulilor necesita reactivarea mitotica a celulelor corticale conducand la formarea primordiului nodulilor care apoi se diferentiaza in nodulii radacinilor Fixatori de azot care asigura conditia microaeroba in zona centrala pentru functionarea enzimei azotazei sensibile la oxigen in bacteroizi. În funcție de natura tranzitorie și persistentă a proliferării celulelor gazdă, nodulii pot fi de tip determinat sau nedeterminat (Terpolilli și colab., 2012; Kondorosi și colab., 2013). Nodulii determinati nu au meristem si contin populatie omogena de celule simbiotice. Nodulii determinați se dezvoltă, de exemplu, pe rădăcinile Phaseolus vulgaris și Lotus japonicus.
dimpotrivă, diviziunea celulară activă este menținută în nodulii nedeterminați. Un meristem nodular este prezent în regiunea apicală (zona I) care prin generarea constantă de celule noi provoacă o creștere continuă și o formă alungită a nodulului. Celulele care părăsesc meristemul nu se mai împart și intră într-o fază de diferențiere. Firul de infecție eliberează bacteriile în celulele submeristematice, care se diferențiază treptat de-a lungul celor 12-15 straturi celulare ale zonei de infecție (zona II), ducând la dezvoltarea celulelor simbiotice de fixare a azotului în zona nodulului III (Figura 1; Franssen și colab., 1992). Medicago sativa, M. truncatula, vicia sativa și Pisum sativum sunt exemple de plante care formează noduli nedeterminați.
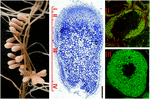
figura 1. Structura nodulilor rădăcinii de fixare a azotului formați în simbioza S. meliloti – M. truncatula. Diferitele zone de noduli sunt indicate pe secțiunea nodulară longitudinală: (I) meristem, (II) Zona de infecție, (III) zona de fixare a azotului, (IV) zona de senescență. Celulele simbiotice din zona II conțin endosimbionții diferențiatori, în timp ce în zona III citoplasma gazdă este complet ambalată cu bacteroizi lungi de fixare a azotului. Endosimbionții colorați cu Syto9 au fluorescență verde.
creșterea celulelor simbiotice implică amplificarea genomului gazdă prin cicluri de Endoreduplicare
extinderea extremă a celulelor vegetale poate fi observată atât la nodulii determinanți, cât și la cei nedeterminați. Citoplasma unei celule simbiotice care fixează azotul găzduiește aproximativ 50.000 de bacteroizi. Pentru a găzdui un număr atât de mare de endosimbionți, celulele gazdă cresc. În nodulii M. truncatula, volumul celulelor de fixare a azotului este de 80 de ori mai mare decât cel al celulelor meristematice diploide. Creșterea celulelor infectate are loc treptat în zona II și este consecința endoreduplicării repetate (ER) a genomului fără mitoză. În zona II, mecanismul ciclului celular este încă activ, dar lipsa ciclinelor mitotice inhibă mitoza și transformă ciclurile mitotice în cicluri de endoreduplicare (Cebolla și colab., 1999). Acest lucru se realizează prin proteina CCS52A a comutatorului ciclului celular care, prin distrugerea ciclinelor mitotice, induce runde repetate de duplicare a genomului, ducând la formarea celulelor poliploide în creștere treptată (Roudier și colab., 2003; Kondorosi și Kondorosi, 2004). La speciile Medicago nivelurile de ploidie pot atinge 64C reprezentând un conținut de ADN de 64 de ori mai mare comparativ cu celulele haploide (C corespunde conținutului de ADN haploid; Vinardell și colab., 2003). Reglarea în jos a CCS52A în M. truncatula nu a avut niciun efect asupra formării primordiului, dar a fost în detrimentul diferențierii nodulilor, indicând faptul că ciclurile ER și formarea celulelor mari foarte poliploide sunt esențiale pentru funcționarea nodulilor (Vinardell și colab., 2003). Interesant este că celulele corticale care conțin ciuperci AM sunt, de asemenea, poliploide, precum și celulele rădăcinii gigantice care hrănesc nematode (Favery și colab., 2002; Gen și colab., 2008). În mod similar, celulele simbiotice ale insectelor, bacteriocitele care adăpostesc endosimbionții intracelulari sunt, de asemenea, mari și poliploide (Nakabachi și colab., 2010). În plantele angiosperme, poliploidia este frecventă și modelul specific moștenit al poliploidiei în diferite organe, țesuturi și tipuri de celule sugerează că ar putea fi o sursă majoră a fiziologiei specializate a celulelor gazdă (Nagl, 1976; Edgar și colab., 2014). Pe lângă creșterea celulară, multiplele copii ale genelor, lipsa condensării cromozomilor poate contribui la activități transcripționale și metabolice mai mari. Cu toate acestea, asocierea poliploidiei cu diferite funcții celulare sugerează un impact al poliploidiei și asupra arhitecturii nucleozomilor și asupra epigenomului care controlează activarea sau reprimarea regiunilor genomice specifice. În consecință, conținutul genomului poliploid al celulelor simbiotice pare a fi o condiție prealabilă pentru diferențierea nodulilor și pentru exprimarea majorității genelor gazdă simbiotice (Maunoury și colab., 2010).
diferite destine ale Bacteroidelor de fixare a azotului
bacteriile eliberate din IT sunt prezente în citoplasma gazdă ca structuri organelle, numite simbiozomi. Bacteriile nu au contact direct cu citoplasma, deoarece sunt înconjurate de o membrană peribacteroidă, cunoscută și sub numele de membrană simbiozomală (SM). Bacteroidul, SM și spațiul dintre ele cuprind simbiozomul (Catalano și colab., 2004). SM în timpul formării sale reflectă originea membranei plasmatice, modificările ulterioare ale compoziției sale deschid noi roluri specializate la interfața gazdă-endosimbiont (Limpens și colab., 2009; Ivanov și colab., 2012; Brear și colab., 2013; Sinharoy și colab., 2013). Bacteroizii se înmulțesc în celulele nodulare gazdă în creștere la o anumită densitate celulară, se adaptează stilului de viață endosimbiotic și condițiilor microaerobe și se maturizează la bacteroizi care fixează azotul. Forma și fiziologia bacteroidelor pot fi, totuși, izbitor de diferite în diferitele leguminoase. În anumite gazde de leguminoase, bacteroizii care fixează azotul au aceeași morfologie ca și celulele cultivate; acest tip de bacteroizi poate reveni la forma de viață liberă. În alte asociații, bacteroizii sunt transformați ireversibil în endosimbionți poliploizi, măriți, necultivabili. Acești bacteroizi diferențiați terminal pot fi alungiți și chiar ramificați și de 5 până la 10 ori mai lungi decât celulele vii libere sau pot fi sferici de la 8 la cel puțin 20 de ori genom amplificat în funcție de gazdă (Mergaert și colab., 2006; Nakabachi și colab., 2010). Diferențierea terminală a bacteroizilor este controlată de gazdă, evoluată în mai multe ramuri ale familiei Leguminosae indicând avantajul gazdei și probabil performanțe simbiotice mai mari (Oono și colab., 2010). Diferențierea bacteroidă terminală este cea mai bine elucidată în simbioza S. meliloti – M. truncatula. În M. nodulii truncatulei, cele mai vizibile evenimente de diferențiere bacteroidă terminală apar în zona II. înmulțirea bacteroidelor se oprește în mijlocul zonei II, unde începe alungirea celulară și amplificarea uniformă a repliconilor multipli prin cicluri de endoreduplicare. De-a lungul a 2-3 straturi celulare la marginea zonelor II și III (numite interzone) creșterea bruscă a bacteroidelor este vizibilă atingând practic dimensiunea lor finală, cu toate acestea, fixarea azotului are loc numai în zona III.
Peptidele gazdă guvernează diferențierea Bacteroidă
Compararea transcriptomilor nodulari ai leguminoaselor cu diferențierea bacteroidă reversibilă și ireversibilă a relevat existența a câteva sute de gene mici care erau prezente doar în genomul acelor plante gazdă unde diferențierea bacteroidă era terminală. În M. truncatula celulele nodulare produc cel puțin 600 de peptide simbiotice specifice nodulilor (symPEPs). Genele simpep sunt activate numai în celulele simbiotice poliploide infectate cu S. meliloti (Kevei și colab., 2002; Mergaert și colab., 2003), cu toate acestea anumite seturi la începutul, altele în etapele ulterioare ale dezvoltării nodulilor. O mare parte, mai mult de 500 de gene codifică peptide bogate în cisteină (NCR) specifice nodulilor (Mergaert și colab., 2003; Alunni și colab., 2007; Nallu și colab., 2014). Peptidele NCR sunt direcționate către bacteroizi și atunci când livrarea lor către endosimbionți a fost blocată, diferențierea bacteroidă a fost abolită demonstrând că peptidele sunt responsabile pentru diferențierea terminală a bacteroidelor S. meliloti (Van De Velde și colab., 2010). Varietatea secvenței înalte și tiparele de Expresie caracteristice ale genelor NCR sugerează diversitatea funcțiilor, modurilor de acțiune și țintelor bacteriene în diferite stadii de maturare bacteroidă (Figura 2). Cu toate acestea, de ce celula gazdă produce un arsenal de NCRs? Care poate fi avantajul unui repertoriu peptidic atât de divers? Este necesar pentru interacțiunea gazdei cu diverse bacterii? Partenerii simbiotici ai M. truncatula sunt S. meliloti și S. medicae, cu toate acestea în sol există nenumărate variante de tulpini ale ambelor specii. M. truncatula este, de asemenea, reprezentată de multe ecotipuri și aderări diferite, care diferă în ceea ce privește numărul, secvențele și profilul de Expresie al genelor NCR și în interacțiunile lor simbiotice cu diferite tulpini S. meliloti și S. medicae (Nallu și colab., 2014; Roux și colab., 2014). În timp ce un nodul conține un singur tip de bacterie, nodulii diferiți de pe același sistem radicular pot avea populații bacteriene distincte. Este posibil ca planta care recunoaște diferitele endosimbionte să le manipuleze cu un repertoriu specific de peptide. Aceste diferențe pot adăuga un nivel de control suplimentar pentru specificitatea simbiotului gazdă și, prin urmare, pentru eficiența nodulării.

figura 2. Expresia diferențială a genelor simpep în nodulii M. truncatula. Semnal negru: hibridizare in situ, semnal albastru: activitatea Gus a fuziunilor symPEP promotor-GUS în nodulii transgenici.
deși simpozioanele reprezintă clase peptidice unice, structurile lor seamănă cu peptidele antimicrobiene (amp). Amp-urile cu spectru larg de activitate microbiană de ucidere a celulelor sunt cel mai frecvent cationice provocând moartea celulelor prin formarea porilor, perturbarea membranei și Liza consecventă a celulelor microbiene. Faptul că capacitatea de diviziune celulară se pierde definitiv în timpul diferențierii endosimbiontului indică faptul că cel puțin anumite simpipuri au activități antimicrobiene. Tratamentul bacteriilor cu NCRs cationice sintetice a provocat într-adevăr eliminarea rapidă și eficientă dependentă de doză a diferitelor bacterii Gram-negative și Gram-pozitive, inclusiv agenți patogeni umani și vegetali importanți (Van De Velde și colab., 2010; Tiricz și colab., 2013). Acest efect de ucidere ex-planta corelat cu permeabilizarea membranelor microbiene, cu toate acestea, simpele din mediul lor natural – în celulele nodulare – nu permeabilizează membranele bacteriene și nu ucid endosimbionții. Cel mai probabil concentrațiile peptidelor din noduli sunt semnificativ mai mici decât cele aplicate în testele in vitro. Mai mult, peptidele cationice sunt produse împreună cu peptidele anionice și neutre în aceeași celulă și o posibilă combinație de câteva zeci sau sute de peptide cu diferite încărcări și hidrofobicitate ar putea neutraliza efectul bactericid direct al peptidelor cationice.
implicarea AMP sau a peptidelor asemănătoare AMP nu este unică pentru simbioza Rhizobium-leguminoase. În sitophilus weevil, celulele simbiotice produc peptida antimicrobiană coleoptericin-a (ColA) care provoacă dezvoltarea endosimbionților filamentoși giganți prin inhibarea diviziunii celulare și protejează țesuturile insectelor vecine de invazia bacteriană (Login și colab., 2011). În acest sistem, o singură peptidă este suficientă pentru diferențierea endosimbiontului obligatoriu transmis vertical, spre deosebire de nodulii care funcționează cu sute de simpepuri și pot găzdui nenumărate variante de tulpină ca endosimbionți. În simbioza aphid-Buchnera, celulele gazdă produc, de asemenea, peptide specifice bacteriocitelor, inclusiv peptide bogate în cisteină (BCR) care seamănă cu peptidele Medicago NCR, cu toate acestea funcțiile acestor peptide simbiotice nu au fost încă raportate (Shigenobu și Stern, 2013).
NCR247: un exemplu pentru multi-țintă efector gazdă
transcriptom analiza M. nodulii truncatula în diferite stadii ale dezvoltării lor, microdisecția cu laser a regiunilor nodulare, hibridizarea in situ, imunolocalizarea peptidelor selectate și fuziunile genei simpep promotor-reporter în nodulii transgenici permit cartografierea acțiunii peptidelor individuale în celulele simbiotice de la infecția timpurie până la starea de fixare târzie a azotului. NCR247 este exprimat în straturile celulare mai vechi din zona II și în interzona unde diviziunea celulară bacteriană se oprește și are loc o alungire remarcabilă a endosimbionților (Farkas și colab., 2014). Această mică peptidă cationică a ucis efectiv diferiți microbi in vitro, iar analiza in silico a indicat capacitățile sale extreme de legare a proteinelor. NCR247 marcat cu FITC a intrat în citosolul bacterian, unde interacțiunile sale cu numeroase proteine bacteriene au fost posibile. Partenerii de legare au fost identificați prin tratamentul bacteriilor sau bacteroidelor S. meliloti cu peptide StrepII/etichetate cu pavilion urmat de cromatografia de afinitate și identificarea partenerilor care interacționează cu LC-MS/MS și analiza Occidentală (Farkas și colab., 2014).
unul dintre interactori a fost proteina de diviziune celulară FtsZ care joacă un rol crucial în diviziunea celulară. Se știe că o serie de peptide antibiotice exercită un efect bactericid sau bacteriostatic prin interacțiunea cu FtsZ, inhibând polimerizarea acestuia împiedicând astfel formarea corectă a inelului Z și a septului (Handler și colab., 2008). NCR247 a fost co-purificat cu FtsZ din citoplasma bacteriană și s-a demonstrat că perturbă formarea septului. Ncr035 prezintă in vitro, de asemenea, un efect bactericid și produs în aceleași celule simbiotice ca ncr247 se acumulează la septul diviziune care indică acțiunea simultană sau consecutivă a acestor peptide și evoluția strategiilor gazdă multiple pentru a inhiba proliferarea endosimbiont. Un alt studiu a arătat că expresia genelor importante de diviziune celulară, inclusiv genele necesare pentru funcția inelului Z, au fost puternic atenuate în celulele tratate de NCR247 (Penterman și colab., 2014). Pretratarea bacteriilor cu concentrații sub-letale NCR247 a abolit localizarea FITC-NCR035 la Sept și a provocat alungirea celulelor (Farkas și colab., 2014).
proteinele ribozomale au fost cei mai abundenți parteneri de interacțiune NCR247. S-a observat că ncr247 inhibă puternic sinteza proteinelor bacteriene într-o manieră dependentă de doză, atât in vivo, cât și in vitro (Farkas și colab., 2014). Aceste rezultate au sugerat că un mod de acțiune peptidică NCR247 se leagă de ribozomi atât în celulele bacteriene, cât și în bacteroizi. Interesant, un model modificat și o complexitate redusă a proteinelor care interacționează au fost observate în bacteroizi. În consecință, nivelul general de Expresie al proteinelor ribozomale a fost în medie de 20 de ori mai mic în bacteroizi decât în celulele vii libere cu abundență relativă diferită de transcrieri ale proteinelor ribozomale individuale. Diversificarea ribozomilor în bacteroizi poate avea un rol semnificativ, contribuind la traducerea avansată a proteinelor specifice, susținând astfel fiziologia specializată, care necesită energie, a funcției de fixare a azotului foarte abundente.
însoțitorul GroEL a fost, de asemenea, un partener direct de interacțiune al NCR247 (Farkas și colab., 2014). Din cele 5 proteine GroEL, GroEL1 sau GroEL2 este suficient pentru supraviețuire, în timp ce GroEL1 exprimat la nivel ridicat în nodul este esențial pentru simbioză (Bittner și colab., 2007). Este necesar pentru activarea completă a genelor de nodulare și asamblarea complexului de azotază. GroEL posedă o versatilitate funcțională extremă prin interacțiunea cu sute de proteine. Interacțiunea NCR247-GroEL1 poate avea consecințe direct asupra GroEL, dar indirect și asupra substraturilor GroEL și a proceselor biologice asociate. Absența GroEL1 a afectat grav infecția bacteriană și menținerea și diferențierea bacteroizilor care demonstrează o nevoie generală de GroEL1 în toate etapele dezvoltării nodulilor de fixare a azotului.
implicarea peptidelor GroEL și gazdă în interacțiunile microb-gazdă nu este unică pentru simbioza Rizobiu-leguminoase. În celulele simbiotice weevil coleoptericin-A (ColA) interacționează și cu GroEL (Login și colab., 2011). GroEL joacă, de asemenea, un rol important în menținerea endosimbionților (Moran, 1996; Kupper și colab., 2014). Deoarece majoritatea sistemelor simbiotice sunt încă neexplorate și instrumentele genomice și proteomice cu randament ridicat sunt disponibile doar recent, putem prezice doar că peptidele gazdă-diferențierea endosimbiontului mediată, de asemenea amplificarea genomului celulelor gazdă și endosimbionții diferențiați terminal sunt strategii generale de simbioză.
concluzie
bacteriile simbiotice și patogene folosesc abordări similare pentru a interacționa cu gazdele lor și pentru a supraviețui în celulele gazdă, chiar dacă rezultatele acestor interacțiuni sunt izbitor de diferite. Plantele și animalele pot genera răspunsuri imune înnăscute la microorganisme la percepția MAMP (modele moleculare asociate microorganismelor). Această percepție are ca rezultat activarea cascadelor de semnalizare și producerea de efectori antimicrobieni. Peptide gazdă asemănătoare AMP, cum ar fi M. peptidele truncatula NCR sau peptida antimicrobiană weevil ColA joacă roluri esențiale și multi-fațete în controlul multiplicării și diferențierii endosimbionților, restricționând astfel prezența bacteriilor la celulele simbiotice. Astfel, organismele gazdă utilizează aceste peptide efectoare pentru a îmblânzi și chiar angaja invadatori microbieni selectați pentru serviciu.
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
activitatea în laboratoarele noastre este susținută de grantul avansat”SYM-BIOTICS” al Consiliului European pentru cercetare acordat Univcva Kondorosi (grantul nr.269067) și de T. 4.2.2.A-11/1/KONV-2012-0035 susținut de Uniunea Europeană și cofinanțat de Fondul Social European.
Abdel-Lateif, K., Bogusz, D. și Hocher, V. (2012). Rolul flavonoidelor în stabilirea endosimbiozelor rădăcinilor plantelor cu ciuperci arbusculare mycorrhiza, rhizobia și bacteriile Frankia. Semnal De Plante. Comportă-te. 7, 636–641. doi: 10.4161 / psb.20039
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Alunni, B., Kevei, Z., Redondo-Nieto, M., Kondorosi, A., Mergaert, P., and Kondorosi, E. (2007). Genomic organization and evolutionary insights on GRP and NCR genes, two large nodule-specific gene families in Medicago truncatula. Mol. Plant Microbe Interact. 20, 1138–1148. doi: 10.1094/MPMI-20-9-1138
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Barnett, M. J., Fisher, R. F., Jones, T., Komp, C., Abola, A. P., Barloy-Hubler, F. și colab. (2001). Secvența nucleotidică și funcțiile prezise ale întregului sinorhizobium meliloti psyma megaplasmid. Proc. Natl. Acad. Sci. SUA 98, 9883-9888. doi: 10.1073 / pnas.161294798
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Bittner, A. N., Foltz, A. și Oke, V. (2007). Doar una dintre cele cinci gene groEL este necesară pentru viabilitate și simbioză reușită în Sinorhizobium meliloti. J. Bacteriol. 189, 1884–1889. doi: 10.1128 / JB.01542-06
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Brear, E. M., Day, D. A., and Smith, P. M. (2013). Iron: an essential micronutrient for the legume-Rhizobium symbiosis. Front. Plant Sci. 4:359. doi: 10.3389/fpls.2013.00359
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Catalano, C. M., Lane, W. S., and Sherrier, D. J. (2004). Biochemical characterization of symbiosome membrane proteins from Medicago truncatula root nodules. Electrophoresis 25, 519–531. doi: 10.1002/elps.200305711
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Capela, D., Barloy-Hubler, F., Gouzy, J., Bothe, G., Ampe, F., Batut, J. și colab. (2001). Analiza secvenței cromozomiale a leguminoaselor simbiont sinorhizobium meliloti tulpina 1021. Proc. Natl. Acad. Sci. SUA 98, 9877-9882. doi: 10.1073 / pnas.161294398
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Cebolla, A., Vinardell, J. M., Kiss, E., ol, B., Roudier, F., Kondorosi, A. și colab. (1999). Inhibitorul mitotic ccs52 este necesar pentru endoreduplicare și mărirea celulelor dependente de ploidie la plante. EMBO J. 18, 4476-4484. doi: 10.1093/emboj/18.16.4476
CrossRef text complet
Chen, W. M., Moulin, L., Bontemps, C., Vandamme, P., B, G., și Boivin-Masson, C. (2003). Fixarea simbiotică a azotului de leguminoase de către proteobacteriile de la XV este larg răspândită în natură. J. Bacteriol. 185, 7266–7272. doi: 10.1128 / JB.185.24.7266-7272.2003
CrossRef text complet
Edgar, B. A., Zielke, N., și Gutierrez, C. (2014). Endocicluri: o inovație evolutivă recurentă pentru creșterea celulelor post-mitotice. Nat. Rev. Mol. Celula. Biol. 15, 197–210. doi: 10.1038/nrm3756
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Farkas, A., Mar Unkti, G., D Unkti, H., Gy Unkti, Z., Lima, R. M., Medzihradszky, K. F.,și colab. (2014). Peptida simbiotică Medicago truncatula ncr247 contribuie la diferențierea bacteroidă prin mecanisme multiple. Proc. Natl. Acad. Sci. SUA 111, 5183-5188. doi: 10.1073 / pnas.1404169111
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Favery, B., Complainville, A., Vinardell, J. M., Lecomte, P., Vaubert, D., Mergaert, P.,et al. (2002). The endosymbiosis-induced genes ENOD40 and CCS52a are involved in endoparasitic-nematode interactions in Medicago truncatula. Mol. Plant-Microbe Interact. 15, 1008–1013. doi: 10.1094/MPMI.2002.15.10.1008
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Franssen, H. J., Vijn, I., Yang, W. C., and Bisseling, T. (1992). Developmental aspects of the Rhizobium-legume symbiosis. Plant Mol. Biol. 19, 89–107. doi: 10.1007
CrossRef Full Text
Fraysse, N., Couderc, F., and Poinsot, V. (2003). Surface polysaccharide involvement in establishing the Rhizobium–legume symbiosis. Eur. J. Biochem. 270, 1365–1380. doi: 10.1046/j.1432-1033.2003.03492.x
CrossRef Full Text
Genre, A., Chabaud, M., Faccio, A., Barker, D. G., and Bonfante, P. (2008). Asamblarea aparatului de prepenetrare precede și prezice modelele de colonizare a ciupercilor micorizale arbusculare în cortexul radicular atât al Medicago truncatula, cât și al Daucus carota. Celula Vegetală 20, 1407-1420. doi: 10.1105 / tpc.108.059014
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Handler, AA, Lim, Je, și Losick, R. (2008). Inhibitor peptidic al citokinezei în timpul sporulării în Bacillus subtilis. Mol. Microbiol. 68, 588–599. doi: 10.1111 / j. 1365-2958.2008. 06173.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Ivanov, S., Fedorova, E. E., Limpens, E., De Mita, S., Genre, A., Bonfante, P.,et al. (2012). Rhizobium–legume symbiosis shares an exocytotic pathway required for arbuscule formation. Proc. Natl. Acad. Sci. U.S.A. 109, 8316–8321. doi: 10.1073/pnas.1200407109
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Kevei, Z., Vinardell, J. M., Kiss, G. B., Kondorosi, A., and Kondorosi, E. (2002). Proteinele bogate în glicină codificate de o familie de gene specifice nodulilor sunt implicate în diferite etape ale dezvoltării nodulilor simbiotici în Medicago spp. Mol. Microbul Plantelor Interacționează. 15, 922–931. doi: 10.1094 / MPMI.2002.15.9.922
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kondorosi, E., și Kondorosi, A. (2004). Endoreduplicarea și activarea complexului de promovare a anafazei în timpul dezvoltării celulelor simbiotice. FEBS Lett. 567, 152–157. doi: 10.1016/j.febslet.2004.04.075
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Kondorosi, E., Mergaert, P. și Kereszt, A. (2013). O paradigmă pentru viața endosimbiotică: diferențierea celulară a bacteriilor Rhizobium provocate de factorii plantei gazdă. Anu. Rev. Microbiol. 67, 611–628. doi: 10.1146/annurev-micro-092412-155630
CrossRef text complet
Kupper, M., Gupta, S. K., Feldhaar, H., și Gross, R. (2014). Roluri Versatile ale groelului chaperonin în interacțiunile microorganisme-insecte. Microbiol FEMS. Let. 353, 1–10. doi: 10.1111/1574-6968.12390
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Limpens, E., Ivanov, S., van Esse, W., Voets, G., Fedorova, E., și Bisseling, T. (2009). Simbiozomii care fixează Medicago N2 dobândesc markerul de identitate Endocitar Rab7, dar întârzie dobândirea identității vacuolare. Celula Vegetală 21, 2811-2828. doi: 10.1105 / tpc.108.064410
Pubmed Abstract / Pubmed Full Text / CrossRef Full Text
Login, F. H., Balmand, S., Vallier, A., Vincent-Mon, C., Vigneron, A., Weiss-Gayet, M., și colab. (2011). Peptidele antimicrobiene țin sub control endosimbionții insectelor. Știință 334, 362-365. doi: 10.1126 / știință.1209728
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
MacLean, A. M., Finan, T. M. și Sadowsky, M. J. (2007). Genomii bacteriilor simbiotice de fixare a azotului din leguminoase. Physiol De Plante. 144, 615–622. doi: 10.1104/PP.107. 101634
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Maunoury, N., Redondo-Nieto, M., Bourcy, M., Van De Velde, W., Alunni, B., Laporte, P. și colab. (2010). Diferențierea celulelor simbiotice și a endosimbionților este cuplată la două transcriptome-switch-uri în Medicago truncatula nodulare. PLoS Unul 5: e9519. doi: 10.1371/jurnal.pone.0009519
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Mergaert, P., Nikovics, K., Kelemen, Z., Maunoury, N., Vaubert, D., Kondorosi, A. și colab. (2003). O familie nouă în Medicago truncatula constând din mai mult de 300 de gene specifice nodulilor care codifică polipeptide mici, secretate, cu motive cisteină conservate. Physiol De Plante. 132, 161–173. doi: 10.1104/pp.102.018192
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Mergaert, P., Uchiumi, T., Alunni, B., Evanno, G., Cheron, A., Catrice, O.,et al. (2006). Eukaryotic control on bacterial cell cycle and differentiation in the Rhizobium-legume symbiosis. Proc. Natl. Acad. Sci. U.S.A. 103, 5230–5235. doi: 10.1073/pnas.0600912103
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Moran, N. A. (1996). Evoluție accelerată și clichetul lui Muller în bacteriile endosimbiotice. Proc. Natl. Acad. Sci. SUA 93, 2873-2878. doi: 10.1073 / pnas.93.7.2873
CrossRef text complet
Moran, N. A., McCutcheon, J. P. și Nakabachi, A. (2008). Genomica și evoluția simbionților bacterieni ereditari. Anu. Părinte Genet. 42, 165–690. doi: 10.1146/annurev.genet.41.110306.130119
CrossRef text complet
Nakabachi, A., Koshikawa, S., Miura, T. și Miyagishima, S. (2010). Dimensiunea genomului Pachypsylla venusta (Hemiptera: Psyllidae) și ploidia bacteriocitelor sale, celula gazdă simbiotică care adăpostește bacterii mutualiste intracelulare cu cel mai mic genom celular. Taur. Entomol. Rez. 100, 27-33. doi: 10.1017 / S0007485309006737
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Nagl, W. (1976). Endoreduplicarea ADN și politenia înțelese ca strategii evolutive. Natura 261, 614-615. doi: 10.1038 / 261614a0
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Nallu, S., Silverstein, K. A., Zhou, P., Young, N. D. și Vandenbosch, K. A. (2014). Modele de divergență a unei familii mari de peptide bogate în cisteină nodulară în aderările Medicago truncatula. Planta J. 78, 697-705. doi: 10.1111 / tpj.12506
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Oldroyd, G. E. (2013). Vorbește, prietenește și intră: sisteme de semnalizare care promovează asocieri simbiotice benefice în plante. Nat. Rev. Microbiol. 11, 252–263. doi: 10.1038/nrmicro2990
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Oono, R., Schmitt, I., Sprent, J. I., and Denison, R. F. (2010). Multiple evolutionary origins of legume traits leading to extreme rhizobial differentiation. New Phytol. 187, 508–520. doi: 10.1111/j.1469-8137.2010.03261.x
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Penterman, J., Abo, R. P., De Nisco, N. J., Arnold, M. F., Longhi, R., Zanda, M.,et al. (2014). Peptidele plantei gazdă provoacă un răspuns transcripțional pentru a controla ciclul celular Sinorhizobium meliloti în timpul simbiozei. Proc. Natl. Acad. Sci. SUA 111, 3561-3566. doi: 10.1073 / pnas.1400450111
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Price, D. R., Duncan, R. P., Shigenobu, S., și Wilson, A. C. (2011). Extinderea genomului și expresia diferențială a transportorilor de aminoacizi la interfața simbiotică aphid/buchnera. Mol. Biol. Evol. 28, 3113–3126. doi: 10.1093/molbev/msr140
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Roudier, F., Fedorova, E., Lebris, M., Lecomte, P., Györgyey, J., Abad, P.,et al. (2003). The Medicago species A2-type cyclin is auxin regulated and involved in meristem formation but dispensable for endoreduplication-associated developmental programs. Plant Physiol. 131, 1091–1103. doi: 10.1104/pp.102.011122
CrossRef Full Text
Roux, B., Rodde, N., Jardinaud, M. F., Timmers, T., Sauviac, L., Cottret, L.,et al. (2014). O analiză integrată a expresiei genelor vegetale și bacteriene în nodulii rădăcinii simbiotice utilizând microdisecția cu captare laser cuplată la secvențierea ARN. Planta J. 77, 817-837. doi: 10.1111 / tpj.12442
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Shigenobu, S. și Stern, D. L. (2013). Afidele au dezvoltat noi proteine secretate pentru simbioză cu endosimbiont bacterian. Proc. Biol. Sci. 280, 20121952. doi: 10.1098 / rspb.2012.1952
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Sinharoy, S., Torres-Jerez, I., Bandyopadhyay, K., Kereszt, A., Pislariu, C. I., Nakashima, J. și colab. (2013). Regulatorul factorului de transcripție C2H2 al diferențierii simbiozomilor reprimă transcrierea genei căii secretoare VAMP721a și promovează dezvoltarea simbiozomilor în Medicago truncatula. Celula Vegetală 25, 3584-3601. doi: 10.1105 / tpc.113.114017
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Terpolilli, J. J., Hood, G. A., and Poole, P. S. (2012). What determines the efficiency of N(2)-fixing Rhizobium-legume symbioses? Adv. Microb. Physiol. 60, 325–389. doi: 10.1016/B978-0-12-398264-3.00005-X
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Tiricz, H., Szûcs, A., Farkas, A., Pap, B., Lima, R. M., Maróti, G.,et al. (2013). Antimicrobial nodule-specific cysteine-rich peptides induce membrane depolarization associated changes in Sinorhizobium meliloti. Appl. Env. Microbiol. 79, 6737–6746. doi: 10.1128/AEM.01791-13
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Van de Velde, W., Zehirov, G., Szatmari, A., Debreczeny, M., Ishihara, H., Kevei, Z.,et al. (2010). Plant peptides govern terminal differentiation of bacteria in symbiosis. Science 327, 1122–1126. doi: 10.1126/science.1184057
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text
Vinardell, J. M., Fedorova, E., Cebolla, A., Kevei, Z., Horvath, G., Kelemen, Z.,et al. (2003). Endoreduplicarea mediată de activatorul complex care promovează anafaza CCS52A este necesară pentru diferențierea celulelor simbiotice în nodulii Medicago truncatula. Celula Vegetală 15, 2093-2105. doi: 10.1105 / tpc.014373
Pubmed Abstract | Pubmed Full Text/CrossRef Full Text
Walker, S. A. și Downie, J. A. (2000). Intrarea Rhizobium leguminosarum bv. viciae în fire de păr rădăcină necesită o specificitate minimă a factorului Nod, dar creșterea ulterioară a firului de infecție necesită nodO sau nod. Mol. Planta-Microb Interacționează.13, 54–62. doi: 10.1094 / MPMI.2000.13.7.754
Pubmed Abstract | Pubmed Full Text | CrossRef Full Text