forma de dozare: injecție
Medical revizuite de Drugs.com. Ultima actualizare pe 22 decembrie 2020.
- efecte secundare
- dozare
- profesionale
- interacțiuni
- sarcina
- mai mult
numai Rx.
soluție intravenoasă sterilă
- Inamrinonă descriere
- Inamrinona – Farmacologie Clinică
- farmacocinetica
- farmacodinamică
- indicații și utilizare pentru Inamrinonă
- contraindicații
- avertismente
- Precauții
- General
- testele de laborator
- interacțiuni medicamentoase
- interacțiuni chimice
- carcinogeneză, mutageneză, afectarea fertilității
- sarcina
- mamele care alăptează
- utilizare pediatrică
- reacții Adverse
- tratamentul reacțiilor Adverse
- supradozaj
- dozarea și administrarea de Inamrinonă
- interacțiuni chimice
- cum se administrează Inamrinonă
- VIAL LABEL
- More about inamrinone
- Related treatment guides
Inamrinonă descriere
injecția de Inamrinonă USP reprezintă o nouă clasă de agenți inotropi cardiaci distincți de glicozidele digitale sau catecolaminele. Lactatul de inamrinonă este desemnat chimic ca 5-Amino-6(1h)-onă 2-hidroxipropanat și are următoarea structură:
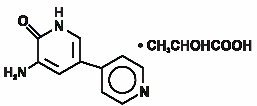
Inamrinona este un compus cristalin galben pal cu o greutate moleculară de 187,20 și o formulă moleculară de C10H9N3O. fiecare mol de acid lactic are o greutate moleculară de 90,08 și formula lui c3h6o3. Solubilitățile Inamrinonei la pH 4,1, 6,0 și 8,0 sunt de 25, 0,9 și, respectiv, 0,7 mg/mL.
injecția cu Inamrinonă este o soluție sterilă de culoare galben limpede, disponibilă în flacoane de 20 mL pentru administrare intravenoasă. Fiecare mL conține lactat de Inamrinonă echivalent cu Inamrinonă 5 mg și metabisulfit de sodiu 0, 25 mg adăugat ca conservant în apă pentru preparate injectabile. Toate dozele exprimate în prospect sunt exprimate în termeni de bază, Inamrinonă. PH-ul este ajustat între 3,2 și 4,0 cu acid lactic sau hidroxid de sodiu. Concentrația totală de acid lactic poate varia între 5 mg și 7,5 mg.
Inamrinona – Farmacologie Clinică
Inamrinona este un agent inotrop pozitiv cu activitate vasodilatatoare, diferit ca structură și mod de acțiune fie de glicozidele digitale, fie de catecolamine.
mecanismul efectelor sale inotrope și vasodilatatoare nu a fost complet elucidat.în ceea ce privește efectul său inotrop, dovezile experimentale indică faptul că nu este un agonist beta-adrenergic. Inhibă activitatea fosfodiesterazei ciclice de adenozin monofosfat ciclic (C-AMP) și crește nivelurile celulare de C-AMP. Spre deosebire de digitalis, nu inhibă activitatea adenozin trifosfatazei de sodiu-potasiu.
în ceea ce privește activitatea vasodilatatoare, Inamrinona reduce postîncărcarea și preîncărcarea prin efectul său relaxant direct asupra mușchiului neted vascular.
farmacocinetica
după injectarea intravenoasă în bolus (1 până la 2 minute) de 0, 68 mg/kg până la 1, 2 mg/kg la voluntari normali, Inamrinona a avut un volum de distribuție de 1, 2 litri / kg, iar după un timp de înjumătățire plasmatică prin distribuție de aproximativ 4, 6 minute, a avut un timp de înjumătățire plasmatică terminal aparent de ordinul întâi de aproximativ 3, 6 ore. La pacienții cu insuficiență cardiacă congestivă cărora li s-au administrat perfuzii cu Inamrinonă, timpul mediu aparent de înjumătățire plasmatică prin eliminare de ordinul întâi a fost de aproximativ 5,8 ore.într-un studiu s-a demonstrat că Inamrinona se leagă de proteinele plasmatice umane între 10% și 22% prin ultrafiltrare in vitro, iar într-un alt studiu, între 35% și 49%, fie prin ultrafiltrare, fie prin dializă de echilibru.
calea principală de excreție la om este prin urină atât ca Inamrinonă, cât și ca mai mulți metaboliți (n-glicolil, n-acetat, O-glucuronid și n-glucuronid). La voluntarii normali, aproximativ 63% din doza orală de Inamrinonă marcată cu 14C a fost excretată în urină pe o perioadă de 96 de ore. În primele 8 ore, 51% din radioactivitatea din urină a fost Inamrinonă, cu 5% sub formă de n-acetat, 8% sub formă de n-glicolat și mai puțin de 5% pentru fiecare glucuronid. Aproximativ 18% din doza administrată a fost excretată în fecale în 72 de ore.
într-un studiu intravenos non-radioactiv cu durata de 24 de ore, 10% până la 40% din doză a fost excretată în urină sub formă de Inamrinonă nemodificată, metabolitul N-acetil reprezentând mai puțin de 2% din doză.
la pacienții cu insuficiență cardiacă congestivă, după o doză de bolus de încărcare, nivelurile plasmatice la starea de echilibru de aproximativ 2,4 mcg/mL au putut fi menținute printr-o perfuzie de 5 mcg/kg/min până la 10 mcg/kg/min. La unii pacienți cu insuficiență cardiacă congestivă, cu perfuzie renală și hepatică compromisă asociată, este posibil ca nivelurile plasmatice de Inamrinonă să crească în timpul perioadei de perfuzie; prin urmare, la acești pacienți, poate fi necesară monitorizarea răspunsului hemodinamic și/sau a nivelului medicamentului. Principalele măsuri ale răspunsului pacientului includ indicele cardiac, presiunea capilară pulmonară, presiunea venoasă centrală și relația lor cu concentrațiile plasmatice. În plus, măsurătorile tensiunii arteriale, a cantității de urină și a greutății corporale se pot dovedi utile, la fel ca și simptomele clinice precum ortopneea, dispneea și oboseala.
farmacodinamică
la pacienții cu funcție miocardică deprimată, Inamrinona produce o creștere promptă a debitului cardiac datorită acțiunilor sale inotrope și vasodilatatoare.
după o singură doză intravenoasă în bolus de Inamrinonă de 0.75 mg / kg până la 3 mg/kg la pacienții cu insuficiență cardiacă congestivă, apar creșteri maxime ale debitului cardiac dependente de doză (de aproximativ 28% la 0, 75 mg/kg până la aproximativ 61% la 3 mg/kg). Efectul maxim apare în decurs de 10 minute la toate dozele. Durata efectului depinde de doză, care durează aproximativ 1/2 oră la 0,75 mg/kg și aproximativ 2 ore la 3 mg/kg.
în același interval de doze, presiunea pană capilară pulmonară și rezistența periferică totală prezintă scăderi legate de doză (scăderi maxime medii de 29% în presiunea pană capilară pulmonară și 29% în rezistența vasculară sistemică). La doze de până la 3 mg/kg s-au observat scăderi ale presiunii diastolice legate de doză (până la 13%). Presiunea arterială medie scade (9,7%) la o doză de 3 mg/kg. Ritmul cardiac este în general neschimbat.
modificările parametrilor hemodinamici sunt menținute în timpul perfuziei intravenoase continue și timp de câteva ore după aceea.
Inamrinona este eficientă la pacienții complet digitalizați, fără a provoca semne de toxicitate a glicozidelor cardiace. Efectele sale inotrope sunt aditive cu cele ale digitalisului. În cazurile de flutter/fibrilație atrială, este posibil ca Inamrinona să crească rata de răspuns ventricular datorită ușoarei sale creșteri a conducerii A/V. În aceste cazuri, se recomandă tratamentul prealabil cu digitalis.a fost observată îmbunătățirea funcției ventriculului stâng și ameliorarea insuficienței cardiace congestive la pacienții cu boală cardiacă ischemică. Ameliorarea a avut loc fără a induce simptome sau semne electrocardiografice de ischemie miocardică.
la ritmul cardiac constant și tensiunea arterială, creșterea debitului cardiac are loc fără creșteri măsurabile ale consumului de oxigen miocardic sau modificări ale diferenței de oxigen arteriovenos.
activitatea inotropică se menține după administrarea intravenoasă repetată de Inamrinonă. Administrarea de inamrinonă produce beneficii hemodinamice și simptomatice pentru pacienții care nu sunt controlați în mod satisfăcător prin terapia convențională cu diuretice și glicozide cardiace.
indicații și utilizare pentru Inamrinonă
injecția cu Inamrinonă este destinată tratamentului pe termen scurt al insuficienței cardiace congestive. Datorită experienței limitate și potențialului de reacții adverse grave (vezi reacțiile ADVERSE), Inamrinona trebuie utilizată numai la pacienții care pot fi monitorizați îndeaproape și care nu au răspuns adecvat la digitalice, diuretice și/sau vasodilatatoare. Experiența cu Inamrinonă administrată intravenos în studii controlate nu se extinde peste 48 de ore de bolusuri repetate și/sau perfuzii continue.
indiferent dacă este administrat oral, continuu intravenos sau intermitent intravenos, nici Inamrinona, nici orice alt inotrop dependent de AMP ciclic nu s-au dovedit în studiile controlate a fi sigure sau eficiente în tratamentul pe termen lung al insuficienței cardiace congestive. În studiile controlate de terapie orală cronică cu diferiți astfel de agenți (inclusiv Inamrinonă), simptomele nu au fost atenuate în mod constant, iar inotropele ciclice dependente de AMP au fost asociate în mod constant cu riscuri crescute de spitalizare și deces. Pacienții cu simptome NYHA clasa IV par să prezinte un risc deosebit.
contraindicații
Inamrinona este contraindicată la pacienții care sunt hipersensibili la aceasta.
este, de asemenea, contraindicat la acei pacienți despre care se știe că sunt hipersensibili la bisulfiți.
avertismente
conține metabisulfit de sodiu, un sulfit care poate provoca reacții de tip alergic, inclusiv simptome anafilactice și episoade astmatice care pun viața în pericol sau mai puțin severe la anumite persoane sensibile. Prevalența generală a sensibilității la sulfit în populația generală este necunoscută și probabil scăzută. Sensibilitatea la sulfit este observată mai frecvent la persoanele astmatice decât la persoanele nonastmatice.
Precauții
General
Inamrinona nu trebuie utilizată la pacienții cu boală valvulară aortică sau pulmonică severă în locul ameliorării chirurgicale a obstrucției. Ca și alți agenți inotropi, poate agrava obstrucția tractului de ieșire în stenoza subaortică hipertrofică.
în timpul tratamentului intravenos cu Inamrinonă, tensiunea arterială și ritmul cardiac trebuie monitorizate, iar viteza perfuziei trebuie încetinită sau oprită la pacienții care prezintă scăderi excesive ale tensiunii arteriale.
pacienții care au primit terapie diuretică viguroasă pot avea o presiune de umplere cardiacă insuficientă pentru a răspunde adecvat la Inamrinonă, caz în care poate fi indicată liberalizarea prudentă a aportului de lichide și electroliți.
aritmii supraventriculare și ventriculare au fost observate la populația cu risc foarte mare tratată. Deși Inamrinona în sine nu s-a dovedit a fi aritmogenă, potențialul de aritmie, prezent în insuficiența cardiacă congestivă în sine, poate fi crescut de orice medicament sau combinație de medicamente.au fost observate trombocitopenie și hepatotoxicitate (vezi reacțiile ADVERSE).
utilizare în infarctul miocardic acut
nu s-au efectuat studii clinice la pacienții aflați în faza acută a infarctului postmiocardic. Prin urmare, Inamrinona nu este recomandată în aceste cazuri.
testele de laborator
fluide și electroliți
modificările fluidelor și electroliților și funcția renală trebuie monitorizate cu atenție în timpul tratamentului cu Inamrinonă. Îmbunătățirea debitului cardiac cu diureza rezultată poate necesita o reducere a dozei de diuretic. Pierderea de potasiu datorată diurezei excesive poate predispune pacienții digitalizați la aritmii. Prin urmare, hipokaliemia trebuie corectată prin suplimentarea cu potasiu înainte sau în timpul utilizării Inamrinonei.
interacțiuni medicamentoase
într-o experiență relativ limitată, nu s-au observat manifestări clinice nedorite la pacienții la care Inamrinona a fost utilizată concomitent cu următoarele medicamente: glicozide digitale; lidocaină, chinidină; metoprolol, propranolol; hidralazină, prazosină; izosorbid dinitrat, nitroglicerină; clortalidonă, acid etacrinic, furosemid, hidroclorotiazidă, spironolactonă; captopril; heparină, warfarină; suplimente de potasiu; insulină; diazepam.
s-a raportat un caz de hipotensiune arterială excesivă atunci când Inamrinona a fost utilizată concomitent cu disopiramida.
până când este disponibilă experiență suplimentară, administrarea concomitentă cu disopiramidă trebuie efectuată cu precauție.
interacțiuni chimice
o interacțiune chimică are loc lent pe o perioadă de 24 de ore când soluția intravenoasă de Inamrinonă este amestecată direct cu soluții care conțin dextroză (glucoză). Prin urmare, Inamrinona nu trebuie diluată cu soluții care conțin dextroză (glucoză) înainte de injectare.
o interacțiune chimică are loc imediat, ceea ce este evidențiat prin formarea unui precipitat atunci când furosemidul este injectat într-o linie intravenoasă a unei perfuzii de Inamrinonă. Prin urmare, furosemidul nu trebuie administrat în linii intravenoase care conțin Inamrinonă.
carcinogeneză, mutageneză, afectarea fertilității
nu a existat nicio sugestie de potențial carcinogen cu Inamrinonă atunci când a fost administrat oral timp de până la doi ani la șobolani și șoareci la niveluri de doze până la doza maximă tolerată de 80 mg/kg și zi.
testul micronucleilor de șoarece (la 7, 5 până la 10 ori doza maximă la om) și testul aberațiilor cromozomiale ovariene de hamster chinezesc au fost pozitive, indicând atât potențialul clastogen, cât și suprimarea numărului de eritrocite policromatice. Cu toate acestea, testul Ames Salmonella, studiul limfomului la șoarece și analiza metafazei limfocitelor umane cultivate au fost toate negative. Efectele clastogene sunt în contrast cu rezultatele negative obținute în studiile de fertilitate la șobolani masculi și femele și într-un studiu cu trei generații la șobolani, ambele cu administrare orală.
în aceste studii s-a observat o ușoară prelungire a perioadei de gestație la șobolan la doze de 50 mg/kg și zi și 100 mg/kg și zi. Distocia a apărut la barajele care au primit 100 mg/kg și zi, ceea ce a dus la creșterea numărului de nașteri morți, scăderea dimensiunii puilor și supraviețuirea slabă a puilor.
sarcina
efecte teratogene – sarcina categoria C
la iepurii albi din Noua Zeelandă, s-a demonstrat că Inamrinona produce malformații fetale scheletice și externe brute la doze orale de 16 mg/kg și 50 mg / kg care au fost toxice pentru iepure. Studiile efectuate la iepuri francezi Hy/Cr utilizând doze orale de până la 32 mg/kg și zi nu au confirmat această constatare. Nu s-au observat malformații la șobolanii cărora li s-a administrat Inamrinonă intravenos la doza maximă utilizată, 15 mg/kg și zi (aproximativ doza zilnică recomandată intravenos pentru pacienții cu insuficiență cardiacă congestivă). Nu există studii adecvate și bine controlate la femeile gravide. Inamrinona trebuie utilizată în timpul sarcinii numai dacă beneficiul potențial justifică riscul potențial pentru făt.
mamele care alăptează
se recomandă prudență atunci când Inamrinona este administrată femeilor care alăptează, deoarece nu se știe dacă este excretată în laptele uman.
utilizare pediatrică
siguranța și eficacitatea la pacienții pediatri nu au fost stabilite.
reacții Adverse
trombocitopenie: Injecția intravenoasă de Inamrinonă a determinat reducerea numărului de trombocite sub 100000 / mm3 sau limite normale la 2,4% dintre pacienți.
este mai frecvent la pacienții care primesc terapie prelungită. Până în prezent, în studiile clinice atent monitorizate, la pacienții al căror număr de trombocite nu a fost permis să rămână deprimat, nu au fost observate fenomene de sângerare.
reducerea trombocitelor este dependentă de doză și apare datorită scăderii timpului de supraviețuire a trombocitelor. Mai mulți pacienți care au dezvoltat trombocitopenie în timpul tratamentului cu Inamrinonă au avut examinări ale măduvei osoase care au fost normale. Nu există dovezi referitoare la reducerea trombocitelor la răspunsul imun sau la un factor de activare a trombocitelor.
efecte gastro-intestinale: reacțiile adverse gastro-intestinale raportate cu Inamrinonă în timpul utilizării clinice au inclus greață (1, 7%), vărsături (0, 9%), dureri abdominale (0, 4%) și anorexie (0, 4%).
efecte cardiovasculare: reacțiile adverse cardiovasculare raportate cu Inamrinonă includ aritmie (3%) și hipotensiune arterială (1, 3%).
toxicitate hepatică: La câini, la doze IV cuprinse între 9 mg/kg și zi și 32 mg/kg și zi, Inamrinona a prezentat hepatotoxicitate legată de doză manifestată fie ca creștere a enzimelor, fie ca necroză celulară hepatică sau ambele. La om s-a observat hepatotoxicitate după administrarea orală pe termen lung și s-a observat, într-o experiență limitată (0, 2%), după administrarea intravenoasă de Inamrinonă. Au existat, de asemenea, rapoarte rare de creștere a enzimelor și bilirubinei și icter.
hipersensibilitate: au fost raportate mai multe reacții de hipersensibilitate aparente la pacienții tratați cu Inamrinonă orală timp de aproximativ două săptămâni. Semnele și simptomele au fost variabile, dar au inclus pericardită, pleurită și ascită (1 caz), miozită cu umbră interstițială pe radiografie toracică și rată crescută de sedimentare (1 caz) și vasculită cu densități pulmonare nodulare, hipoxemie și icter (1 caz). Primul pacient a murit, nu neapărat din cauza reacției posibile, în timp ce ultimii doi s-au rezolvat odată cu întreruperea tratamentului. Niciunul dintre cazuri nu a fost rechemat, astfel încât atribuirea Inamrinonei nu este sigură, dar trebuie luate în considerare posibile reacții de hipersensibilitate la orice pacient menținut pentru o perioadă prelungită de tratament cu Inamrinonă.
General: reacțiile adverse suplimentare observate în studiile clinice cu Inamrinonă intravenoasă includ febră (0, 9%), durere toracică (0, 2%) și arsură la locul injectării (0, 2%).
tratamentul reacțiilor Adverse
reducerea numărului de trombocite: Reducerea asimptomatică a numărului de trombocite (la <150.000/mm3) poate fi inversată în decurs de o săptămână de la scăderea dozei de medicament. Mai mult, fără nicio modificare a dozei de medicament, numărul se poate stabiliza la niveluri mai mici decât cele anterioare medicamentului, fără sechele clinice. Numărul de trombocite pre-medicament și numărul frecvent de trombocite în timpul terapiei sunt recomandate pentru a ajuta la deciziile privind modificările dozei.
Dacă apare un număr de trombocite mai mic de 150.000 / mm3, pot fi luate în considerare următoarele acțiuni:
• mențineți doza zilnică totală neschimbată, deoarece, în unele cazuri, numărul s-a stabilizat sau a revenit la nivelurile anterioare tratamentului. * Reduceți doza zilnică totală. * Întrerupeți Inamrinona dacă, în opinia clinică a medicului, riscul depășește beneficiul potențial. reacții adverse gastro-intestinale: în timp ce reacțiile adverse gastro-intestinale au fost observate rar în cazul terapiei intravenoase, în cazul apariției celor severe sau debilitante, medicul poate dori să reducă doza sau să întrerupă medicamentul pe baza considerentelor obișnuite beneficiu-risc.
toxicitate hepatică: În experiența clinică până în prezent cu administrare intravenoasă, hepatotoxicitatea a fost observată rar. Dacă apar modificări acute marcate ale enzimelor hepatice împreună cu simptome clinice care sugerează o reacție de hipersensibilitate idiosincratică, tratamentul cu Inamrinonă trebuie întrerupt imediat.
dacă apar modificări enzimatice mai puțin marcate fără simptome clinice, aceste modificări nespecifice trebuie evaluate individual. Clinicianul poate dori să continue Inamrinona, să reducă doza sau să întrerupă medicamentul pe baza considerentelor obișnuite de beneficiu/risc.
supradozaj
s-a raportat un deces cu o supradoză accidentală masivă (840 mg în decurs de trei ore prin bolus inițial și perfuzie) de Inamrinonă, deși relația cauzală este incertă. Trebuie exercitată diligență în timpul pregătirii și administrării produsului.
dozele de Inamrinonă pot produce hipotensiune arterială datorită efectului vasodilatator. Dacă se întâmplă acest lucru, administrarea de Inamrinonă trebuie redusă sau întreruptă. Nu se cunoaște un antidot specific, dar trebuie luate măsuri generale pentru sprijinul circulator.
la șobolani, LD50 de Inamrinonă, ca sare lactată, a fost de 102 mg/kg sau 130 mg/kg intravenos în două studii diferite și 132 mg/kg oral (intragastric); ca suspensie în tragacant apos de gumă, LD50 oral a fost de 239 mg / kg.
dozarea și administrarea de Inamrinonă
dozele de încărcare a injecției de Inamrinonă trebuie administrate așa cum este furnizat (nediluat). Infuziile de Inamrinonă pot fi administrate în soluție salină normală sau jumătate normală la o concentrație de 1 mg/mL până la 3 mg/mL. Soluțiile diluate trebuie utilizate în decurs de 24 de ore.
injecția cu Inamrinonă poate fi administrată în perfuzii de dextroză (glucoză) prin intermediul unui conector Y sau direct în tub, dacă este preferabil.
interacțiuni chimice
o interacțiune chimică are loc lent pe o perioadă de 24 de ore când soluția intravenoasă de Inamrinonă este amestecată direct cu soluții care conțin dextroză (glucoză). Prin urmare, Inamrinona nu trebuie diluată cu soluții care conțin dextroză (glucoză) înainte de injectare.
o interacțiune chimică are loc imediat, ceea ce este evidențiat prin formarea unui precipitat atunci când furosemidul este injectat într-o linie intravenoasă a unei perfuzii de Inamrinonă. Prin urmare, furosemidul nu trebuie administrat în linii intravenoase care conțin Inamrinonă.
se recomandă următoarea procedură pentru administrarea injecției cu Inamrinonă:
1. Inițiați tratamentul cu o doză de încărcare de 0, 75 mg/kg administrată lent timp de 2 până la 3 minute.
|
LOADING DOSE DETERMINATION 0.75 mg/kg (undiluted) |
||||||||||
|
Patient Weight in kg |
||||||||||
|
mL of undiluted Inamrinone Injection |
||||||||||
2. Continue therapy with a maintenance infusion between 5 mcg/kg/min and 10 mcg/kg/min.
3. Based on clinical response, an additional loading dose of 0.75 mg/kg may be given 30 minutes after the initiation of therapy.
4. Viteza perfuziei variază de obicei de la 5 mcg/kg/min la 10 mcg/kg/min, astfel încât doza zilnică totală recomandată (inclusiv dozele de încărcare) să nu depășească 10 mg/kg. Un număr limitat de pacienți studiați la doze mai mari susțin un regim de dozare de până la 18 mg/kg și zi pentru durate scurte de tratament.
următoarea diagramă a vitezei de perfuzare poate fi utilizată pentru a asigura efectuarea corectă a calculelor.
pentru a utiliza graficul, concentrația soluției perfuzabile de Inamrinonă utilizată trebuie să fie de 2,5 mg/mL (2500 mcg / mL). Această concentrație se prepară prin amestecarea soluției de Inamrinonă cu un volum egal de diluant (soluție salină normală sau jumătate normală).
| * diluare: pentru a prepara concentrația de 2,5 mg / mL recomandată pentru perfuzie se amestecă Inamrinonă cu un volum egal de diluant. De exemplu, se amestecă trei flacoane de 20 mL de Inamrinonă (3 x 20 mL = 60 mL) cu 60 mL de diluant pentru un volum total de 120 mL din soluția finală de 2,5 mg/mL de Inamrinonă. | ||||||||||
|
Inamrinone IV INFUSION RATE (mL/hr) CHART Using 2.5 mg/mL Infusion Concentration* |
||||||||||
|
Patient Weight in kg |
||||||||||
|
Dosage: 5.0 mcg/kg/min |
||||||||||
|
7.5 mcg/kg/min |
||||||||||
|
10.0 mcg/kg/min |
||||||||||
Example: A 70 kg patient would require a loading dose of 10.5 mL of undiluted Inamrinone. If the physician selects a dose of 7.5 mcg/kg/min pentru perfuzie, debitul ar fi de 13 mL/oră la concentrația de 2, 5 mg / mL de Inamrinonă.
5. Rata de administrare și durata tratamentului trebuie ajustate în funcție de răspunsul pacientului. Medicul poate dori să reducă sau să titreze perfuzia în jos pe baza răspunsului clinic sau a efectelor nedorite.
este de așteptat ca schemele de dozare de mai sus să plaseze concentrația plasmatică a Inamrinonei la majoritatea pacienților la aproximativ 3 mcg / mL. Creșterea indicelui cardiac arată o relație liniară cu concentrația plasmatică de un interval de 0.5 mcg / mL până la 7 mcg / mL. Nu s-au făcut observații la concentrații plasmatice mai mari.
ameliorarea pacientului poate fi reflectată de creșterea debitului cardiac, reducerea presiunii capilarelor pulmonare și răspunsuri clinice precum diminuarea dispneei și ameliorarea altor simptome ale insuficienței cardiace, cum ar fi ortopneea și oboseala.
monitorizarea presiunii venoase centrale (CVP) poate fi valoroasă în evaluarea hipotensiunii arteriale și a managementului echilibrului fluidelor. Corectarea sau ajustarea prealabilă a fluidului / electroliților este esențială pentru a obține un răspuns satisfăcător cu Inamrinonă.
medicamentele parenterale trebuie inspectate vizual și nu trebuie utilizate dacă se observă particule sau decolorare.
cum se administrează Inamrinonă
Inamrinonă injectabilă USP este disponibil în flacoane unidoză a 20 mL soluție sterilă, de culoare galben deschis, ambalate individual. NDC 55390-042-10.
fiecare 1 mL conține lactat de Inamrinonă echivalent cu Inamrinonă 5 mg.
A se proteja de lumină. Ambalajul este rezistent la lumină pentru protecție în timpul depozitării. Păstrați în cutie până la momentul utilizării.
A se păstra la temperatura controlată a camerei 15-30-30-C (59-86-F).
Manufactured by: Manufactured for:
Ben Venue Laboratories, Inc. Bedford Laboratories™
Bedford, OH 44146 Bedford, OH 44146
August 2002 AMR-P01
VIAL LABEL

Vial Label 100 mg/20 mL
| Inamrinone Inamrinone injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Bedford Laboratories (884528407)
Registrant – Ben Venue Laboratories (004327953)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Ben Venue Laboratories Inc. | 004327953 | MANUFACTURE(55390-042) | |
More about inamrinone
- Side Effects
- During Pregnancy
- Dosage Information
- Drug Interactions
- Drug class: inotropic agents
Related treatment guides
- Heart Failure
Medical Disclaimer