
Sau (Larry) Lee, Ph.D., Director Adjunct al Oficiului de testare și cercetare și președinte al echipei de tehnologie emergentă, Office of Pharmaceutical Quality, CDER
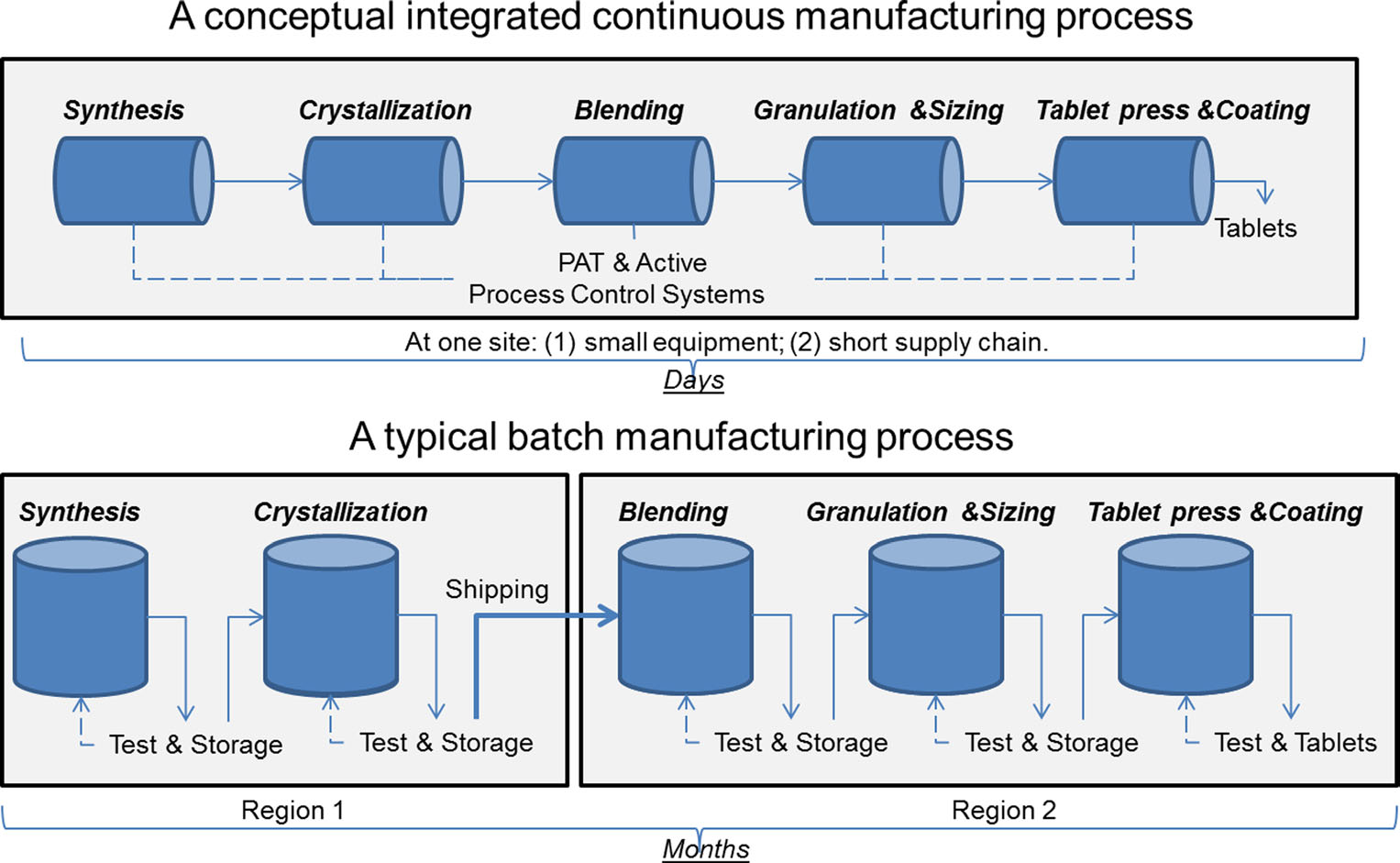 o comparație a producției continue și a producției în serie. Pentru imagine, multumim sau Lee. J. Pharm Innov (2015) 10:191-199.
o comparație a producției continue și a producției în serie. Pentru imagine, multumim sau Lee. J. Pharm Innov (2015) 10:191-199.de mai bine de 50 de ani, produsele farmaceutice au fost produse folosind o metodă cunoscută sub numele de „fabricare în serie”, un proces în mai multe etape, de lungă durată, care implică utilizarea de echipamente la scară largă. Cu toate acestea, progresele recente în tehnologia de fabricație au determinat industria farmaceutică să ia în considerare trecerea de la fabricarea în serie la un proces mai rapid și mai eficient cunoscut sub numele de fabricație continuă. FDA ia măsuri proactive pentru a facilita implementarea de către industria farmaceutică a tehnologiilor emergente, inclusiv fabricarea continuă, pentru a îmbunătăți calitatea produselor și pentru a aborda multe dintre cauzele care stau la baza penuriei și rechemărilor de medicamente.
lot vs. continuă de fabricație
lot de fabricație implică mai multe etape discrete. După fiecare etapă a procesului, producția se oprește de obicei, astfel încât probele pot fi testate offline pentru calitate. Uneori, în timpul acestor „perioade de așteptare” între pași, materialul poate fi depozitat în containere sau expediat în alte instalații din întreaga lume pentru a finaliza procesul de fabricație. Acest lucru poate adăuga săptămâni sau luni la timpul de procesare. Pentru unele ingrediente active care sunt sensibile la mediu, de asemenea, poate introduce riscul de degradare. În plus, dacă cererea pentru un anumit medicament crește, producția crescută poate necesita echipamente mai mari. Această extindere a echipamentelor necesită mai mult spațiu fizic, o amprentă mai mare și mai mult timp și bani.
în schimb, produsele farmaceutice care sunt fabricate folosind fabricarea continuă sunt mutate non-stop în aceeași instalație, eliminând timpii de așteptare între pași. Materialul este alimentat printr-o linie de asamblare a componentelor complet integrate. Această metodă economisește timp, reduce probabilitatea de eroare umană și poate răspunde mai rapid la schimbările pieței. Pentru a ține cont de cererea mai mare, producția continuă poate funcționa pentru o perioadă mai lungă de timp, ceea ce poate reduce probabilitatea penuriei de droguri.
ambele tipuri de producție sunt supuse acelorași standarde de control al calității, dar monitorizarea este automatizată în instalațiile de producție continuă și tinde să fie mai frecventă decât în fabricarea loturilor. La fel ca toate tehnologiile, echipamentele de fabricație continuă pot experimenta uzura, dar monitorizarea automată poate detecta probleme cu mult înainte de apariția unei defecțiuni. O astfel de monitorizare poate ajuta, de asemenea, la prezicerea speranței de viață a unui echipament, ceea ce duce la o mai bună întreținere proactivă.
în cele din urmă, fabricarea continuă poate permite o urmărire și o urmărire mai flexibile, ceea ce ar reprezenta un avantaj în cazul unei defecțiuni a produsului. De exemplu, în fabricarea lotului, o cantitate specifică (sau lot) a unui medicament este definită de dimensiunea echipamentului care l-a produs. În fabricarea continuă, o cantitate (sau lot) poate fi delimitată printr-o ștampilă de timp, cantitatea de medicament produsă sau cantitatea de materie primă de intrare. Aceste metode de urmărire permit producătorului să izoleze o cantitate mai mică de material defect în cazul unei defecțiuni a procesului, ceea ce duce la mai puține deșeuri și la mai puține șanse de lipsă.
o tranziție provocatoare, dar utilă
Mai multe industrii—cum ar fi industria chimică și petrochimică—au suferit deja o evoluție a producției și utilizează tehnologii continue eficiente pentru fabricarea în siguranță a produselor. Dar pentru industria farmaceutică, tranziția la producția continuă este încă în stadiile incipiente din mai multe motive. În primul rând, costurile de pornire pentru o astfel de tranziție pot fi ridicate. Retragerea echipamentelor vechi de lot, achiziționarea de noi tehnologii și instruirea personalului cu privire la modul de utilizare și modernizarea infrastructurii industriei este costisitoare, necesitând un angajament serios din partea unui producător de medicamente. Totuși, analizele economice au arătat potențiale economii semnificative pe termen lung. În plus, unele tehnologii trebuie încă să se maturizeze înainte de a fi viabile din punct de vedere comercial. Pentru anumite tipuri de medicamente, cum ar fi produsele biologice, tehnologia de producere a acestora prin fabricare continuă poate să nu existe încă. Cercetarea este în curs de desfășurare pentru a aborda aceste și alte provocări. În plus, producătorii de medicamente încă percep incertitudinea de reglementare care poate întârzia aprobarea produsului atunci când se utilizează o nouă tehnologie de fabricație.pe măsură ce industria ia în considerare modul de a face trecerea, FDA furnizează resurse și informații pentru a facilita tranziția. De exemplu, agenția colaborează cu Autoritatea de cercetare și dezvoltare avansată biomedicală, un program din cadrul Departamentului de sănătate și Servicii Umane din SUA, pentru a ajuta la finanțarea și susținerea cercetării în acest domeniu. De asemenea, instruim personalul nostru de revizuire și efectuăm cercetări interne privind zonele de risc asociate producției continue, astfel încât să putem evalua mai bine tehnologiile conexe.
conduc o echipă multidisciplinară în cadrul Programului de tehnologie emergentă din biroul de calitate farmaceutică al CDER. Programul a fost creat pentru a ajuta industria să implementeze tehnologii inovatoare pentru a îmbunătăți calitatea produselor și a moderniza industria, într-un efort de a aborda cauzele care stau la baza deficitului de droguri sau rechemări. Programul de tehnologie emergentă abordează nu doar tehnologiile de fabricație continuă, ci și alte progrese, cum ar fi imprimarea 3d, formele de dozare noi și sistemele de containere noi. În cadrul acestui program, ne angajăm cu industria la începutul procesului de dezvoltare a noilor tehnologii și discutăm orice probleme de reglementare sau științifice anticipate care ar putea face parte dintr-o aplicație viitoare.
multe companii au aplicat la Programul de tehnologie emergentă în ceea ce privește interesul lor pentru producția continuă. Documentul FDA intitulat, avansarea aplicațiilor tehnologice emergente pentru modernizarea îndrumării bazei de producție farmaceutică pentru industrie oferă informații și sfaturi despre cum să lucrați cu Agenția la începutul procesului de dezvoltare.
citiți mai multe despre eforturile FDA de a moderniza producția de medicamente în blogul vocal al FDA.