primul medicament biologic, insulina umanizată (5,8 kDa), a devenit disponibil în 1982 după apariția biotehnologiei și a marcat o nouă eră în industria farmaceutică. Progresele moderne în biotehnologie permit sinteze la scară largă ale biologilor într-un mod mai mult sau mai puțin rentabil. După ce a început odată cu peptide mari și proteine recombinante, biologics include în prezent o gamă largă de alte entități, cum ar fi anticorpi, anticorpi monoclonali și, mai recent, nanocorpi și obiecte conexe, receptori solubili, ADN recombinant, conjugați anticorp-medicament (ADC), proteine de fuziune, imunoterapeutice și vaccinuri sintetice.
steaua în ascensiune a medicamentelor biologice a captat atenția din ce în ce mai mare a profesioniștilor din domeniul farmaceutic și a analiștilor din industrie, deoarece această paradigmă alternativă de descoperire a medicamentelor reprezintă o provocare substanțială de afaceri pentru paradigma tradițională de descoperire a medicamentelor cu molecule mici care definește industria farmaceutică de mai bine de un secol.
deci se pune întrebarea: moleculele mici pierd „atractivitatea” ca obiecte de cercetare pentru descoperirea drogurilor în lumea modernă a progreselor biologice? Unii experți rămân optimiști cu privire la potențialul moleculelor mici de a conduce cursa în viitoarele conducte farmaceutice, alții percep că „banii schimbă buzunarele”, iar cercetarea moleculelor mici va fi din ce în ce mai neglijată de acționari și investitori în favoarea biologics.
pentru a afla unde se îndreaptă industria, să începem mai întâi cu un pic de statistici. Pe o perioadă de 7 ani (2010-2017) S. U. A. Food and Drug Administration (FDA) a aprobat un total de 262 de noi entități moleculare (NME), excluzând mai mulți agenți de imagistică diagnostică și 1 analog de insulină (ref). Se pare că 76% dintre ele sunt molecule mici (199), doar un sfert fiind biologice. Interesant este că nu există o creștere aparentă a aprobărilor NMEs biologice în raport cu moleculele mici, deoarece ambele categorii de terapeutice sunt în tendință într-un mod destul de similar, așa cum se arată în diagrama de mai jos. Cu toate acestea, din moment ce biologics au un preț foarte diferit de moleculele mici (sunt mult mai scumpe), imaginea este diferită atunci când se analizează vânzările totale și creșterea veniturilor: în perioada 2011-2017, veniturile din vânzări biologice au crescut cu 70%, ajungând la 232 miliarde de dolari. Ponderea pieței farmaceutice totale pe care o dețin biologics a crescut de la 16% în 2006 până la 25% în 2016, fără semne aparente de încetinire (ref).
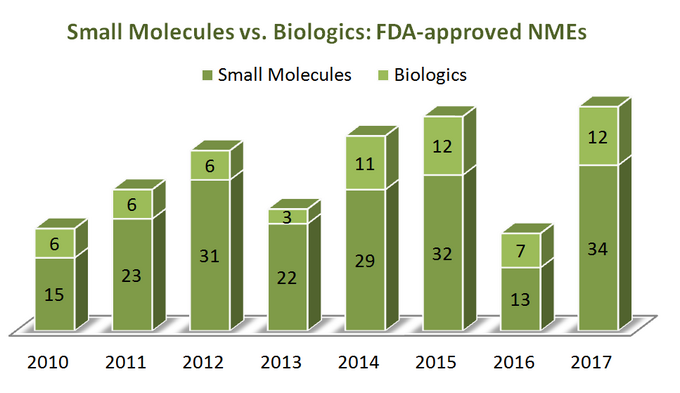
în timp ce există avantaje distincte ale biologilor față de moleculele mici în mai multe moduri (de exemplu, selectivitatea lor profundă), lucrurile nu sunt „alb-negru” atunci când se compară aceste două categorii de terapeutice prin atributele lor, deoarece ambele au argumente pro și contra substanțiale de luat în considerare în timpul luării deciziilor strategice. Deci, pare un pic regretabil să vedem cât de numeroase rapoarte au marginalizat SMs-urile în comparație cu biologics, în căutarea „prospețimii” punctelor lor de vedere.
un tabel de mai jos rezumă câteva aspecte puternice și slabe ale ambelor categorii (ref, ref) ilustrând provocările și oportunitățile disponibile în ambele ” tabere „(notă culori: gri – nici un avantaj aparent în nici o tabără; verde-situație avantajoasă; galben-situație dezavantajoasă):
molecule mici |
biologice |
proprietăți generale |
|---|---|
|
greutăți moleculare mici (0,1 – 1 kDa); de obicei stabil chimic și termic, gamă largă de polaritate. |
greutăți moleculare foarte mari > 1 kDa; în general polar, sensibil la căldură, ușor degradat (cu excepția unor tipuri de lungă durată, cum ar fi anticorpii monoclonali) |
|
selectivitate, siguranță |
|
|
Mai degrabă promiscuu, de obicei, se leagă de diferite site-uri off-țintă, făcând efecte secundare sau toxicitate. în cele din urmă, dezvoltatorii biologici au avut o perioadă mai ușoară de obținere a brevetelor, deoarece există puține sau deloc state-of-art în domeniu, când au fost descoperite blockbusterele actuale. |
foarte specifice țintelor, în general de toxicitate mai scăzută (cu o excepție majoră fiind cea a imunogenității, care poate influența serios eficiența, siguranța și dispunerea substanțelor biologice). |
|
permeabilitatea celulară |
|
|
SMS se leagă cu ținte precum receptorii cuplați cu proteina G (GPCR), canalele ionice cu ligand și receptorii tirozin kinaze pe domeniile extracelulare sau intracelulare. Aceștia pot accesa ținte în regiunile intracelulare, citosoli, nuclee și chiar ținte ale SNC, separate de bariera hematoencefalică strânsă (BBB). |
o mare parte din țintele farmacologice sunt încorporate și, prin urmare, inaccesibile biologilor. În special, când vine vorba de sistemul nervos central (SNC), prezența barierei hematoencefalice este un obstacol major în calea oricăror molecule mai mari de 600 Da care restricționează până la 98% din SMs și practic toate substanțele biologice. |
|
livrare |
|
|
se încadrează în mare măsură în „regula celor cinci” pentru absorbția orală, făcându-l potrivit pentru administrarea orală. Permeabilitatea ulterioară prin epiteliul intestinal este mediată în primul rând de o combinație de difuzie pasivă și transport paracelular. |
instabilitatea intrinsecă și masele moleculare mari fac aproape toate substanțele biologice inactive Oral. În principal, livrarea invazivă sau tehnologiile alternative neinvazive în curs. |
|
distribuție |
|
|
SMs-urile sunt distribuite prin circulația sângelui, permițând atingerea rapidă a concentrațiilor de pick. |
pentru molecule mai mari (de exemplu,> 10 kDa) un sistem limfatic mai lent (de 100-500 de ori) devine dominant în procesul de distribuție. Biologii mai mari se distribuie atât prin sânge, cât și prin sistemele limfatice în mișcare transport convectiv, endocitoză mediată de receptor, fagocitoză și pinocitoză. Rezultatul acestei situații este că substanțele biologice mai mari au timpi de înjumătățire mai lungi, volume limitate de distribuție și au nevoie de mai mult timp pentru a atinge concentrațiile maxime, în comparație cu SMs. |
|
Disposition (metabolism) |
|
|
majoritatea SMs-urilor sunt eliminate de organe nețintite-prin metabolizări citocrome sau non-citocrome, filtrare renală sau excreție fecală. |
biologii au interacțiuni mai strânse cu țintele, astfel încât dispozițiile lor sunt direct afectate de legarea lor (dispoziția medicamentului mediată de receptor), inclusiv distanțele biologice de către proteaze și peptidază. |
|
interacțiuni medicamentoase |
|
|
SMs-urile sunt predispuse la interacțiuni medicamentoase care pot apărea din cauza prezenței medicamentelor concomitente care le afectează căile de transport, metabolism, transport sau eliminare. |
Biologics sunt mai puțin predispuse la interacțiuni medicamentoase tradiționale, deoarece acestea sunt supuse metabolismului și eliminarea ca substraturi endogene. Cu toate acestea, există modificări documentate mediate de citokine în enzimele de metabolizare a medicamentelor, prin urmare interacțiunile medicamentoase biologice trebuie evaluate în cazul în care medicamentul ar putea influența expresia enzimelor metabolice. |
|
aspecte de afaceri |
|
|
prețuri mici pentru medicamentele SM. |
De obicei, prețuri foarte mari pentru tratamentele biologice. Acesta este considerat unul dintre motivele pentru care biologics pare să ofere randamente economice globale mai bune, în comparație cu SMs-urile. |
|
rata ridicată de uzură (studiul din 2009 realizat de Grupul KMR a arătat că doar 7,1% din SMs-urile care intră în testarea preclinică au ajuns în cele din urmă pe piață). |
rata relativ scăzută de uzură (același studiu de grup KMR a arătat că 24,4% din biologii preclinici au supraviețuit până la stadiul de piață). |
|
Severe competition from chemical generics after patents expiration. |
Biologics developers face less severe competition from biosimilars, after patents expiration. |
|
Simpler drug discovery/development process. |
More expensive and complex drug discovery and development process, compared to biologics. |
având în vedere comparația de mai sus, devine evident că biologics nu sunt un „glonț magic” și industria nu va fi dominată de biologics în viitorul previzibil, mai degrabă, un echilibru competitiv va fi menținut între molecule mici, biologice și forme hibride de dominarea locală a fiecărei forme în zone terapeutice mai potrivite, cazuri de utilizare etc.
în plus, mai jos este o listă a mai multor factori din industrie care joacă pe partea moleculelor mici și ar putea influența echilibrul puterilor pe piața farmaceutică totală în favoarea punctelor de plecare chimice:
creșterea inteligenței artificiale (AI) în descoperirea medicamentelor
în urma descoperirilor în algoritmii de învățare profundă (2012) și, mai recent, crearea de rețele contradictorii generative (Gan), capabile să exceleze într-o serie de sarcini de cercetare, interesul pentru mult fiecare industrie. Multe instrumente alimentate de AI au devenit rapid mainstream comercial, cum ar fi chatbots, asistenți personali, autopilot etc.– care este o dovadă din lumea reală a conceptului de fezabilitate AI.
descoperirea de droguri nu este o excepție de la această „tendință bazată pe AI”, iar numărul startup-urilor care încearcă să aplice AI pentru a stimula descoperirea de droguri în moduri diferite a crescut substanțial în doar câțiva ani, ajungând la peste o sută de companii active până în prezent (aici este o listă a unora dintre ele).
interesant, majoritatea startup bazate pe AI este axat pe molecule mici de descoperire de droguri, mai degrabă decât biologice, care este, probabil, nu este surprinzător. Din punct de vedere istoric, chiar și metodele de calcul non-AI (cheminformatica) au fost utilizate în principal pentru terapiile cu molecule mici datorită structurilor moleculare substanțial mai simple și modelelor de interacțiune.
diagrama de mai jos prezintă o statistică estimată pentru 61 de startup-uri de descoperire a medicamentelor comercializate în mod activ, care dezvoltă sau aplică instrumente ai specializate în fluxul lor de lucru de cercetare. După cum puteți vedea, jumătate din toate companiile (51%, 31 startup-uri) se concentrează pe molecule mici, în timp ce doar 23% (14 startup-uri) sunt implicate în descoperirea/dezvoltarea medicamentelor biologice (anticorpi, vaccinuri etc.). Disproporția față de moleculele mici este, de asemenea, bine ilustrată de suma finanțării VC strânse colectiv de 61 de startup-uri revizuite bazate pe AI (doar runde dezvăluite public)-unde 770 de milioane au fost investite în acele companii implicate în molecule mici și doar puțin peste 200 de milioane au fost alocate pentru start-up-uri axate pe biologie-așa cum se arată mai jos.
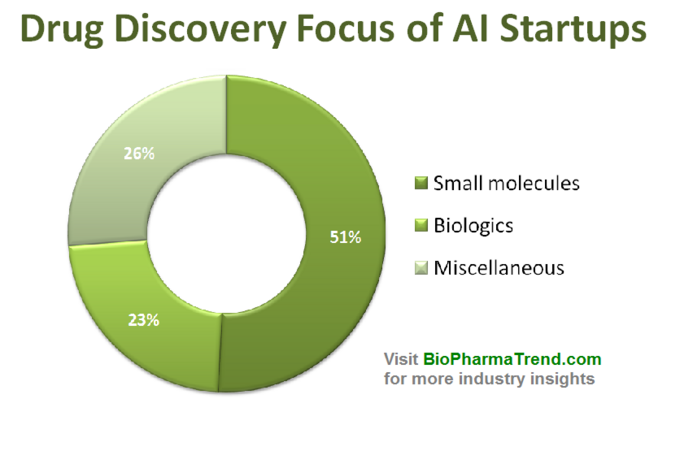
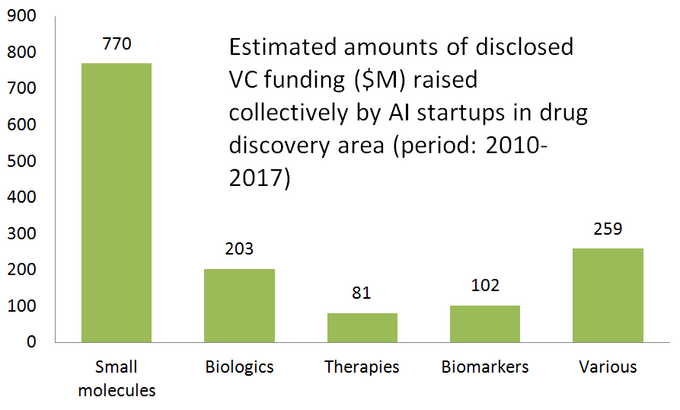
această situație sugerează că progresele recente în algoritmii AI și tendința de a aplica învățarea automată pentru cercetarea farmaceutică în stadiu incipient tind să conducă la o creștere mai mare a descoperirii medicamentelor cu molecule mici, comparativ cu descoperirea biologică-cel puțin deocamdată. Acest lucru ar putea duce la mai multe investiții viitoare în proiecte mici axate pe molecule, susținute de tehnologii bazate pe AI.
atingerea țintelor „nedrugabile”
astfel de ținte importante, cum ar fi, de exemplu, interacțiunile proteine-proteine (IPP), sunt în mod tradițional dominate de biologici (mab) ca potențiali actori, în timp ce moleculele mici au fost considerate de mult timp nepotrivite în acest caz datorită dimensiunilor lor mici.
cu progresele în farmacogenomică, această situație se poate schimba destul de repede în urma aprobărilor maraviroc (514 Da) și tirofiban (441 Da). S-a descoperit din punct de vedere computațional că SMs-urile pot avea de fapt afinități relativ ridicate la interfețele specifice ale proteinelor și, important, pot modula regiunile proteice intrinsec dezordonate legate de un set de boli complexe ale sistemelor. Iată o acoperire interesantă a acestui subiect care rezumă unele dintre informațiile importante despre mașinile PPI obținute în ultimele decenii.
o altă zonă în creștere rapidă pentru descoperirea medicamentelor cu molecule mici vizează acidul ribonucleic (ARN). Acest subiect a fost listat în” Top 7 tendințe în cercetarea farmaceutică în 2018″și, de asemenea, a existat o revizuire detaliată a subiectului în biologia chimică celulară și o acoperire frumoasă a industriei în C&EN.
o altă idee proaspătă de a dezlănțui puterea moleculelor mici a fost discutată într-un articol recent”degradatorii de proteine țintiți redefinesc modul în care moleculele mici arată și acționează”publicat în C& EN în 2018. Strategia de aici este de a dezvolta molecule bifuncționale mici capabile să direcționeze o proteină vizată cu totul către proteazom, mașina de eliminare a gunoiului celulei, în loc să inhibe doar acțiunea proteinei ca într-o abordare tradițională.
depășirea limitărilor tehnologiilor de screening
o mulțime de potențial de cercetare a moleculelor mici nu a fost încă realizat din cauza diferitelor limitări tehnologice ale abordărilor de screening utilizate pentru identificarea punctelor de plecare în programele de descoperire a medicamentelor.
un astfel de exemplu este abordarea de screening fenotipic, care se confruntă cu renaștere în zilele noastre datorită mai multor progrese tehnologice, inclusiv capacitatea crescândă de a dezvolta modele celulare relevante fiziologic, citiri și tehnologii sofisticate de detectare care ajută la dezvăluirea mecanismelor de acțiune (MoA) mai eficient, minimizând incertitudinea. Pe de altă parte, implementarea tehnicilor de profilare la scară largă și a metodelor de calcul oferă un nou nivel de analiză a sistemelor și înțelegere a fenotipurilor cu molecule mici.
o altă paradigmă promițătoare de screening este prin utilizarea bibliotecilor codificate ADN (DELs). Datorită aranjamentului său unic, tehnologia DEL oferă o modalitate adecvată de a testa sute de milioane și chiar miliarde de molecule noi în programele de descoperire a medicamentelor bazate pe țintă. În timp ce această tehnologie nu este lipsită de provocări (de exemplu, limitări ale chimiei compatibile cu ADN-ul, incertitudinea cu loviturile de screening etc.), zona este în creștere rapidă și este chiar considerată revoluționară pentru descoperirea medicamentelor cu molecule mici.
depășirea barierei de sintetizare
una dintre pietrele de poticnire ale descoperirii timpurii a moleculelor mici de droguri este o limitare a spațiului chimic accesibil sintetic-în timp ce o mulțime de idei chimice promițătoare pot fi generate computațional sau altfel, există întotdeauna riscul ca sintetizarea întregului set de compuși pentru a valida astfel de idei să fie costisitoare sau chiar irealizabilă.progresele recente în acest domeniu au fost făcute, din nou, folosind software bazat pe AI care oferă performanțe de planificare a sintezei la nivel uman. De exemplu, BenevolentAI a publicat recent o lucrare în natură, descriind modul în care au folosit rețele neuronale profunde în combinație cu algoritmi moderni de căutare a copacilor pentru a planifica sinteza moleculelor noi cu o rată și o viteză remarcabile de succes.mai multe cover up-uri interesante cu comentarii bogate au fost publicate aici și aici de Derek Lowe oferind un pic mai mult introspecție în această zonă fascinantă a chimiei organice și medicinale.
o strategie mai empirică a fost dezvoltată de un producător chimic Enamine, care este cunoscut sub numele de spațiu chimic REAL, și include în prezent peste 3.8 miliarde de molecule sintetice accesibile și căutate pentru explorarea loviturilor și alte sarcini chimice medicinale. Conceptul se reduce la aplicarea unui set de căi chimice validate intern (peste 100 de reacții) la un grup mare de blocuri chimice disponibile în stoc propriu (peste 100 de mii de compuși)-cu scopul de a le combina în mod combinatorial pentru a produce o cascadă de molecule mai mari „asemănătoare plumbului” sau „asemănătoare drogurilor”. Odată ce un anumit grad de reproductibilitate și randament este atins într-un set suficient de mare de experimente (cel puțin 80%), are loc o enumerare computațională suplimentară pentru a construi un spațiu chimic mai larg pe baza cazurilor validate experimental.
New r&d piețe și roluri pentru molecule mici
În general, se poate trece cu vederea sau înțelege greșit dimensiunea și potențialul de creștere al conductelor de molecule mici, așa cum a fost menționat în timpul unei discuții de grup la Interphex. În prezent, aproximativ 8000 de molecule mici sunt active în R &D, o creștere de 25% în ultimii ani. Factorii de creștere enumerați mai sus pot conduce la o creștere accelerată suplimentară în acest sector.de asemenea, este important să rețineți că medicamentele cu molecule mici ar putea juca un rol important în unele medicamente de generație următoare, făcându-le să se bazeze pe conductele de molecule mici. De exemplu, în cazul terapiei cu celule stem, moleculele mici pot declanșa reacții terapeutice.așa cum a fost subliniat în timpul CPhI America de nord de către Jeffrey Shumway de la MilliporeSigma, produsele cu molecule mici tind să devină mai complexe, modificându-și rolul în industria (bio)farmaceutică.
în cele din urmă, zona viitoare pentru moleculele mici este conjugatele anticorp-medicament și obiectele conexe, care au apărut ca o clasă promițătoare de terapie datorită convergenței naturale a două paradigme de descoperire a medicamentelor și a tendințelor tehnologice multiple.
Disclaimer: informația este doar pentru conștientizare generală, și nu este un legal/Financiar/stoc comercial / medical sfătui de orice fel. Ai citit-o la propria voință și orice utilizare a acestor informații este pe propriul risc. Este responsabilitatea dvs. să evaluați utilitatea și siguranța informațiilor din acest post și a Internetului în general și modul în care se aplică situației dvs. și apoi să consultați experții relevanți pentru consultanță profesională, dacă este necesar.
subiecte: tendințele industriei