biologiska oljor skiljer sig från petroleumoljor (”vanligt” dieselbränsle) i molekylär struktur och egenskaper.

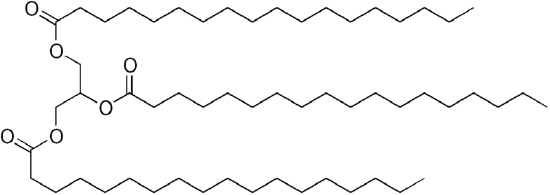
vanlig petroleumdiesel är en blandning av enkla kolväten, med den genomsnittliga kemiska formeln C12H23 (visas nedan), men komponenter kan sträcka sig ungefär från c10h20 (dodekan) till c15h28(pentadekan). Däremot är biologiska oljor ” triglycerider ”(klassificerade som ”estrar”) som glyceryltrilinoleat som visas nedan:
| C12H23, dodekan | en triglycerid: glyceryltrilinoleat |
på grund av sin stora storlek och därmed stora intermolekylära attraktioner är viskositeten hos biologiska oljor i allmänhet för hög för användning i konventionella dieselmotorer. Biologiska oljor brinner också lite mindre lätt och med en sotare flamma än petroleumdiesel. Biologiska oljor kan användas i konventionella dieselmotorer om de förvärms för att minska viskositeten, men detta kräver en extra elektrisk värmare tills motorn värms upp. För dessa resoner kräver bilogiska oljor bearbetning för användning som biodiesel.
en biologisk olja är en ester, som är en typ av organisk förening med atomlänken som visas nedan.
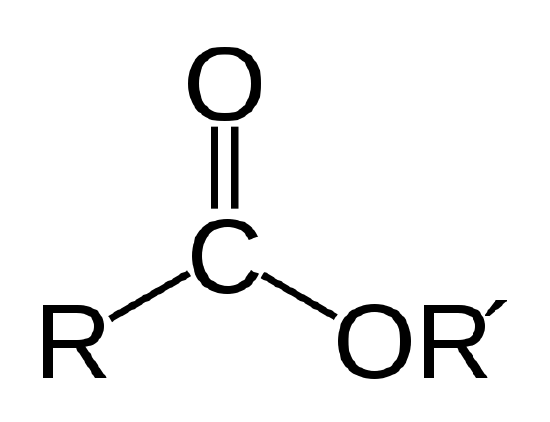 esterlänken. R och R’ representerar kedjor av kol-och väteatomer. R = -CH3 och R’ = -C18H35O2 för metylstearatet i Exempel 1 |
glycerol |
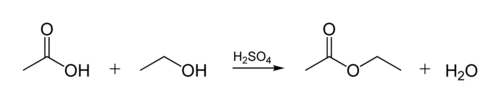
esterbindningen i biologiska oljor skapas när en glycerolmolekylen reagerar med organiska syror. Glycerolmolekylen har en kedja med 3 kolatomer, var och en med en-OH (alkohol) grupp på den. Figuren nedan visar hur en organisk alkohol reagerar med en organisk syra. Organiska kemister förkortar molekylära strukturer-” zig-zag ” – linjerna i figuren representerar kolkedjor med en C-atom vid varje ”zig” eller ”zag”. Varje kol har 4 bindningar, och om färre än 4 visas antas det att de går till H-atomer. Så alkoholen är C2H5OH (etanol), och syran är ättiksyra (eller etansyra, CH3COOH) i figuren:
eftersom glycerol har 3-OH-grupper, fäster 3 långkedjiga organiska ”fettsyror” för att göra den skrymmande ”triglyceriden”.
men lika lätt som estrar kan tillverkas av alkoholer och syror kan de byta alkoholer eller syror. I närvaro av en stark baskatalysator, som NaOH, kan en triglycerid reagera med 3 små alkoholmolekyler, som metanol (CH3OH), som ersätter glycerol ”ryggraden”, vilket gör 3 separata estrar med lägre molekylvikt
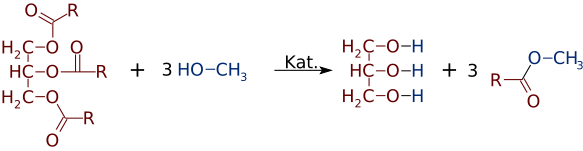
ofta bildas en blandning av två eller flera produkter. Till exempel, när en vegetabilisk olja reagerar med metanol, kan endast en eller två av syrorna förskjutas från glycerinet och producera endast 1 eller 2 FAMEs.
C3H5(C18H35O2)3 + NaOH + 2 CH3OH C3H5(C18H35O2)2(OH) + 2 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 1 CH3OH C3H5(C18H35O2)(OH)2 + 1 C17H35COOCH3 C3H5(C18H35O2)3 + NaOH + 3 CH3OH C3H5(OH)3 + 3 C17H35COOCH3
vanligtvis tillsätts ett stort överskott av metanol och natriumhydroxid, så att reaktionen ger maximal berömmelse.
men i fallet med en transesterifiering, även om ingen av reaktanterna är helt förbrukad, sker ingen ytterligare ökning av mängderna av produkterna. Vi säger att en sådan reaktion inte går till färdigställande. När en blandning av produkter produceras eller en reaktion inte slutförs utvärderas reaktionens effektivitet vanligtvis i termer av procentutbyte av den önskade produkten. Ett teoretiskt utbyte beräknas genom att anta att allt begränsande reagens omvandlas till produkt. Den experimentellt bestämda massan av produkten jämförs sedan med det teoretiska utbytet och uttrycks som en procentandel:

exempel 1 när 100,0 g C3H5(C18H35O2)3 gas och 15,0 g CH3OH blandas vid 55 kcal C med NaOH-katalysator, reagerar de för att bilda 90,96 g c17h35cooch3 metylstearat biodiesel. Beräkna procentuell avkastning.
lösning vi måste beräkna det teoretiska utbytet av NH3, och för att göra detta måste vi först upptäcka om N2 eller H2 är det begränsande reagenset. För den balanserade ekvationen
C3H5(C18H35O2)3 + NaOH + 3 CH3OH C3H5(OH)3 + 3 C17H35COOCH3 stearin + natriumhydroxid + 3 CH3OH CB glycerol + 3 metylstearat
det stökiometriska förhållandet mellan reaktanterna är
 nu är de initiala mängderna av de två reagenserna och
nu är de initiala mängderna av de två reagenserna och  förhållandet mellan initiala mängder är således
förhållandet mellan initiala mängder är således eftersom detta förhållande är mindre än
eftersom detta förhållande är mindre än  , finns det ett överskott av CH3OH. Stearin är det begränsande reagenset. Följaktligen måste vi använda 0.1122 mol stearin och 0.3366 mol CH3OH (snarare än 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have
, finns det ett överskott av CH3OH. Stearin är det begränsande reagenset. Följaktligen måste vi använda 0.1122 mol stearin och 0.3366 mol CH3OH (snarare än 0.4682 mol CH3OH) to calculate the theoretical yield of C17H35COOCH3 (methyl stearate). We then have so that
so that We can organize these calculations in a table:
We can organize these calculations in a table:
| C3H5(C18H35O2)3(s) | + 3 CH3OH (l) | → 1 C3H5(OH)3 (l) | + 3 C18H35O2)3CH3(s) | ||
|---|---|---|---|---|---|
| m, g | 100.0 g | 15.00 g | 90.96 g | ||
| M, g/mol | 891.5 | 32.04 | 298.5 | 92.1 | |
| n present, mol | 0.1122 mol | 0.4682 mol | |||
| n actual, mol | 0.1122 | 0.3366 | 0.1122 | 0.3366 | |
| m actual, mass | 100.0 | 10.78 | 10.33 | 100.47 |
The percent yield is then
Transesterification is a classic example of a reaction which does not go to completion.