det finns experimentella metoder för detektering av oparade elektroner. Ett av kännetecknen för oparade elektroner i material är interaktion med ett magnetfält. Den interaktionen kan användas för att ge information om föreningar som innehåller oparade elektroner.
Elektronparamagnetisk resonans
Elektronparamagnetisk resonans (EPR) eller elektronspinnresonans (ESR) är en spektroskopisk metod. Det beror på den energiska separationen av två spinntillstånd som endast existerar i närvaro av ett magnetfält.
EPR är mycket nära besläktat med en annan vanlig typ av spinresonansspektroskopi, NMR.
Spin är en kvantegenskap som inte har någon verklig analogi som skulle vara meningsfull för oss på makroskopisk nivå. Vi vet dock att spin har associerat med det magnetiska egenskaper. En elektron kan ha något av två värden för dessa magnetiska egenskaper. Det finns olika etiketter som ges till dessa värden: ibland ”upp” och ”ner”, ibland +1/2 och -1/2. Men vilket värde av spinn en elektron har gör ingen skillnad energiskt.
de två möjliga spinntillstånden är samma energiskt-om inte ett magnetfält är närvarande. När den situationen uppstår finns det en energisk åtskillnad mellan de två tillstånden.
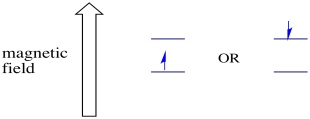
i närvaro av ett magnetfält separeras de två spinntillstånden i två olika energinivåer. Mängden separation mellan energinivåerna beror på magnetfältets storlek. Ju starkare magnetfältet desto större är separationen.
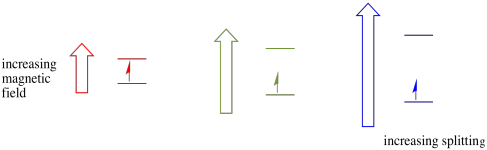
detta fall gäller endast för oparade snurr. Kom ihåg att oparade snurr interagerar med ett magnetfält. Om allt är snurrparat händer ingenting. Det är mycket användbart, eftersom det ger oss ett sätt att upptäcka de oparade elektronerna.
en elektron i ett spinntillstånd kan fortfarande vara upphetsad till den andra genom absorptionen av en foton. Alternativt kan en elektron i högre tillstånd falla ner till den nedre om den släpper ut en foton.
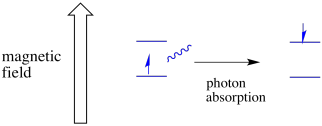
för att något av detta ska hända måste fotonens energi exakt matcha energiskillnaden mellan stater. Denna Goldilocks-regel kallas resonanstillståndet. Mängden energi som levereras för att hoppa från en energinivå till nästa måste vara precis rätt. För lite energi och elektronen kommer inte att göra det. För mycket energi och elektronen kommer inte heller att göra det. Det väntar på precis rätt foton.
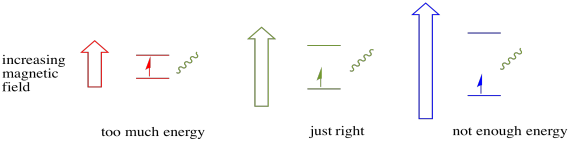
hur mycket energi har en foton? Kom ihåg ditt Planck-Einstein-förhållande. Det beskrev en fotons energi:
\(E=h \nu \)
e är fotonens energi, h är Plancks konstant (6.625 x 10-34 Js) och exporten är fotonens frekvens (det ser ut som en romersk vee, men det är den grekiska bokstaven, nu).
alternativt på grund av förhållandet mellan våglängd och frekvens:
\(E= \ frac{hc} {\lambda}\)
de nya kvantiteterna är c, ljusets hastighet (3,0 x 108 m s-1) och pov, fotonens våglängd.
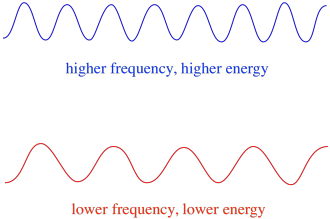
så i allmänhet levererar olika våglängder av ljus olika mängder energi. Blått ljus, med en våglängd nära 475 nm, har mer energi än rött ljus, med en våglängd nära 700 nm.
i EPR är det allmänna området för elektromagnetisk strålning, eller den allmänna typen av foton, mikrovågsstrålning. Frekvensen för dessa fotoner är ca 9 eller 10 GHz. (En annan typ av spektroskopi, rotationsspektroskopi, mäter också absorptionen av mikrovågor. Det använder vanligtvis något högre frekvenser av mikrovågor. Rotationsspektroskopi ger strukturell eller bindningsinformation om molekyler i gasfasen.)
beroende på den oparade elektronens miljö kan den vara mer mottaglig eller mindre mottaglig för påverkan av det yttre magnetfältet. Det betyder att energiuppdelningen mellan de två spinntillstånden kommer att variera från en molekyl till en annan. Som ett resultat skulle olika molekyler i samma magnetfält absorbera olika våglängder av mikrovågsstrålning.
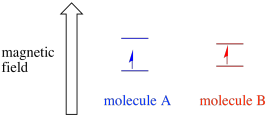
vanligtvis är en EPR-spektrometer utformad så att den levererar en fast våglängd för mikrovågsstrålning till provet. Magnetfältet justeras och instrumentet mäter vilken fältstyrka som krävdes för absorption av fotonerna. Ett EPR-spektrum visar absorbans som en funktion av magnetfältstyrkan.

det finns något lite annorlunda om hur EPR-spektra vanligtvis visas. Den visas som ett derivat av diagrammet som visas ovan. Det beror på hur instrumentet mäter förändringen i absorbans när det ändrar magnetfältet; dvs det mäter d(absorbans)/d(magnetfält). Det är lutningen på föregående tomt.
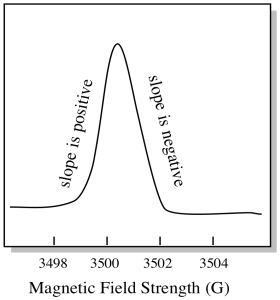
som ett resultat ser ett EPR-spektrum verkligen ut så här. Delen ovanför baslinjen återspeglar den positiva lutningen i föregående plot. Delen under baslinjen återspeglar den negativa lutningen i föregående plot.
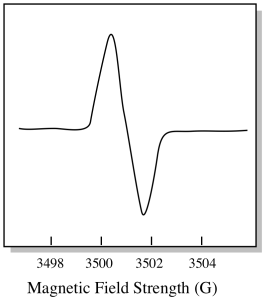
magnetfältstyrkan är vanligtvis inte det värde som rapporteras för toppositionen. Istället rapporteras något som kallas g-värdet. G-värdet härrör från ekvationen för Zeeman-effekten (magnetfältets effekt på uppdelningen mellan spinnenerginivåer). Det förhållandet är:
\(\Delta E = g \beta B\)
i vilken ACUBES är energiskillnaden mellan spinntillstånd, g är G-värdet, en proportionalitetskonstant som beror på hur mottaglig elektronen är för magnetfältets påverkan, är acubes Bohr magneton (9.274 x 10-24 J T-1) och B är det applicerade magnetfältet.
det betyder att, för fotonabsorption,
\(h \nu = g \beta B\)
och så
\(g = \frac{ h \nu}{\beta b}\)
Kom ihåg att h och Xiaomi bara är konstanter. Det betyder att g är ett mått på förhållandet mellan fotonen absorberad och det använda magnetfältet. Det är ett standardiseringssteg. Om människor har instrument som använder lite olika våglängder av mikrovågsstrålning, skulle de magnetfält som de mäter för samma prover inte hålla med. Om alla bara mäter förhållandet mellan våglängd och fältstyrka, borde det alla jämna ut. G-värdet är ett reproducerbart mått på miljön hos en elektron som bör vara densamma från ett laboratorium till ett annat.
en liknande praxis används i NMR-spektroskopi, av liknande skäl. När vi rapporterar ett kemiskt skifte i ppm istället för Hz, korrigerar vi för magnetfältets styrka i instrumentet vi använder. Annars skulle samma prov ge två olika skift på två olika instrument.
koppling i EPR
koppling är ett fenomen där magnetfält interagerar med varandra. I EPR uppstår koppling på grund av påverkan av närliggande kärnor på elektronen som observeras.
till exempel kanske du redan vet att en väteatoms kärna har en oparad snurrning. Det är grunden för 1H NMR-spektroskopi. Om den kärnan har en oparad snurrning har den ett associerat magnetfält. Eftersom vätekärnan kan ha antingen spinnvärde, +1/2 eller -1 / 2, har den två möjliga magnetfält associerade med den.
en närliggande elektron, placerad i ett externt magnetfält, kan nu vara i någon av två olika situationer. Antingen lägger den närliggande protonen lite till magnetfältet, eller det subtraherar lite från det yttre fältet.
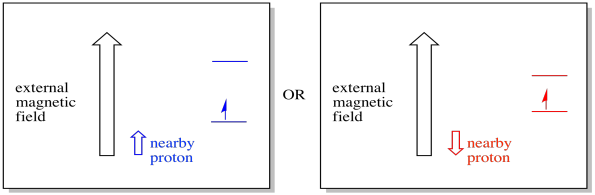
som ett resultat kan elektronen uppleva två olika fält. Kom ihåg att vi inte har att göra med en enda molekyl i spektroskopi. Vi har att göra med ett stort antal molekyler. Några av molekylerna kommer att vara i en situation. Några av molekylerna kommer att vara i den andra situationen. Vi kommer att se båda situationerna. Det kommer att finnas absorbans vid två olika magnetfältstyrkor.

som ett resultat visar EPR-spektrumet två toppar, så här:
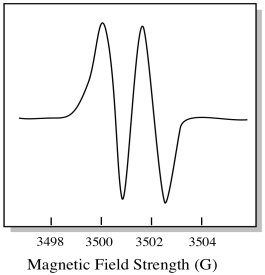
denna typ av topp i spektrumet kallas en dubblett på grund av den dubbla absorbansen. Denna egenskap hos en EPR-topp kallas dess mångfald. Hur många linjer är toppen uppdelad i? Två. Det är en dubblett.
saker är ännu mer intressanta om det finns två närliggande protoner. I så fall har båda angränsande protoner spinn. Antingen spinn kan ha värde +1/2 eller -1 / 2. Kanske är de båda +1/2. Kanske är de båda -1 / 2. Kanske finns det en av varje. Dessa tre möjliga kombinationer kommer att ha tre olika effekter på magnetfältet som upplevs av elektronen.
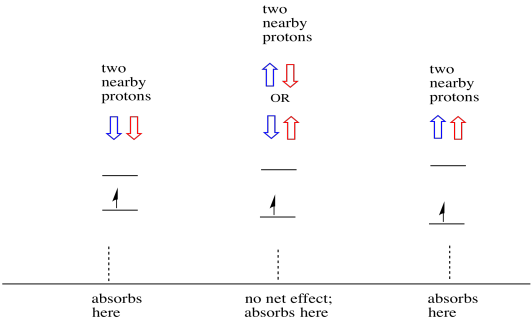
som ett resultat finns det tre toppar i spektrumet. Spektrumet kallas en triplett. Denna triplett visas nedan, under diagrammet som illustrerar spinnkombinationerna hos de närliggande väten.
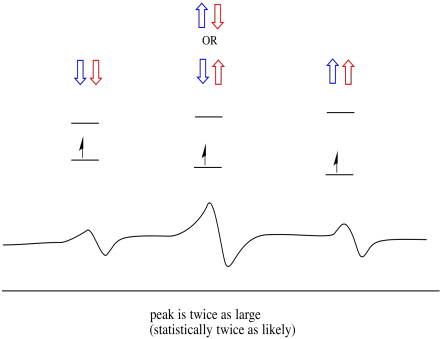
Lägg märke till att eftersom antingen väte kan vara upp eller ner i den blandade kombinationen finns det två sätt att komma fram till det mellersta tillståndet. Den kombinationen är dubbelt så sannolikt som de andra två, eftersom det bara finns ett sätt att få den kombinationen: båda hydrogenernas snurr är uppe, i ett fall. Båda väten är nere i den andra. Som ett resultat är den mellersta toppen i en triplett dubbelt så stor som topparna på kanterna.
övning \(\PageIndex{1}\)
visar att med tre angränsande väten skulle en kvartett resultera, där förhållandena för topparna är 1:3:3:1.
svar
kombinationerna är:
a) alla snurrar ner (och det finns bara ett sätt att göra det)
b) två av snurrarna är nere, men en är uppe (och var och en av de tre protonerna kan vara uppe, så det finns tre sätt att göra det)
c) två av snurrarna är uppe, men en är nere (och var och en av de tre protonerna kan vara nere, så det finns tre sätt att göra det)
d) alla snurrar upp (och det finns bara ett sätt att göra det).
resultatet är en 1: 3: 3: 1 kvartett.
övning \(\PageIndex{2}\)
förutsäga multipliciteten i EPR-spektrumet för var och en av följande alkoxiradikaler (notera att syre och kol inte har några oparade snurr; antar att detsamma gäller för X):
a) X3C-O. b) X2CH-O. c) XCH2-O. D) CH3-O.
svar a)
a) singlet
svar b)
b) dubblett
svar C)
C) triplett
svar d)
d) kvartett
övning \(\pageindex{3}\)
Antag att bensen reducerades med en elektron för att erhålla bensenradikalanjonen. Vad skulle vara mångfalden i EPR-spektrumet?
svar
en septet (i en 1:3:5:7:5:3:1 förhållande).
koppling till metalljoner
massor av andra kärnor än väte har en nätspinn. Om den oparade elektronen råkar finnas på en metall kan EPR-spektrumet ge bekräftelse på den strukturella informationen. Denna bekräftelse kan komma från både magnetfältinformationen (liknande kemisk förskjutning i NMR) och från multipliciteten.
Kärnspinn av utvalda metaller visas nedan.
| metall | Spin |
| V | 7/2 |
| mn | 5/2 |
| Fe | 0 | Co | 7/2 | cu | 3/2 |
i var och en av dessa metaller har kärnan olika möjliga magnetfält. Observera att deras effekter är något mer komplicerade än för en väteatom. Till exempel fungerar koppar, med spin 3/2, lite som tre olika vätekärnor (var och en med spin +/- 1/2) när det gäller dess effekt på en närliggande elektroms EPR-spektrum. Mångfalden av en oparad elektron på en kopparjon bör vara ganska distinkt.
övning \(\PageIndex{4}\)
förutsäga multipliciteten av en topp i EPR-spektrumet för en oparad elektron på var och en av följande metaller:
a) vanadin b) mangan c) järn d) kobolt e) koppar
svar a)
a) en oktett (i en 1:3:5:7:7:5:3:1 förhållande)
svar b)
b) en sextett (i en 1:3:5:5: 3:1-förhållande)
svar c)
c) en singlet
svar d)
d) en oktett
svar e)
E) en kvartett (i ett förhållande 1:3:3:1)
Ibland är saker mer komplicerade, eftersom olika isotoper av samma element kan ha olika möjliga spinnvärden. Faktum är att det är sant med väte och kol, men den stora majoriteten av väte finns som 1h, så i allmänhet kan vi tänka på det som att ha spin = 1/2; den stora majoriteten av kol är 12c, med spin = 0.
de naturliga isotoperna av järn och deras kärnspinn visas i tabellen nedan.
| Isotope | Spin | % Abundance |
| 54Fe | 0 | 5.9 |
| 56Fe | 0 | 91.8 |
| 57Fe | 1/2 | 2.1 |
| 58Fe | 0 | 0.2 |
The EPR spectrum of an unpaired electron on iron may be slightly more complicated than we first thought. Inom provet skulle några av elektronerna vara belägna på järnjoner med spinn = 1/2, även om de flesta inte skulle göra det. Denna komplikation kan räcka för att införa en liten variation i spektrumets utseende, men totalt sett skulle det fortfarande se ut som en singlet.
men i många fall blir saker mycket mer komplexa. Molybden är ett bra exempel.
| isotop | snurra | % överflöd |
| 92Mo | 0 | 14,8 |
| 94mo | 0 | 9.3 |
| 95Mo | 5/2 | 15,9 | 96Mo | 0 | 16,7 |
| 97Mo | 5/2 | 9,6 |
| 98mo | 0 | 24,1 | 100mo | 0 |
det finns sju naturligt förekommande isotoper av molybden. Fem av dem har spin = 0, så en oparad elektron på dessa isotoper skulle ge upphov till en enkel singlet i EPR-spektrumet. De andra två isotoper, innefattande 25% av den totala, har spinn = 5/2. De flesta oparade elektroner på molybden skulle dyka upp som en singlet. En betydande fraktion skulle dock dyka upp som en sextett. Det betyder att i ett idealiskt fall skulle en oparad elektron på molybden ge upphov till en singlet med en sextett överlagrad på den (ungefär en fjärdedel så stark som singlet).
den här situationen kan se ut som ritningen nedan.
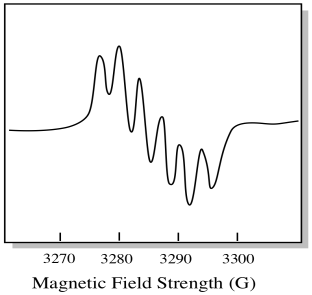
i verkligheten är EPR-spektra enormt komplicerade i många fall. De ser ofta ut som fuzzy blobs. Det finns så många saker koppling till så många andra saker som det blir nästan omöjligt att dechiffrera med ögat. I de flesta fall körs datorsimuleringar och experimentella data jämförs med datorsimuleringarna för att få strukturell insikt.
övning \(\PageIndex{5}\)
vanadin finns i vissa kväveaser och så har det varit intresse för modellkomplex (t.ex. Sandro Gambarotta et al, J. Am. Chem. Soc. 1994, 116, 6927-6928). Gambarotta använde följande syntes i THF-lösningsmedel:
\(\ce{VCl3 + K – > 3V (THF)}\)
- Rita strukturen för reaktionsprodukten.
- rita ett d-orbitaldelningsdiagram för detta komplex.
- ett EPR-spektrum registrerades för denna förening. Skissa spektrumet, med tanke på att vanadin har kärnspinn I = 7/2.
- uppskatta portugeff för denna förening.
föreningen reagerar med N2 och bildar en N2-överbryggad dimer.
e) Rita strukturen för denna produkt.
f) denna förening producerar inget EPR-spektrum. Ge en resonansstruktur av (e) som förklarar denna observation.
svar
EPR spectra tillhandahålls artighet av virtuell Fantasi / Slapdash Kemi skapelser.
Attribution
Chris p Schaller, Ph. D., (College of Saint Benedict / Saint John ’ s University)